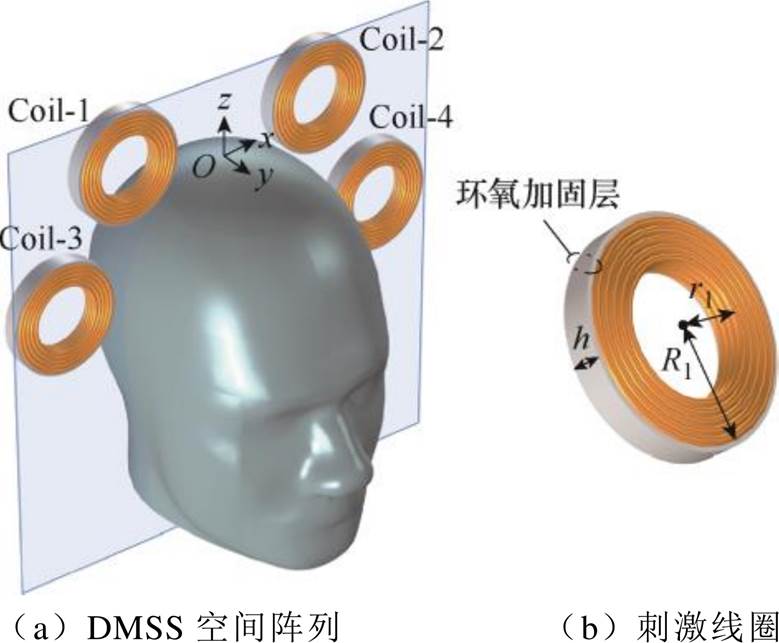
图1 DMSS空间阵列及其刺激线圈三维模型
Fig.1 3D model of the DMSS spatial array and its stimulation coil
摘要 传统经颅磁刺激(TMS)系统只含有一种频率的脉冲刺激电流,且刺激线圈多为平面结构,在颅内产生的感应电场呈弥散性分布,聚焦场位于头皮下方2 cm左右,随着刺激深度的增加,聚焦性急剧削弱。为改善TMS的深部刺激效果,该文提出一种基于时域干涉效应的深部磁刺激系统(DMSS)。首先,提出了含四个垂直于水平面且与头部相切放置的DMSS空间阵列,该结构可实现多路感应电场叠加,减小颅内电场非纵向分量积累,提高深部聚焦性。其次,针对性地设计了双频多通道脉冲刺激电路,以向空间阵列稳定输出两路存在差频的脉冲刺激电流。然后,采用有限元数值分析得到时域干涉刺激模式下DMSS空间阵列产生的颅内干涉电场时空分布。结果表明,DMSS可在头皮下方6 cm的深部靶区产生明显的聚焦场,改善颅内电场空间分布形态。在相同刺激条件下,与传统TMS系统相比,DMSS可将颅内纵向衰减率提高2.5倍、刺激深度提高4 cm,获得深部刺激加强、浅层刺激削弱的效果。最后,搭建低参数实验平台,利用探测线圈测量DMSS产生的干涉电场时空分布,验证了该设计的可行性。
关键词:干涉电场 空间阵列 差频刺激 经颅磁刺激 聚焦
经颅磁刺激(Transcranial Magnetic Stimulation, TMS)技术是一种基于电磁感应原理的无创型颅脑神经调控技术,被广泛应用于抑郁症、焦虑症等精神疾病的临床治疗和神经科学研究[1-3]。TMS系统的核心组成是刺激线圈和刺激电路。在治疗过程中,刺激线圈置于人体头部靶区附近,刺激电路通过向线圈施加高频脉冲电流,在周围空间产生动态磁场。由于人体头部生物组织的电导率、磁导率不为零,动态磁场在颅内靶区产生感应电场,改变神经元膜电位,起到神经调控的作用[4-7]。
深部脑区神经调节机制研究是治疗精神疾病、探索精神疾病成因的关键,利用TMS技术精准刺激深脑靶区,如海马体、杏仁核等成为目前TMS技术的热点应用之一,极具科学研究价值。然而,传统TMS系统的有效刺激深度为头皮下方1.5~2 cm,可实现皮质兴奋性调节,但难以在头皮下方4~8 cm深部脑区诱导产生超过神经元兴奋阈值的感应电场[8-9]。作为研究抑郁症的关键神经基础,前额叶皮层腹内侧区域位于头皮下方7 cm深度处,远远超出传统TMS系统的调控范围[10-11]。
近年来,为提高TMS系统的深脑刺激性能,国内外研究学者对TMS系统内的刺激线圈做出了诸多改良设计。2002—2018年,文献[12-16]提出的一系列H线圈是以改善刺激深度为目标的典型TMS深脑线圈设计。H线圈由携带“向前”刺激电流的基底单元和携带“远离”基底刺激电流的回流单元构成。H线圈在靶区产生的非切向电场分量被最小化,从而提高了电场穿透能力,刺激深度可达头皮下方3~6 cm。然而,在相同刺激条件下,H线圈作用下颅内被刺激的脑组织体积是传统TMS系统中八字形刺激线圈(Figure of Eight Coil, FOE)的6倍。2017年,李江涛等提出一种直线型刺激阵列,可将刺激深度提升至3 cm[17]。2019年,P. Rastogi等提出三重光环线圈(Triple Halo Coil, THC),该线圈刺激深度可达到深脑区的海马体和杏仁核,但其具有显著的局限性,当刺激深层区域时,表层区域也将受到较强刺激,刺激范围过大[18]。2020年,M. M. Sorkhabi等提出在FOE内通入差频脉冲刺激电流,向颅内引入时域干涉效应(Temporal Interference, TI),该研究表明干涉效应可将高频脉冲感应电场传入颅内,叠加形成易于神经元响应的低频干涉电场,但由于FOE线圈产生的干涉电场纵向衰减性能欠佳,刺激深度仍局限在头皮下方2 cm内[19]。2021年,Xin Zonghao等指出在TI-TMS系统中,线圈设计会对刺激效果产生很大影响。因此,他们提出采用四线圈平面阵列向颅内引入干涉刺激的方法,结果表明相较于传统TMS系统,该设计可有效地改善刺激聚焦性,刺激深度在头皮下方2.2 cm以内[20]。2024年,J. A. V. Membrilla等基于连续电流密度反演边界元法提出了一种帽状刺激线圈。相比于传统磁刺激线圈,在产生类似刺激聚焦性时,该帽状刺激线圈可将刺激深度提高4 mm[21]。传统TMS系统产生的颅内感应电场多为高频波形,但由于神经元的低通滤波特性,难以响应高频刺激信号,且刺激深度难以满足深脑神经调控的要求。已有的深脑TMS设计多以牺牲聚焦性为代价,呈半脑或全脑刺激,难以在颅脑深部形成聚焦刺激区,降低了刺激准确性,存在诱导刺激副作用的风险。
针对深脑磁刺激现有的局限性,本文将时域干涉效应引入TMS,提出了一种适用于产生时域干涉刺激的垂直型空间阵列,并根据该阵列的结构特点及功能要求,针对性地设计了双频多通道脉冲刺激电路,由该垂直阵列及脉冲刺激电路共同组成基于时域干涉效应的深部磁刺激系统(Deep Magnetic Stimulation System, DMSS)。首先介绍DMSS空间阵列几何结构及DMSS刺激电路拓扑结构,阐述DMSS设计原理;然后采用有限元数值仿真获得DMSS阵列在颅内产生的干涉电场时空分布,并在相同激励条件下,将DMSS空间阵列与传统TMS系统进行分析对比。结果表明,本文提出的DMSS可向深部区域引入双频时域干涉电场。在时间分布上,DMSS可在深部区域形成易于神经元响应的低频干涉电场;在空间分布上,DMSS可在头皮下方6 cm及更深处产生聚焦刺激区,强化对深层组织的神经调控,弱化对浅表组织神经活动的影响。该设计可从空间、时间两个层面改善深脑刺激效果。最后搭建实验平台,测试DMSS产生的干涉电场时空分布,验证本设计的有效性。
1.1.1 几何结构
TI刺激的概念是以经颅电刺激(Transcranial Electrical Stimulation, TES)为基础提出的。TI-TES通过两组电极通道发放两个频率略有不同的正弦波刺激电流,高频刺激电流在深部靶区干涉叠加,形成易于神经元响应的等效低频包络刺激波形,并产生深脑聚焦的刺激效果。电刺激和磁刺激在干涉领域的区别主要体现在两个方面:①在时间特征上,磁刺激中干涉电场的幅值与刺激电流的变化率正相关,而电刺激中干涉电场的幅值与刺激电流的幅值正相关;②在空间特征上,电刺激中的高频电流由成对电极发送,包括一个刺激电极和一个回收电极,感应电场分布受到电极布局的约束,而在磁刺激中没有刺激电极,颅内感应电场的空间分布会受到刺激线圈空间结构的直接影响。
为模拟TI-TES的刺激效果,在xOz平面上对称放置两对磁刺激线圈,同侧的两个刺激线圈等效时域干涉电刺激中的一对电极,通入同频的刺激电流。DMSS空间阵列及其刺激线圈三维模型如图1所示,阵列内含四个几何参数相同的圆形线圈,线圈与头部相切放置,以减小颅内感应电场非纵向分量积累,提高刺激深度。各线圈径向平面均与水平面垂直,分布在人体头部两侧,有助于改善深脑聚焦效果。根据各线圈在三维坐标系中的分布,将其分别命名为Coil-1、Coil-2、Coil-3及Coil-4,圆形线圈内半径为r1,外半径为R1,宽度为R1-r1,高度为h(以上参数单位均为mm)。

图1 DMSS空间阵列及其刺激线圈三维模型
Fig.1 3D model of the DMSS spatial array and its stimulation coil
1.1.2 工作原理
DMSS空间阵列的工作原理如图2所示。图2中,黄色粗实线表示线圈导线,黑色带箭头点画线表示刺激线圈电流方向。左侧两个线圈在靶平面产生的感应电场方向如红色带箭头虚线所示,右侧两个线圈在靶平面产生的感应电场方向如绿色带箭头实线所示。左侧线圈通入频率为f1的刺激电流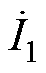 ,右侧线圈通入频率为f2=f1+Df的刺激电流
,右侧线圈通入频率为f2=f1+Df的刺激电流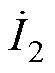 。在空间中位置r(x, y, z)处,左侧线圈产生的感应电场为E1(r),右侧线圈产生的感应电场为E2(r)。设n为三维空间内描述任意方向的单位向量,则在空间任意点,干涉电场在n方向上的分量ETI(n, r)可表示为E1(r)和E2(r)在n方向上的矢量和,干涉电场幅值可记为|ETI(n, r)|。干涉电场工作原理可描述为
。在空间中位置r(x, y, z)处,左侧线圈产生的感应电场为E1(r),右侧线圈产生的感应电场为E2(r)。设n为三维空间内描述任意方向的单位向量,则在空间任意点,干涉电场在n方向上的分量ETI(n, r)可表示为E1(r)和E2(r)在n方向上的矢量和,干涉电场幅值可记为|ETI(n, r)|。干涉电场工作原理可描述为
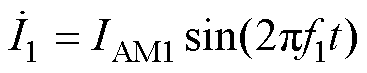 (1)
(1)
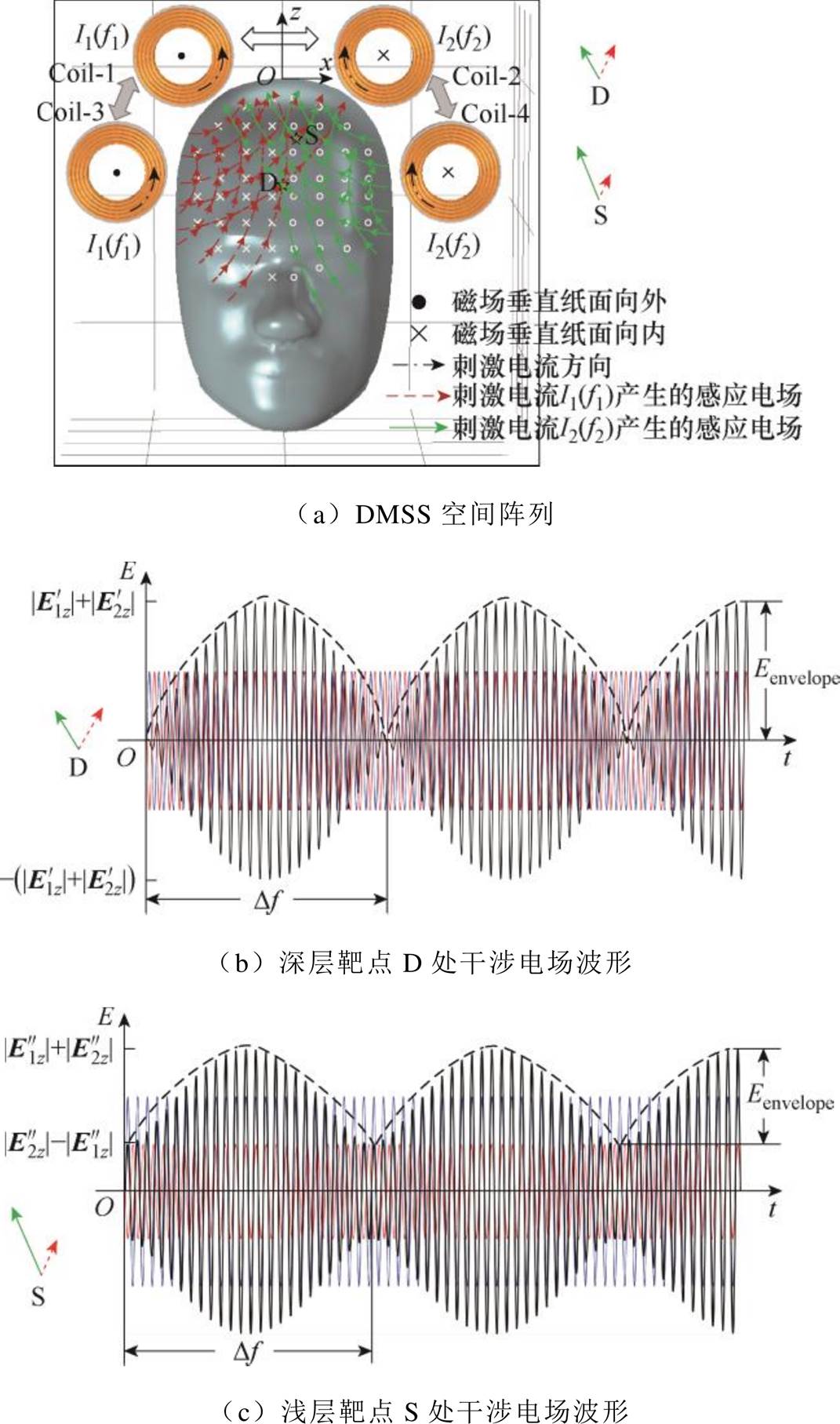
图2 DMSS空间阵列的工作原理
Fig.2 Principles of the DMSS spatial array
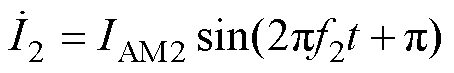 (2)
(2)
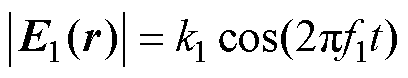 (3)
(3)
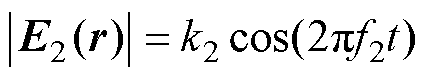 (4)
(4)
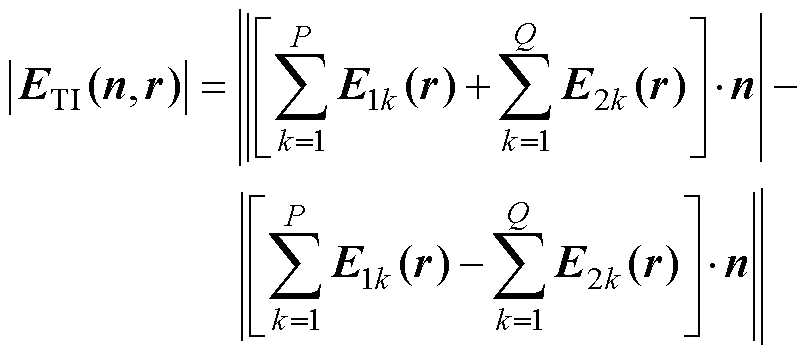 (5)
(5)
式中,IAM1和IAM2分别为两路刺激电流的幅值;k1和k2为比例系数;P、Q分别为通入刺激电流I1和通入刺激电流I2的线圈数量。
式(3)~式(5)所述干涉电场工作原理已在现有研究中得到公认[22-24],本文在此基础上根据DMSS空间阵列的几何特征对原有公式进行了调整。E1(r)和E2(r)的频率分别为f1和f2,两路不同的高频感应电场在颅内叠加,形成以(f1+f2)/2为载波频率、以Df为包络波频率的时域干涉波形ETI(n, r)。干涉电场包络波的强度Eintensity由零峰值表示,振幅调制深度Eenvelope由包络波峰峰值表示。以干涉电场z分量为例,只考虑Coil-1和Coil-2产生的干涉电场,则干涉电场强度Eintensity、包络波振幅调制深度Eenvelope可分别表示为
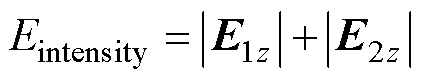 (6)
(6)
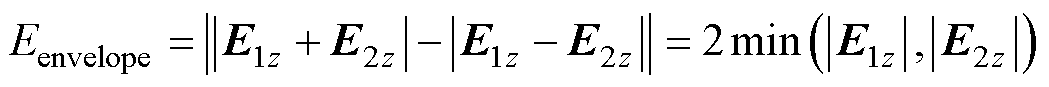 (7)
(7)
式中,E1z和E2z分别为感应电场强度E1和E2的z分量。式(6)是干涉电场包络波零峰值的定义式,在空间中任一点均成立。式(7)是干涉电场包络波峰峰值的定义式,在空间中任一点均成立。本文中阵列左侧线圈中的电流方向为逆时针,右侧线圈中的电流方向为顺时针,颅内感应电场z分量均为正。
Eenvelope呈现的是干涉电场的整体变化趋势[22],Eenvelope越大,越易于诱发神经发放动作电位。根据时域干涉叠加原理,两路感应电场在幅值和方向夹角上的差异会导致叠加产生的包络波振幅调制深度Eenvelope的不同,且只有当两路感应电场幅值差异、方向夹角较小时,所合成的干涉电场叠加包络波Eenvelope较大;当两路感应电场幅值差异较大或方向夹角较大时,所合成的干涉电场叠加包络波Eenvelope较小。当且仅当|E1z|=|E2z|时,Eenvelope有最大值,且此最大值等于Eintensity[23-24]。
当刺激电流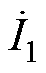 和
和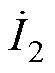 的幅值相等时,在深部靶区处取点D,该点与左右两侧线圈距离相等,则两侧刺激线圈在D点产生的感应电场矢量幅值差异较小、方向夹角较小,所合成的干涉电场强度较强,在D点处有
的幅值相等时,在深部靶区处取点D,该点与左右两侧线圈距离相等,则两侧刺激线圈在D点产生的感应电场矢量幅值差异较小、方向夹角较小,所合成的干涉电场强度较强,在D点处有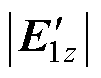 ≈
≈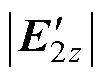 ,Eenvelope≈2
,Eenvelope≈2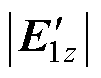 ,不完全相等的原因是E1z和E2z存在差频Df,比例系数k1
,不完全相等的原因是E1z和E2z存在差频Df,比例系数k1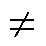 k2。在浅层靶区靠近Coil-2处取点S,该点远离中心轴,靠近右侧刺激线圈,则两路感应电场幅值差异较大、方向夹角较大,该点处合成的干涉电场强度被削弱,在S点处由于
k2。在浅层靶区靠近Coil-2处取点S,该点远离中心轴,靠近右侧刺激线圈,则两路感应电场幅值差异较大、方向夹角较大,该点处合成的干涉电场强度被削弱,在S点处由于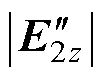 >
>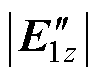 ,干涉电场调制深度Eenvelope=2
,干涉电场调制深度Eenvelope=2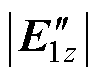 ,叠加后包络波调制深度由于干涉效应显著减小。D点和S点时域干涉叠加波形如图2b和图2c中黑色曲线所示,干涉电场包络波由黑色虚线表示。根据上述分析可知,引入干涉效应后,外周浅表层干涉电场幅值被削弱,深部颅脑中心处干涉电场幅值得到加强,可兼顾刺激深度和聚集性,实现TI-TES中选择性刺激的效果。Coil-3和Coil-4产生的干涉电场分布与此类似,通过空间阵列上、下两组差频刺激线圈的共同作用,有助于进一步强化深部刺激区域的聚焦效果。
,叠加后包络波调制深度由于干涉效应显著减小。D点和S点时域干涉叠加波形如图2b和图2c中黑色曲线所示,干涉电场包络波由黑色虚线表示。根据上述分析可知,引入干涉效应后,外周浅表层干涉电场幅值被削弱,深部颅脑中心处干涉电场幅值得到加强,可兼顾刺激深度和聚集性,实现TI-TES中选择性刺激的效果。Coil-3和Coil-4产生的干涉电场分布与此类似,通过空间阵列上、下两组差频刺激线圈的共同作用,有助于进一步强化深部刺激区域的聚焦效果。
1.2.1 拓扑结构
由于人体组织阻抗随频率的升高而降低,高频脉冲刺激电流产生的感应电场易到达人体深部区域,但细胞膜的低通滤波特性导致神经元对于高频信号的动态响应不佳。通过输出两路存在差频Df的高频脉冲刺激电流,可在深脑区域干涉叠加形成频率为Df、易于神经元响应的低频感应电场,兼顾神经元动态响应效果和刺激深度。
针对空间阵列几何结构特点,本文设计了如图3所示的双频多通道脉冲刺激电路。该电路包含两个绝缘栅双极型晶体管(Insulated Gate Bipolar Transistor, IGBT)半桥结构。两个容量为C1的储能电容和四个IGBT Q1~Q4构成第一个半桥结构,产生频率为f1的刺激电流;两个容量为C2的储能电容和四个IGBT Q5~Q8构成第二个半桥结构,产生频率为f2的刺激电流。阵列中的线圈由等效电感L和等效电阻R表示。为后续实验中测试流经刺激线圈的电流值,采样电阻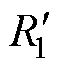 、
、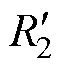 、
、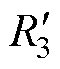 及
及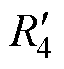 分别与各个刺激线圈串联,如图3中虚线框所示。
分别与各个刺激线圈串联,如图3中虚线框所示。
Coil-1、Coil-3与C1连接到第一个半桥放电电路中,流过频率为f1的刺激电流。Coil-2、Coil-4与C2连接到第二个半桥放电电路中,流过频率为f2的刺激电流。在该工作模式下,阵列刺激线圈以yOz平面为界分为两组,形成“左右差频刺激”。
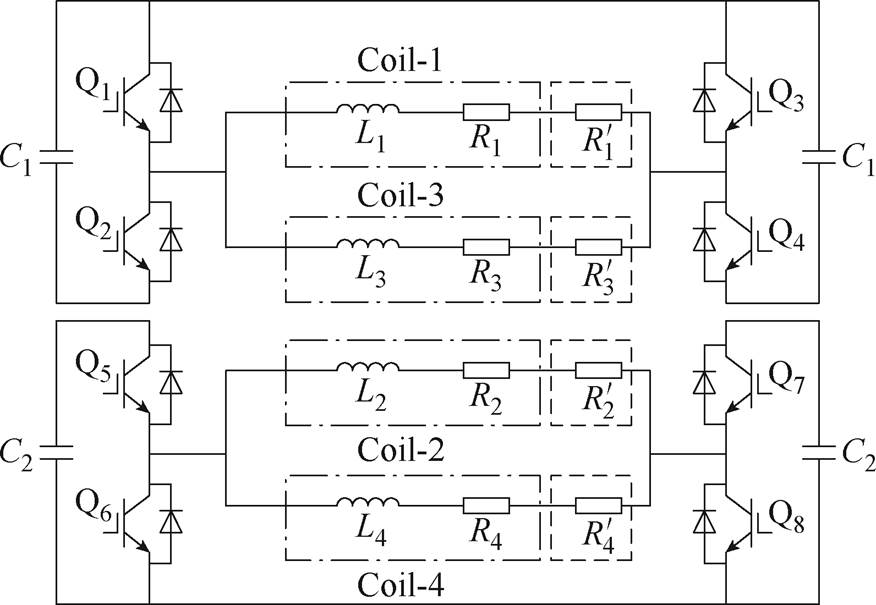
图3 双频多通道脉冲刺激电路拓扑
Fig.3 Topology of the DMSS interferometric stimulation circuit
1.2.2 工作原理
有研究提出在一个完整正弦脉冲的1/4周期内,刺激电流可看作近似直线上升,若通过控制放电开关,产生近似三角形的刺激电流,则此时产生的颅内感应电场近似矩形,该矩形波可用于进行与神经元时间-强度曲线相关的研究。另一方面,近似三角形的脉冲电流不仅可以约束线圈的短期温升,还可以提高激活神经的有效率[25]。为此,本文通过控制刺激电路中的放电开关导通状态,产生两路高频、波形近似三角形的刺激电流。
以Coil-1和Coil-3所在的半桥电路为例进行分析,一个脉冲周期内产生刺激电流的开关时序如图4所示。设储能电容C1上极板为正,刺激电流从左到右为正方向。一个完整脉冲周期内产生刺激电流的开关时序可分为六个阶段。阶段a:充电过程;阶段b:死区时间;阶段c:正向放电;阶段d:正向续流;阶段e:反向放电;阶段f:反向续流。在阶段a,直流电源Es向储能电容C1充电,Q0为充电开关,控制充电时长,继而控制充电电压幅值,Rs为限流电阻,保证充电支路的电流峰值在安全阈值以下。在阶段b,系统处于死区时间,确保充电开关完全关断,再开通放电开关。在阶段c,放电开关Q1、Q4导通,电磁能量由右侧储能电容转移到刺激线圈,刺激电流正向增加至Imax。在阶段d,放电开关均关断,刺激电流通过VD2和VD3完成续流,电流正向衰减至零。在阶段e,放电开关Q2、Q3导通,电磁能量由左侧储能电容转移到刺激线圈,刺激电流反向增加至-Imax。在阶段f,放电开关均关断,刺激电流通过VD1和VD4完成续流,电流反向衰减至零。刺激电流的脉宽由Q1~Q4的导通时间调节,因此本系统具有脉冲宽度可调的功能。
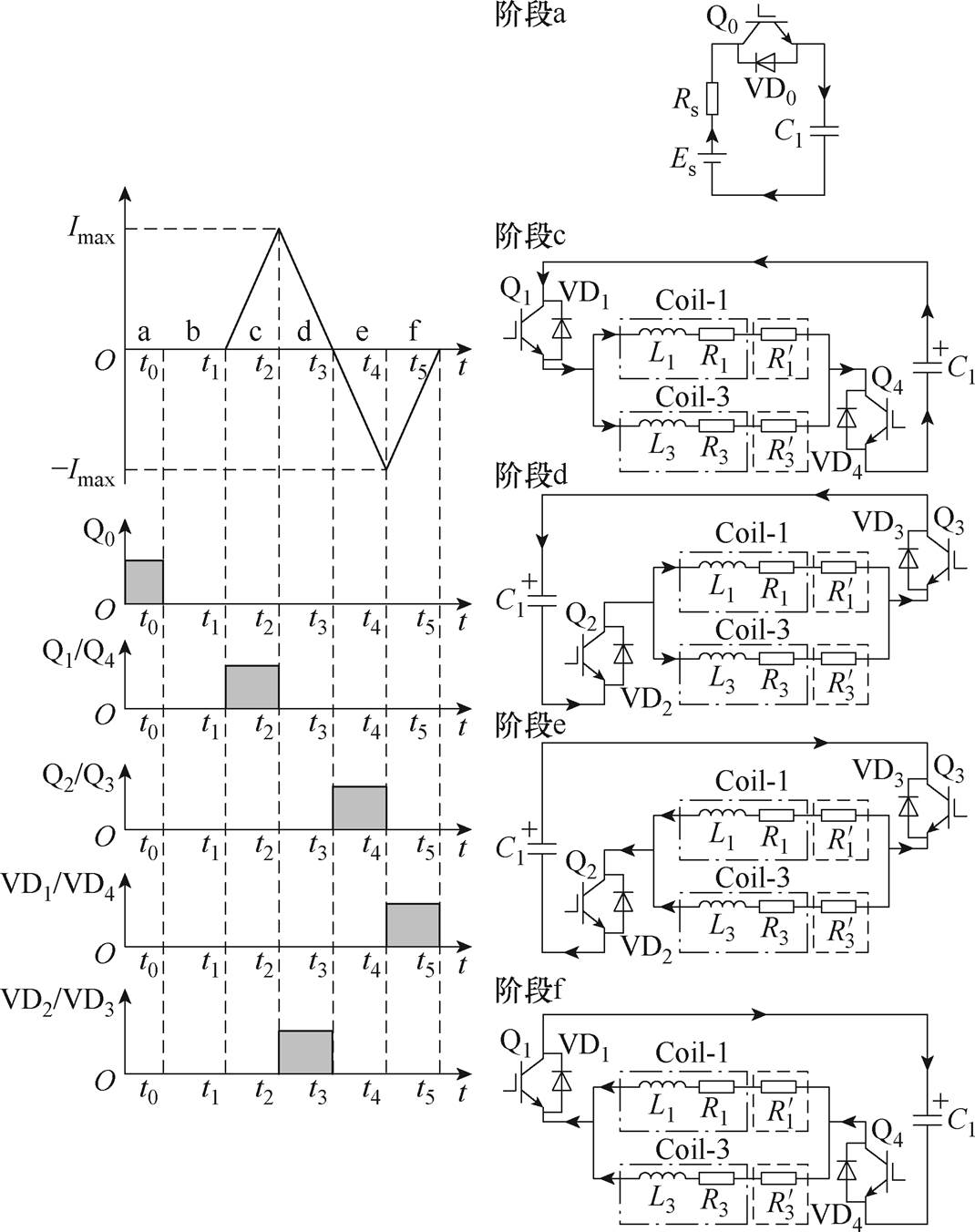
图4 放电开关时序
Fig.4 Timing of discharge switch
为研究系统刺激效果,本文采用COMSOL平台进行有限元数值计算,基于AC-DC电磁场仿真模块对所提出DMSS阵列进行三维建模,并利用瞬态求解器对颅内感应电场分布特性进行计算。DMSS阵列中的刺激线圈由线径为3 mm、电导率为5.998×107 S/m的铜线构成,线圈高度h=12 mm。选取真实头部模型作为刺激对象,人体头部模型来自COMSOL官网(http://cn.comsol.com/products),其最终几何体含有1个域、21个边界、46条边和27个顶点。人体头部被构造为均匀各向同性介质,其生物电导率为0.33 S/m。为分析颅内干涉电场的纵向分布特征,在颅内yOz平面上取半长轴为10 cm、半短轴为3.5 cm的椭圆形区域作为靶平面,选取y、z测试线以获取靶区平面感应电场空间分布特性,头部顶点与坐标原点重合,如图1a及图2a所示。
1)刺激强度:用靶平面上干涉电场强度峰值Emax(V/m)表示,刺激强度越大越有利于改变神经元膜电位,易于引起神经元动态响应[26-27]。
2)聚焦性:设靶平面上干涉电场强度峰值为Emax,靶平面上感应电场强度大于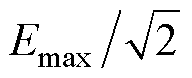 的点构成的区域称为半功率区,将该区域的面积称为聚焦面积S(cm2)。聚焦面积越小,代表刺激聚焦性越好[28-29]。
的点构成的区域称为半功率区,将该区域的面积称为聚焦面积S(cm2)。聚焦面积越小,代表刺激聚焦性越好[28-29]。
3)纵向衰减率:定义沿z测试线头皮下方2 cm的浅层刺激靶点处干涉电场强度为E2cm(V/m)、6 cm的深脑刺激靶点处干涉电场强度为E6cm(V/m),其比值即为感应电场纵向衰减率d,即d=E6cm/E2cm。d越大,表明当深脑靶点获得一定的刺激强度时,浅层非靶区生物组织承受的感应电场强度越弱,选择性刺激效果越好[30-31]。
4)刺激深度:当设置头部顶点为z坐标零点时,刺激深度为颅内感应电场最强点的纵坐标绝对值。
2.3.1 时间分布
取f1=5 000 Hz,f2=4 800 Hz,在靶平面上沿着z测试线在头皮下方深度d为4、5、6 cm处分别设置探针,提取这三点干涉电场的时域分布如图5所示。由图5可知,在不同位置处,干涉电场包络波的频率均与差频Df=200 Hz相等,且随着刺激深度的增加,干涉电场包络波幅值逐渐增强,可实现削弱浅表层电场、强化深部区电场的作用,与前述理论分析的数学模型结果(见图2)一致。
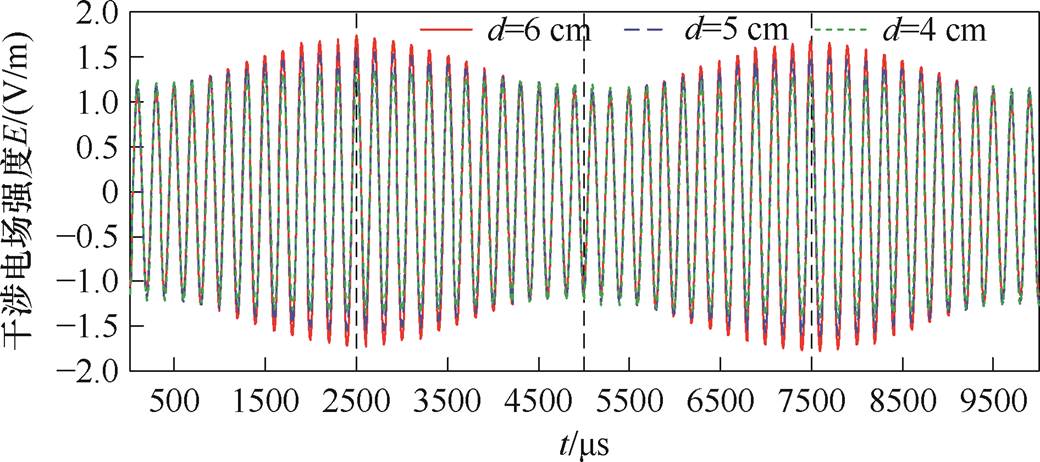
图5 不同刺激深度处的干涉电场时域分布
Fig.5 Temporal distributions of the interference electric field at different stimulation depths
2.3.2 空间分布
取f1=5 000 Hz,f2=4 800 Hz,刺激线圈由线径为3 mm、电导率为5.998×107 S/m的铜线构成,线圈高度h=12 mm,宽度为w=15 mm,总匝数为20。将线圈内半径r1由14 mm开始以3 mm为步长增加至32 mm,得到不同线圈尺寸下颅内刺激强度、聚焦性以及纵向衰减率的变化规律,如图6所示。
由图6可知,当线圈内半径r1由14 mm以步长为3 mm增加至32 mm时,颅内刺激强度增强至原来的2.4倍,纵向衰减率提高了22.4%,但是聚焦性削弱了23.5%。z轴测试线上的纵向干涉电场分布如图7所示,可知本文所提出的DMSS阵列产生干涉电场峰值点纵坐标在-6 cm及以下,即该阵列的刺激深度大于或等于6 cm,可充分满足深脑刺激的需求。另外,随着r1的增加,阵列的刺激靶点向深部区域移动,即几何尺寸较大的线圈有助于改善刺激深度,这与之前研究人员对磁刺激线圈的研究结果相吻合[28, 32]。
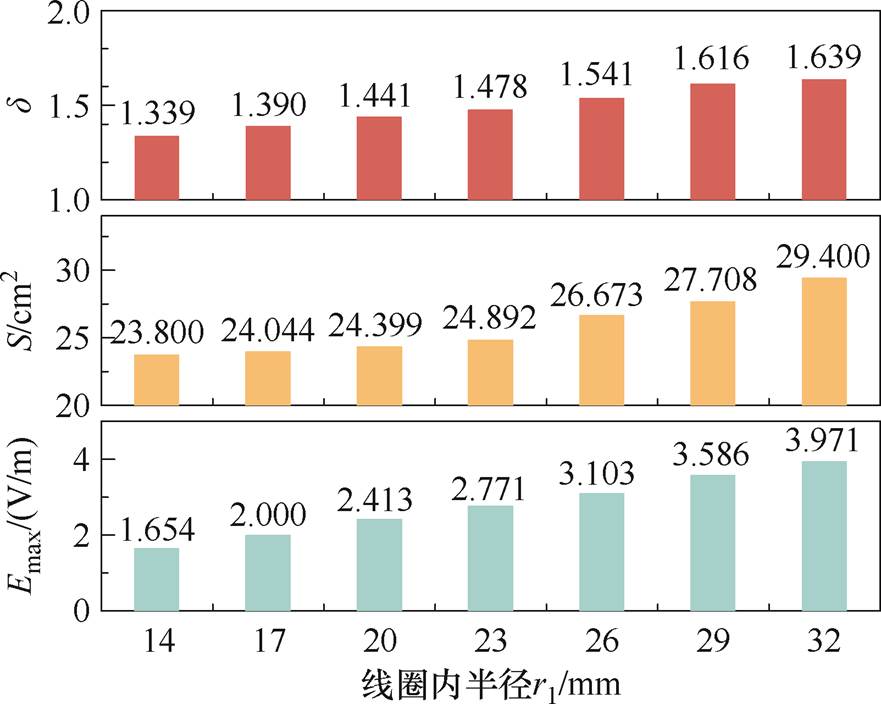
图6 不同r1下的干涉电场空间分布特性
Fig.6 Spatial distributions of the interference electric field at different coil inner radius
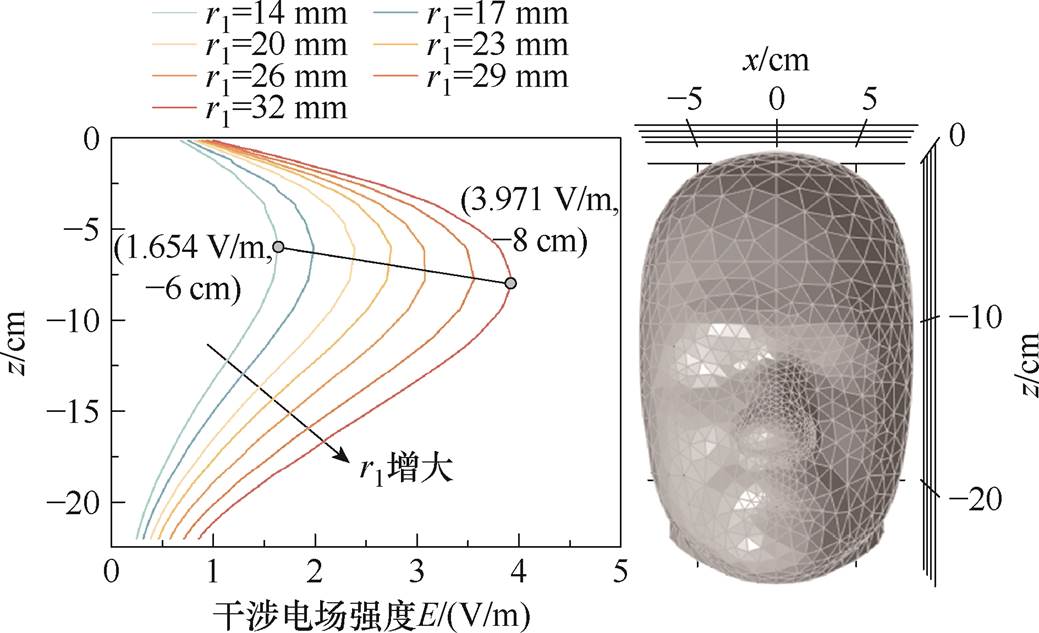
图7 不同r1下的干涉电场纵向分布
Fig.7 Longitudinal distributions of the interference electric field at different coil inner radius
2.3.3 对比讨论
为对比分析DMSS对颅内电场空间分布的优化效果,取传统FOE系统作为参考组,两个系统的线圈参数都为内半径r1=23 mm,外半径R1=38 mm,匝数为20匝,线圈高度为12 mm、宽度为15 mm,在电流频率为5 000 Hz时进行有限元数值建模。通过对比DMSS与传统FOE线圈在纵向靶区产生的聚焦场形态,突出深部聚焦刺激这一显著的优化效果。由于聚焦区电场强度不是重点关注的变量,故对DMSS和传统FOE线圈产生的感应电场数据进行了归一化处理,以便更加直观地观察空间分布特性。DMSS和传统TMS系统产生的感应电场分布如图8所示。
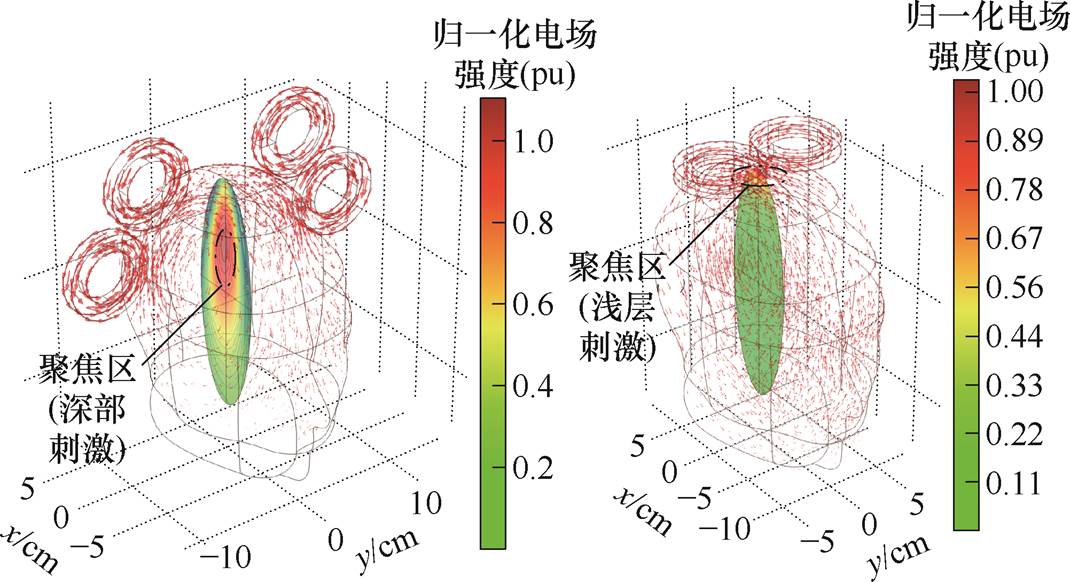
(a)DMSS (b)传统TMS系统
图8 DMSS和传统TMS系统产生的感应电场分布
Fig.8 Induced electric field distributions generated by the DMSS and the traditional TMS systems
由图8可知,本文提出的系统可在深部靶平面产生明显的聚焦区,而传统FOE系统产生的纵向衰减率为0.42,感应电场被约束在头皮下方2 cm以内的浅层区,无法实现深部聚焦。与相同线圈内半径下的TMS系统相比,DMSS可将纵向衰减率提高2.5倍,刺激深度提高4 cm以上。
为进一步验证本文设计的可行性,搭建DMSS实验平台,其示意图如图9所示。微控制器(Microcon- troller Unit, MCU)输出充电开关的驱动信号,通过控制充电开关的导通状态调节直流电源对储能电容的充电时长。电压检测模块对储能电容两端电压进行采样,当电压达到预设值时,向MCU反馈关断信号,充电过程完成。经过死区时间后,MCU按照脉冲发放时序向刺激电路中的放电开关逐一输出开通或关断信号,向DMSS阵列施加两路稳定的高频脉冲刺激电流。
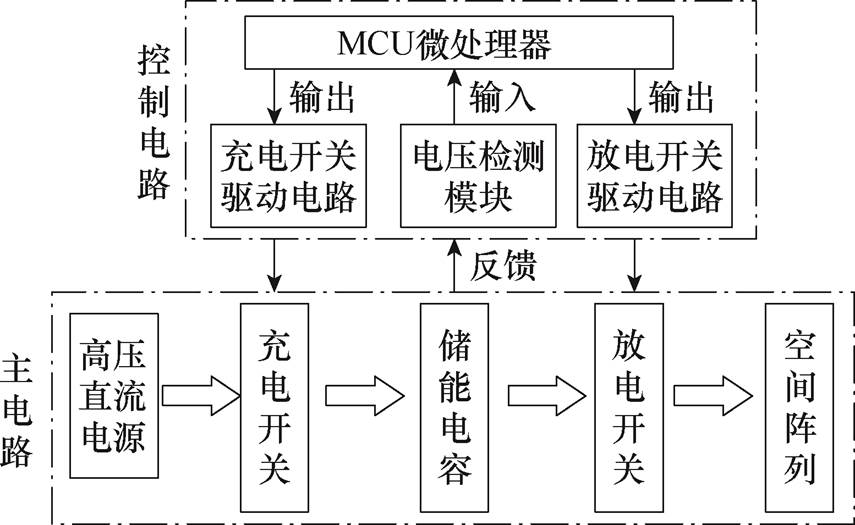
图9 DMSS实验测试平台示意图
Fig.9 Schematic diagram of DMSS experimental test platform
DMSS电路及刺激线圈实物如图10所示。DMSS主要元器件的参数见表1。综合考虑第2节空间阵列在颅内产生的刺激强度、聚焦性及纵向衰减率,选取仿真模型中线圈内半径r1=23 mm时空间阵列的几何参数进行实物加工。
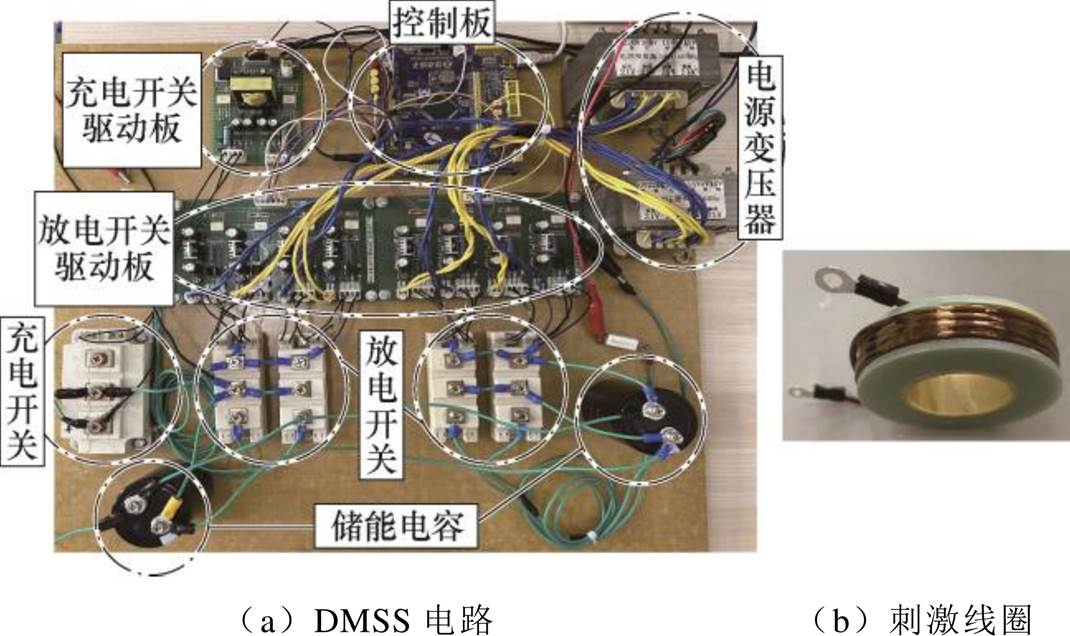
图10 DMSS电路及刺激线圈实物
Fig.10 Photos of the DMSS and stimulation coil
表1 DMSS主要元器件的参数
Tab.1 The key device parameters of DMSS
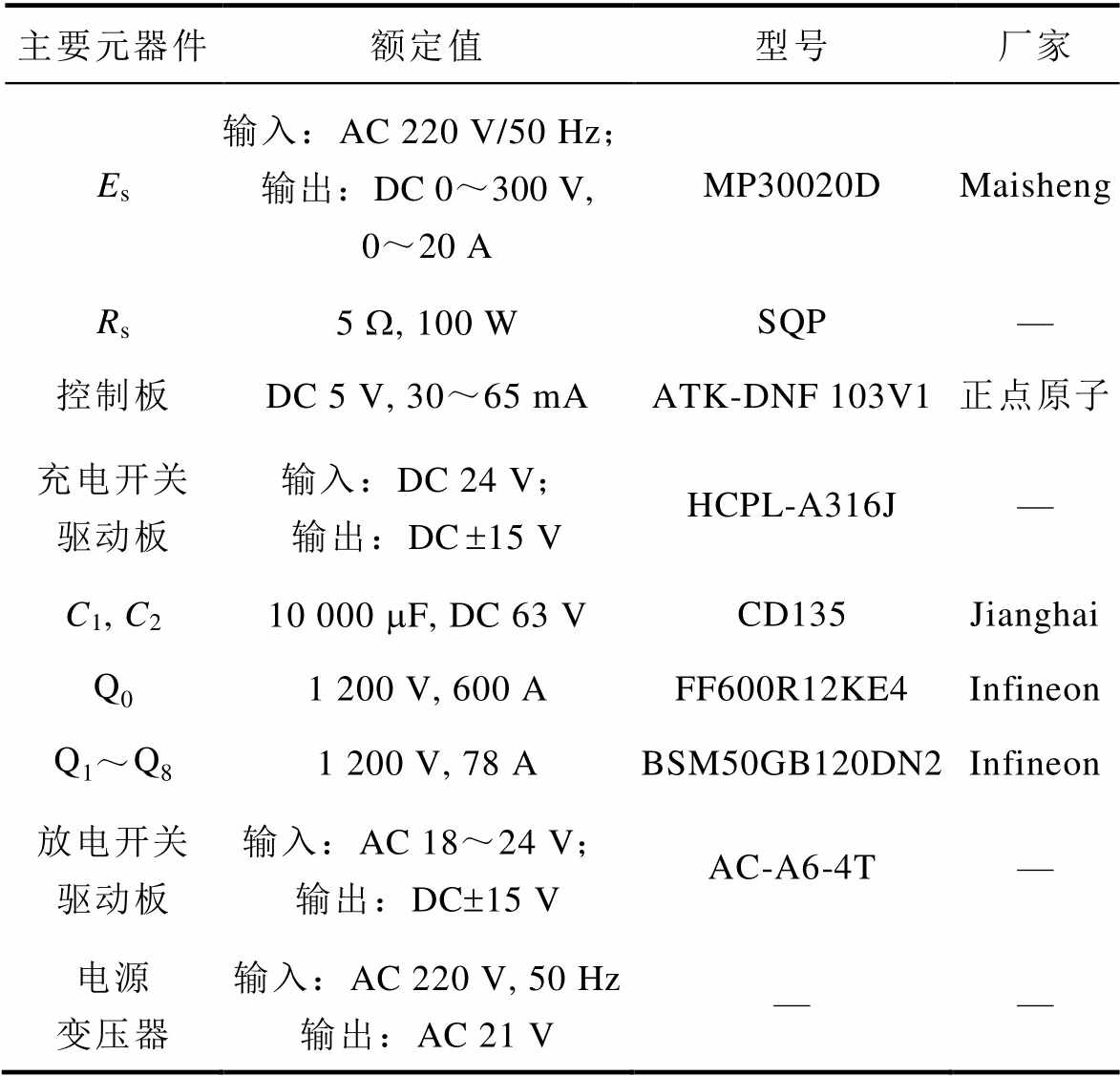
主要元器件额定值型号厂家 Es输入:AC 220 V/50 Hz;输出:DC 0~300 V, 0~20 AMP30020DMaisheng Rs5 W, 100 WSQP— 控制板DC 5 V, 30~65 mAATK-DNF 103V1正点原子 充电开关驱动板输入:DC 24 V;输出:DC±15 VHCPL-A316J— C1, C210 000 mF, DC 63 VCD135Jianghai Q01 200 V, 600 AFF600R12KE4Infineon Q1~Q81 200 V, 78 ABSM50GB120DN2Infineon 放电开关驱动板输入:AC 18~24 V;输出:DC±15 VAC-A6-4T— 电源变压器输入:AC 220 V, 50 Hz输出:AC 21 V——
线圈由线径为3 mm的漆包铜线均匀绕制在中空骨架上,漆包铜线型号为QZY-2/180,其电导率为5.998×107 S/m。线圈内半径r1=23 mm,外半径为38 mm,高度为12 mm,宽度为15 mm,总匝数为5×4。线圈骨架材料为环氧树脂,骨架厚度为3 mm。通过LCR表测量得到单个刺激线圈的电感为31 mH,电阻为11 mW。
实验测试中空间阵列及采样点示意图如图11所示,选用聚丙烯(Polypropylene, PP)定制阵列固定板,固定板上的小孔用于调整阵列中各线圈的相对位置。小型探测线圈采用线径为0.1 mm的细铜丝,在直径为6 mm的环氧棒上绕制而成。实验过程中,沿图中红色虚线做纵向测试线,O点为z坐标零点,将探测线圈放置于不同深度,测量探测线圈端电压即可得到干涉电场分布。在这些采样点上利用探测线圈测量感应电场。探测线圈垂直于yOz平面,上下移动探测线圈,利用示波器捕获探测线圈上的电压波形,即为纵向测试线上各采样点处的感应电场波形。探测线圈及其测试示意图如图12所示。

图11 空间阵列及采样点示意图
Fig.11 Schematic diagram of DMSS array and sampling points

图12 探测线圈及其测试示意图
Fig.12 Detection coil and its testing schematic diagram
将储能电容C1和C2分别充电至VC1=VC2=24 V,通过控制放电开关的导通时序,产生频率分别为f1= 5 000 Hz和f2=4 800 Hz的两路高频脉冲刺激电流,电流峰值约为52 A。
DMSS阵列中心O点为z方向坐标零点,上下移动探测线圈,获得纵向测试线上各采样点处的干涉电场时域波形,测试点A、B、O及F处的干涉电场波形分别如图13~图16所示。在时间分布上,各测试点干涉电场包络波与图5中的理论波形吻合:当刺激电流频率分别为f1=5 000 Hz和f2= 4 800 Hz时,DMSS可在深部刺激区产生低频包络刺激波,干涉电场包络波形频率等于差频Df= 200 Hz。图13~图16中右下角标注了各点采样得到的感应电压值,测试点A、B、O及F处的感应电压峰值分别为82、86、100及72 mV。纵向测试线上各采样点的感应电压峰值见表2。该结果表明,DMSS在纵向测试线上产生的干涉电场呈现浅层区域削弱、深部中心区域增强的分布形态,与图7中仿真计算得到干涉电场强度随z轴变化关系一致。电磁场的分布计算与元器件几何尺寸密切相关,本文结合实验室已有的电子元器件搭建实验平台,并在低参数水平下验证了设计的可行性。在下一阶段的研究工作中,将进一步提高实验平台参数等级,将刺激电流峰值提升至kA级别,以用于动物实验验证中。
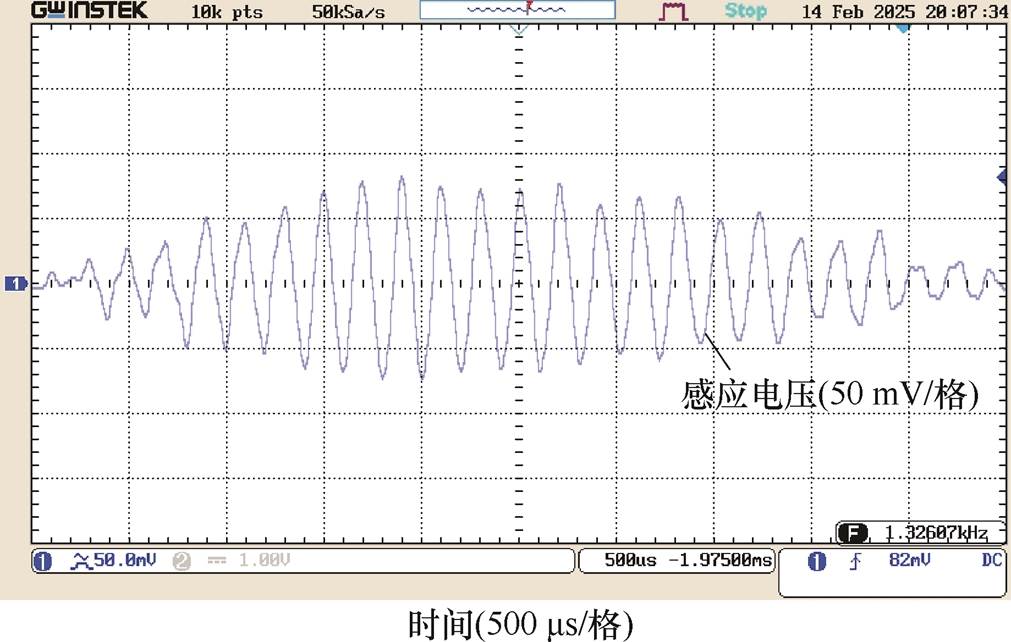
图13 测试点A(z=5 mm)干涉电场时域分布
Fig.13 Temporal distributions of interfering electric field at test point A(z=5 mm)
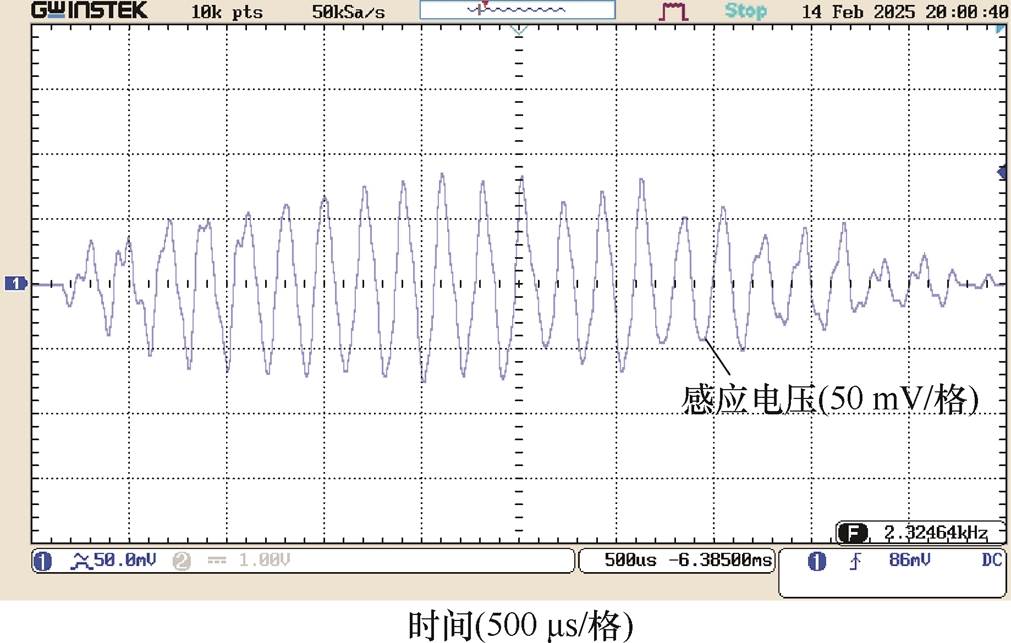
图14 测试点B(z=2.5 mm)干涉电场时域分布
Fig.14 Temporal distributions of interfering electric field at test point B(z=2.5 mm)
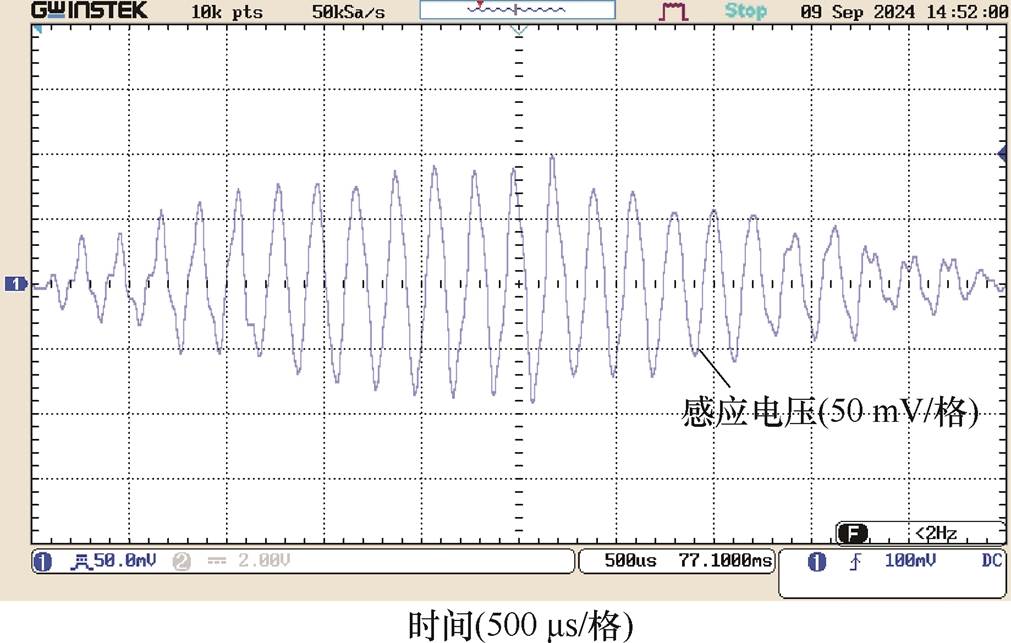
图15 测试点O(z=0)干涉电场时域分布
Fig.15 Temporal distributions of interfering electric field at test point O(z=0)
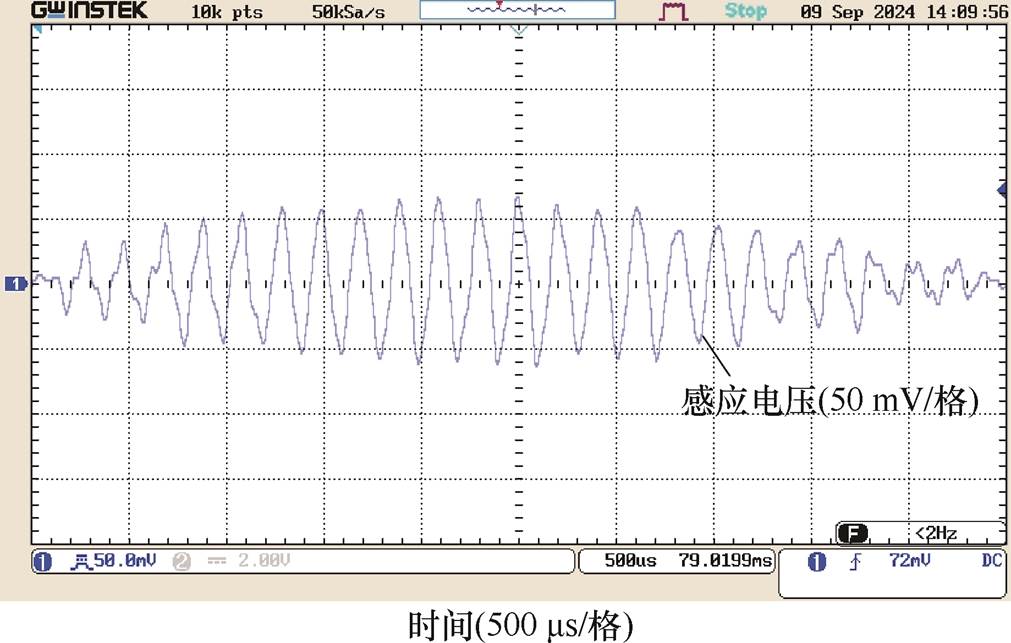
图16 测试点F(z=-10 mm)干涉电场时域分布
Fig.16 Temporal distributions of interfering electric field at test point F(z=-10 mm)
表2 不同深度感应电压峰值
Tab.2 Peak intensity of the induced voltage at different positions
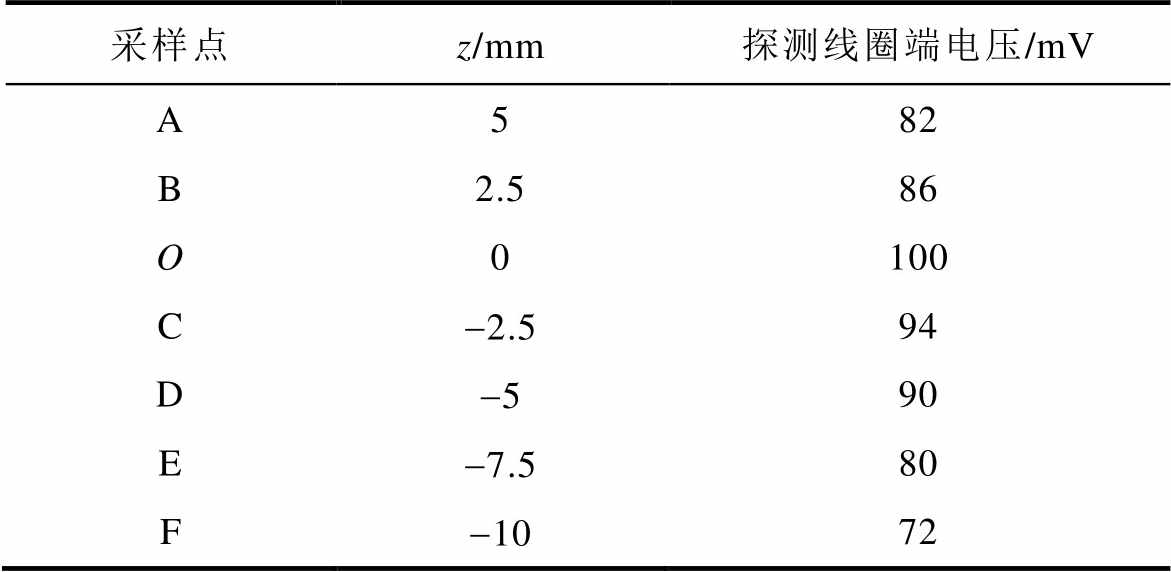
采样点z/mm探测线圈端电压/mV A582 B2.586 O0100 C-2.594 D-590 E-7.580 F-1072
为提高TMS的深部刺激性能,本文将时域干涉效应引入TMS系统,提出了适用于产生干涉磁刺激的DMSS空间阵列,并为该阵列设计了双频多通道脉冲刺激电路。不同于传统TMS线圈的平面结构,DMSS空间阵列由四个垂直于水平面且与头部相切放置的圆形线圈构成,该空间阵列结构可实现多路感应电场叠加,以减小颅内电场非纵向分量积累,提高深部聚焦性。另外,由于时域干涉电场的引入,可在颅内实现深部刺激加强、浅层刺激削弱的改善型感应电场分布。本文详细地介绍了DMSS阵列及电路的结构及工作原理,通过建立有限元数值模型,对系统在颅内产生的干涉电场时空分布特性进行了仿真分析,仿真结果表明:DMSS可在深部区域产生易于神经元动态响应的低频干涉电场包络波,刺激深度可达到6 cm以上,并形成强化深部刺激、削弱浅层刺激的聚焦刺激效果。在刺激条件相同的情况下,相比于传统TMS系统,DMSS可将颅内纵向衰减率提高2.5倍,刺激深度提高4 cm以上。选取仿真模型中线圈内半径为23 mm时的刺激线圈几何参数绕制了空间阵列,并搭建实验平台,保持刺激电流频率与仿真模型一致,采用探测线圈对该系统刺激性能进行了验证。实验结果表明:当刺激电流频率分别为5 000 Hz和4 800 Hz时,在深部区域产生的干涉电场时域分布为频率为200 Hz的低频包络,且深部刺激点处干涉电场强度高于浅层刺激点,与仿真模型中的理论波形形态相吻合。将时域干涉效应引入TMS系统以改善深脑刺激性能是一个极具潜力的研究方向,在神经科学以及生物医学工程方面具有广阔的应用前景。
参考文献
[1] 张帅, 由胜男, 党君武, 等. 基于皮层-基底神经节环路模型的经颅磁声电刺激对大鼠行为决策的影响[J]. 电工技术学报, 2024, 39(2): 356-368.
Zhang Shuai, You Shengnan, Dang Junwu, et al. Effect of transcranial magneto-acousto-electrical stimulation on behavioral decision-making in rats based on a cortical-basal Ganglia loop model[J]. Transactions of China Electrotechnical Society, 2024, 39(2): 356-368.
[2] Hutton T, Aaronson S T, Carpenter L L, et al. The profile of symptom change with transcranial magnetic stimulation for major depressive disorder[J]. Transcranial Magnetic Stimulation, 2024, 1: 100074.
[3] 许宁, 米彦, 李政民, 等. 用于电感负载的全固态双极性LTD型脉冲电流发生器[J]. 电工技术学报, 2023, 38(13): 3413-3424.
Xu Ning, Mi Yan, Li Zhengmin, et al. All-solid-state bipolar linear transformer drive-type pulse current generator for inductive loads[J]. Transactions of China Electrotechnical Society, 2023, 38(13): 3413-3424.
[4] 尚莹春, 张涛. 重复经颅磁刺激对认知功能的作用及其分子机理的研究进展[J]. 电工技术学报, 2021, 36(4): 685-692.
Shang Yingchun, Zhang Tao. The role of repetitive transcranial magnetic stimulation on cognitive functionand its underlying molecular mechanism[J]. Trans- actions of China Electrotechnical Society, 2021, 36(4): 685-692.
[5] 王天玲, 杨雪, 张红梅, 等. 经颅磁刺激联合脑电图在神经精神疾病诊断与治疗中的应用进展[J]. 山东医药, 2024, 64(8): 87-90.
[6] Meneses-San Juan D, Lamas M, Ramírez-Rodríguez G B. Repetitive transcranial magnetic stimulation reduces depressive-like behaviors, modifies dendritic plasticity, and generates global epigenetic changes in the frontal cortex and hippocampus in a rodent model of chronic stress[J]. Cells, 2023, 12(16): 2062.
[7] Tan Xinhua, Guo Ao, Tian Jiasheng, et al. A novel pulse-current waveform circuit for low-energy consump- tion and low-noise transcranial magnetic stimulation [J]. Frontiers in Neuroscience, 2024, 18: 1500619.
[8] Acevedo N, Castle D, Rossell S. The promise and challenges of transcranial magnetic stimulation and deep brain stimulation as therapeutic options for obsessive-compulsive disorder[J]. Expert Review of Neurotherapeutics, 2024, 24(2): 145-158.
[9] Spampinato D A, Ibanez J, Rocchi L, et al. Motor potentials evoked by transcranial magnetic stimulation: interpreting a simple measure of a complex system[J]. The Journal of Physiology, 2023, 601(14): 2827-2851.
[10] Hernández-Sauret A, Martin de la Torre O, Redolar- Ripoll D. Use of transcranial magnetic stimulation (TMS) for studying cognitive control in depressed patients: a systematic review[J]. Cognitive, Affective, & Behavioral Neuroscience, 2024, 24(6): 972-1007.
[11] Schwendner M, Schroeder A, Job K, et al. Cortical stimulation depth of nTMS investigated in a cohort of convexity meningiomas above the primary motor cortex[J]. Journal of Neuroscience Methods, 2024, 404: 110062.
[12] Zangen A, Roth Y, Voller B, et al. Transcranial magnetic stimulation of deep brain regions: evidence for efficacy of the H-Coil[J]. Clinical Neurophysiology, 2005, 116(4): 775-779.
[13] Harel E V, Zangen A, Roth Y, et al. H-coil repetitive transcranial magnetic stimulation for the treatment of bipolar depression: an add-on, safety and feasibility study[J]. The World Journal of Biological Psychiatry, 2011, 12(2): 119-126.
[14] Guadagnin V, Parazzini M, Liorni I, et al. Modelling of deep transcranial magnetic stimulation: different coil configurations[C]//36th Annual International Conference of the IEEE Engineering in Medicine and Biology Society, Chicago, IL, USA, 2014: 4306-4309.
[15] Lu Mai, Ueno S. Comparison of the induced fields using different coil configurations during deep transcranial magnetic stimulation[J]. PLoS One, 2017, 12(6): e0178422.
[16] Lonergan B, Nguyen E, Lembo C, et al. Patient-and technician-oriented attitudes toward transcranial magnetic stimulation devices[J]. The Journal of Neuropsychiatry and Clinical Neurosciences, 2018, 30(3): 242-245.
[17] 李江涛, 曹辉, 郑敏军, 等. 多通道经颅磁刺激线圈阵列的驱动与控制[J]. 电工技术学报, 2017, 32(22): 158-165.
Li Jiangtao, Cao Hui, Zheng Minjun, et al. The drive and control of multi-channel transcranial magnetic stimulation coil array[J]. Transactions of China Electrotechnical Society, 2017, 32(22): 158-165.
[18] Rastogi P, Lee E G, Hadimani R L, et al. Transcranial magnetic stimulation: development of a novel deep-brain triple-halo coil[J]. IEEE Magnetics Letters, 2019, 10: 1-5.
[19] Sorkhabi M M, Wendt K, Denison T. Temporally interfering TMS: focal and dynamic stimulation location[C]//42nd Annual International Conference of the IEEE Engineering in Medicine & Biology Society (EMBC), Montreal, QC, Canada, 2020: 3537-3543.
[20] Xin Zonghao, Kuwahata A, Liu Shuang, et al. Magnetically induced temporal interference for focal and deep-brain stimulation[J]. Frontiers in Human Neuroscience, 2021, 15: 693207.
[21] Membrilla J A V, Pantoja M F, Puerta A P V, et al. Design of transcranial magnetic stimulation coils with optimized stimulation depth[J]. IEEE Access, 2024, 12: 1330-1340.
[22] Ahsan F, Chi Taiyun, Cho R, et al. EMvelop stimulation: minimally invasive deep brain stimula- tion using temporally interfering electromagnetic waves [J]. Journal of Neural Engineering, 2022, 19(4): 046005.
[23] Su Xiaofan, Guo Jiahui, Zhou Meixuan, et al. Computational modeling of spatially selective retinal stimulation with temporally interfering electric fields [J]. IEEE Transactions on Neural Systems and Rehabilitation Engineering, 2021, 29: 418-428.
[24] Karimi F, Attarpour A, Amirfattahi R, et al. Computational analysis of non-invasive deep brain stimulation based on interfering electric fields[J]. Physics in Medicine and Biology, 2019, 64(23): 235010.
[25] 吴晓, 米彦, 郑伟, 等. 脉冲电场对细胞膜电穿孔面积的影响研究[J]. 电工技术学报, 2023, 38(14): 3779-3788.
Wu Xiao, Mi Yan, Zheng Wei, et al. Effect of pulsed electric field on electroporation area of cell memb- rane[J]. Transactions of China Electrotechnical Society, 2023, 38(14): 3779-3788.
[26] Kim D H, Georghiou G E, Won C. Improved field localization in transcranial magnetic stimulation of the brain with the utilization of a conductive shield plate in the stimulator[J]. IEEE Transactions on Bio-Medical Engineering, 2006, 53(4): 720-725.
[27] Zhao Chen, Zhang Shunqi, Liu Zhipeng, et al. Simulation study to improve focalization of a figure eight coil by using a conductive shield plate and a ferromagnetic block[J]. IEEE Transactions on Neural Systems and Rehabilitation Engineering, 2015, 23(4): 529-537.
[28] Deng Zhide, Lisanby S H, Peterchev A V. Electric field depth-focality tradeoff in transcranial magnetic stimulation: Simulation comparison of 50 coil designs [J]. Brain Stimulation, 2013, 6(1): 1-13.
[29] Han B H, Chun I K, Lee S C, et al. Multichannel magnetic stimulation system design considering mutual couplings among the stimulation coils[J]. IEEE Transactions on Bio-Medical Engineering, 2004, 51(5): 812-817.
[30] Lu Mai, Ueno S. Computational study toward deep transcranial magnetic stimulation using coaxial circular coils[J]. IEEE Transactions on Bio-Medical Engineering, 2015, 62(12): 2911-2919.
[31] Guadagnin V, Parazzini M, Fiocchi S, et al. Deep transcranial magnetic stimulation: modeling of different coil configurations[J]. IEEE Transactions on Bio- Medical Engineering, 2016, 63(7): 1543-1550.
[32] Deng Zhide, Lisanby S H, Peterchev A V. Coil design considerations for deep transcranial magnetic stimula- tion[J]. Clinical Neurophysiology, 2014, 125(6): 1202- 1212.
Abstract Transcranial magnetic stimulation (TMS) is a non-invasive bio-stimulation technique that is widely used in the clinical treatment of mental disorders such as depression and anxiety, as well as in neuroscience research. The study of deep neural modulation mechanisms is critical for treating mental illnesses and exploring their underlying causes. However, traditional TMS systems are effective at stimulating depths of 1.5 cm to 2 cm below the scalp, enabling cortical excitability regulation. It is difficult to produce an induced electric field that exceeds the neuronal excitation threshold in deeper brain regions, ranging from 4 cm to 8 cm below the scalp. In order to improve the deep stimulation effect of TMS, a deep magnetic stimulation system (DMSS) based on temporally interfering effect is proposed in this paper.
Firstly, the interferential electric fields were introduced to the deep intracranial target area using the DMSS spatial array. The array contains four coils that are placed perpendicularly to the horizontal plane and tangentially to the scalp, constituting two sets of differential frequency stimulation pairs. Then, the DMSS stimulation circuit was designed to stably output two high-frequency pulsed stimulation currents to the spatial array. Next, the finite element numerical analysis was used to obtain the temporal and spatial distributions of the intracranial electric fields generated by the DMSS spatial array. Results showed that DMSS could generate a low-frequency electric fields in the deep region that was easy for neurons to respond dynamically, strengthen the deep stimulation, weaken the shallow stimulation, and produce an obvious focusing zone at the deep target area of 6 cm below the scalp. Under the same stimulation conditions, compared with the traditional TMS system, the DMSS can improve the intracranial longitudinal attenuation rate by a factor of 2.5, increase the stimulation depth by more than 4cm. Finally, the DMSS experimental platform was built and the system performance was tested to verify the feasibility of this design. The stimulating effects of DMSS were measured through a small detection coil with stimulation current frequencies of 5 000 Hz and 4 800 Hz. The electric fields in the deep region exhibited a low-frequency envelope with a frequency of 200 Hz. The electric fields intensity at the deep stimulation points was higher than that at the shallow stimulation points, which was consistent with the theoretical waveform shape.
Combining the temporally interference effect with TMS design to improve deep brain stimulation performance is a highly promising research direction with vast application prospects in neuroscience and biomedical engineering. The distribution of electromagnetic fields is closely related to the geometric dimensions of electromagnetic field generating components. In this paper, the experimental platform was built with existing electronic components in the laboratory to verify the feasibility of the design at a low parameter level. In the next stage of research work, the parameter level of the experimental platform will be further improved and the peak value of the stimulation current will be increased to kiloampere level for animal experiment verification.
keywords:Interferential electric field, spatial array, differential frequency stimulation, transcranial magnetic stimulation, focusing
DOI: 10.19595/j.cnki.1000-6753.tces.242308
中图分类号:TM154
四川省自然科学基金青年项目(2023NSFSC0830)和电子科技大学神经信息教育部重点实验室开放基金项目(202311FKY00051)资助。
收稿日期 2024-12-19
改稿日期 2025-02-15
方 晓 女,1993年生,博士,副教授,研究方向为脉冲功率技术、生物电磁技术。E-mail: fangxiao930106@163.com(通信作者)
杨文龙 男,1997年生,硕士研究生,研究方向为脉冲发生电路系统及其控制。E-mail: yangwl0902@163.com
(编辑 李 冰)