
图1 实验装置示意图
Fig.1 Schematic experimental diagram
摘要 为深入研究高压纳秒脉冲电场诱导同源细胞的生物电学效应的差异性,该文以人永生化角质形成细胞(HaCaT)、人黑色素瘤细胞(A375)和人黑色素瘤耐药细胞(A375/R)为研究对象,开展细胞悬液杀伤实验,并搭建肿瘤三维水凝胶模拟组织消融实验平台,分析高压纳秒脉冲电场对悬浮细胞的杀伤效应以及对模拟组织的消融效果。同时,结合单细胞真实几何尺寸建立有限元仿真模型,分析高压纳秒脉冲电场作用下几何尺寸对细胞核膜上穿孔面积以及穿孔数量的影响。实验结果显示,在高压纳秒脉冲作用下,正常细胞的存活率最高且消融面积最小,肿瘤耐药细胞的存活率最低且消融面积最大。实验与仿真结果表明,正常细胞、肿瘤细胞及肿瘤耐药细胞对高压纳秒脉冲电场的敏感性存在显著差异,高压纳秒脉冲电场对正常细胞的效果最弱,对肿瘤耐药细胞的效果最强。研究表明,高压纳秒脉冲电场在肿瘤消融领域具有不影响周边正常组织的潜在的临床应用价值。
关键词:纳秒脉冲电场 同源细胞 细胞存活率 水凝胶模拟组织 杀伤差异性
黑色素瘤由于高复发、高转移等恶性特点,其发病率和死亡率在全球范围内呈快速增长的趋势[1-2]。现有射频、微波、冷冻和聚焦超声消融等治疗手段对其治疗效果有限[3-6],新兴的生物免疫疗法[7]和靶向疗法[8]对治疗黑色素瘤具有独特疗效。然而,随着药物治疗进程推进,黑色素瘤在治疗后期表现出高度耐药性,产生抵抗效应,其可避开靶向制剂、免疫疗法等新兴疗法的作用,从而导致治疗失败[9-12]。因此,寻找一种利用细胞对外界刺激的敏感性差异来有效地杀死肿瘤组织中已经存在的肿瘤耐药细胞的新方法或新技术,对于黑色素瘤的临床治疗具有重要意义[13-15]。
脉冲电场肿瘤治疗是新兴的物理治疗研究方向。其中,高压纳秒脉冲电场不仅能诱导细胞膜产生大量的纳米级微孔,还能作用到细胞内部诱导线粒体等途径介导的细胞凋亡,进而消融组织并诱导
机体抗肿瘤免疫效应等一系列的生物电学效应,在肿瘤的预防及治疗领域表现出突出的优势[16-18]。国内外研究学者对高压纳秒脉冲电场作用下的肿瘤细胞的穿孔效应、死亡机制等问题进行了深入的研究[19-22]。然而,关于高压纳秒脉冲电场对正常细胞、肿瘤细胞及其化疗抵抗的肿瘤细胞是否具有相似或不同响应的相关研究,尚无系统性的研究报道。近期,课题组研究人员对细胞的形态、几何尺寸等物理特性差异对高压纳秒脉冲电场下细胞的响应规律进行了研究,发现不同的细胞种类及不同的细胞尺寸(核质比等)会改变脉冲电场作用下跨膜电位分布,从而导致不同的细胞杀伤效果,即对电场响应敏感性存在差异[23-26]。
为了探索肿瘤细胞及其化疗抵抗细胞对脉冲电场的响应差异,刘红梅等以肺癌细胞系A549及顺铂化疗抵抗肺癌细胞A549/R为对象,研究了高压纳秒脉冲电场对其的杀伤效果及消融面积差异,发现高压纳秒脉冲电场对化疗抵抗的A549/R存在一定的选择性,会优先杀伤化疗抵抗的A549/R细胞,对克服临床治疗中出现的耐药难题表现出一定的发展潜力[27-28]。然而,高压纳秒脉冲电场是否对黑色素瘤以及黑色素瘤耐药细胞也存在选择性,相关研究还未开展。而且,目前的研究多以肿瘤细胞/肿瘤耐药细胞、肿瘤细胞/正常细胞或者肿瘤细胞单独作为研究对象,并没有同时针对肿瘤细胞/肿瘤耐药细胞/正常细胞这三种同源细胞开展的高压纳秒脉冲电场作用下的生物电学效应研究。
因此,本文增加肿瘤细胞同源的正常细胞作为研究对象,研究人永生化角质形成细胞(HaCaT)、人黑色素瘤细胞(A375)和人黑色素瘤威罗非尼耐药(1 μg/mL)细胞(A375/R,其中,R表示Resistance)这三株同源细胞在相同高压纳秒脉冲参数作用下的生物电学效应。通过检测细胞存活率,测量三维模拟组织消融面积以及进行基于细胞真实几何尺寸的仿真分析等,探索HaCaT、A375及A375/R对高压纳秒脉冲电场的敏感性差异规律。
人永生化角质形成细胞(HaCaT)从中国科学院上海生命科学研究院细胞库购得,人黑色素瘤细胞(A375)和人黑色素瘤威罗非尼耐药(1 μg/mL)细胞(A375/R)由重庆第三军医大学新桥医院人类呼吸疾病研究所惠赠。三种细胞均使用含有10%胎牛血清(Fetal bovine serum,Gibco,美国)和1%双抗(100 μg/mL青霉素和100 μg/mL链霉素,Gibco,美国)的Dulbecco 改良的Eagle培养基(DMEM,Dulbecco’s modified eagle medium,Gibco,美国)培养,使用胰酶(0.25% Trypsin-EDTA,Gibco,美国)进行消化传代,细胞孵育箱(Thermo Fisher Scientific,美国)培养环境设置为温度37℃、CO2浓度5%。实验前,取对数生长期的细胞,采用胰酶消化处理后用完全培养基制成浓度分别为1×106 cells/mL的细胞悬液备用。
本文实验需要的高压纳秒脉冲由实验室自行研制[29]的脉冲发生器产生,总体实验装置示意图如图1所示。实验过程中使用双针电极和电极杯(electroporation cuvettes,BTX,美国)两种电极分别对三维水凝胶模拟组织和细胞悬液两种生物负载施加固定参数的高压纳秒脉冲电场。电压电流的反馈信号采用PPE–5 kV高压探头(LeCroy,美国)和6600皮尔森电流线圈(Pearson,美国)采集,并通过WavePro760Zi-A示波器(LeCroy,美国)显示和记录,其电压和电流波形如图2所示。

图1 实验装置示意图
Fig.1 Schematic experimental diagram

图2 脉冲电压和电流波形
Fig.2 The waveforms of pulsed voltage and current
取50 μL细胞悬液注入间距为2 mm的电极杯中(见图1d),采用表1的脉冲电场参数进行处理。处理后每20 μL细胞悬液加入到含有180 μL新鲜完全培养基的96孔板中,并设置空白组(只含培养基)以及未经脉冲电场处理的对照组。在孵箱中孵育培养3 h后,吸出培养基并用磷酸盐缓冲盐水溶液(Phosphate Buffer Saline,PBS)清洗,每孔按1 10的比例分别加入10 μL CCK-8试剂(DOJINDO,日本)和100 μL DMEM完全培养基,操作时避免产生气泡以防影响检测结果。继续放入孵箱避光孵育2 h后,用酶标仪(BIO-RAD,美国)测定450 nm波长下的吸光值(Optical Density,OD),计算脉冲电场刺激后细胞的存活率,有
10的比例分别加入10 μL CCK-8试剂(DOJINDO,日本)和100 μL DMEM完全培养基,操作时避免产生气泡以防影响检测结果。继续放入孵箱避光孵育2 h后,用酶标仪(BIO-RAD,美国)测定450 nm波长下的吸光值(Optical Density,OD),计算脉冲电场刺激后细胞的存活率,有
 (1)
(1)
表1 脉冲电场参数设置
Tab.1 Setting of pulse filed parameters

序列电压幅值/V电场强度/(kV/cm)脉宽/ns个数频率/Hz 11 0005300801 21 6008300801 32 00010300801 42 40012300801 53 00015300801
提前30 min将48孔板置于孵箱中预热,使用PBS制备浓度为1×106 cells/(100 µL)的细胞悬液置于冰上冷却,将去离子水(Distilled Water,Gibco,美国)和氢氧化钠溶液(1 mol/L,Sodium hydroxide solution,Sigma-Aldrich,美国)按照99 1的比例配制浓度为0.01 mol/L的氢氧化钠溶液置于冰上冷却。按照顺序将100 µL PBS (10×,phosphate buffer saline,Gibco,美国)、150 µL氢氧化钠溶液(0.01 mol/L)、670 µL胶原蛋白(Collagen I Rat Protein,Gibco,美国)依次加入1.5 mL的离心管中并混匀,取100 µL细胞悬液注入其中并充分混合均匀,使用pH计检查细胞凝胶混合液pH值为7.0~7.4之间。按照150 µL/孔将细胞凝胶混合液移至48孔板中,均匀摇晃确保无气泡后放置孵箱中孵育,30 min后取出孔板观察细胞状态,每孔加入1 mL新鲜培养基放回孵箱孵育24 h。
1的比例配制浓度为0.01 mol/L的氢氧化钠溶液置于冰上冷却。按照顺序将100 µL PBS (10×,phosphate buffer saline,Gibco,美国)、150 µL氢氧化钠溶液(0.01 mol/L)、670 µL胶原蛋白(Collagen I Rat Protein,Gibco,美国)依次加入1.5 mL的离心管中并混匀,取100 µL细胞悬液注入其中并充分混合均匀,使用pH计检查细胞凝胶混合液pH值为7.0~7.4之间。按照150 µL/孔将细胞凝胶混合液移至48孔板中,均匀摇晃确保无气泡后放置孵箱中孵育,30 min后取出孔板观察细胞状态,每孔加入1 mL新鲜培养基放回孵箱孵育24 h。
水凝胶培养24 h后,移走培养基,使用实验室自制的间距为2.5 mm,直径为1 mm的双针电极置于水凝胶中施加脉冲电场进行处理(见图1b和图1c)。实验采用的脉冲参数为电场强度15 kV/cm、脉冲宽度300 ns、重复频率1 Hz、脉冲个数80。培养3 h后,通过Calcein-AM (4 μg/mL,Sigma Aldrich,美国)和Propidium Iodide (10 μg/mL,Beyotime,中国)进行活死染色,利用倒置荧光显微镜(Leica DMi8,德国)观察并成像,Calcein-AM的激发和发射波长分别为488 nm和515 nm,PI的激发和发射波长分别为535 nm和615 nm。保存模拟组织消融面积图像。
通过Image J图像处理软件测量三维水凝胶模拟组织中的红色有效消融区域,获取消融范围并记录。在COMSOL Multiphysics软件中建立三维模拟组织消融实验的1 1几何模型,具体网格剖分以及参数设置参考文献[30],电极针材料设置为铜,直径为1 mm,两根电极针边缘间距为2.5 mm,分别施加3.75 kV的电压信号和接地。仿真中,利用电流模块进行稳态分析,利用拉普拉斯方程计算高压脉冲电场作用下三维水凝胶模拟组织中的电场分布和电场等值线。建立消融面积与电场等值线的关系曲线,结合实测的消融面积计算三维水凝胶模拟组织的消融阈值电场强度。
1几何模型,具体网格剖分以及参数设置参考文献[30],电极针材料设置为铜,直径为1 mm,两根电极针边缘间距为2.5 mm,分别施加3.75 kV的电压信号和接地。仿真中,利用电流模块进行稳态分析,利用拉普拉斯方程计算高压脉冲电场作用下三维水凝胶模拟组织中的电场分布和电场等值线。建立消融面积与电场等值线的关系曲线,结合实测的消融面积计算三维水凝胶模拟组织的消融阈值电场强度。
取对数生长期的细胞,采用胰酶消化处理制成1×105 cells/mL的细胞悬液,使用4%多聚甲醛固定细胞。使用细胞膜红色荧光探针DiI(3 μg/mL,Beyotime,中国)和细胞核蓝色荧光染料Hoechst33342(5 μg/mL,Beyotime,中国)分别对细胞膜和细胞核染色,15 min后,PBS清洗两次之后制成细胞悬液,取10 μL细胞悬液制作玻片在倒置荧光显微镜下观察并获取细胞几何形态图像。
文中所有实验至少重复3次,实验数据用均值± 标准差表示,数据处理及分析使用Excel软件采用单因素方差分析获取两组参数间的显著性差异,当p<0.05时,认为有显著性差异。采用Origin软件绘制统计结果。
经过80个300 ns的高压纳秒脉冲处理后3 h的HaCaT、A375及A375/R存活率情况如图3所示。图中,“*”代表p<0.05,“**”代表p<0.01,“***”代表p<0.001。当高压纳秒脉冲电场强度为5 kV/cm时,HaCaT、A375及A375/R存活率分别为(85.12±0.35)%、(74.61±0.54)%和(62.03±1.01)%,虽然三种细胞存活率相比对照组都有较大程度下降,但由于样本间分散性较大,当电场强度为5 kV/cm时,三种细胞存活率没有显著性差异,p值均在0.09~0.06之间。当电场强度为8 kV/cm时,HaCaT、A375及A375/R存活率分别为(45.44±0.01)%、(34.77±0.06)%和(19.11±0.06)%,HaCaT和A375之间存在显著性差异,A375和A375/R之间差异极显著。当电场强度为10 kV/cm时,HaCaT、A375及A375/R存活率分别为(19.49±0.14)%、(10.54±0.01)%和(4.07±0.02)%,三种细胞之间存在极显著差异。当电场强度为12 kV/cm时,HaCaT、A375及A375/R的存活率分别为(9.49±0.01)%、(4.62±0.01)%、(3.99±0.02)%,HaCaT和A375之间差异极显著,但A375及A375/R的存活率都降到了5%以内,无显著性差异。当电场强度为15 kV/cm时,HaCaT、A375及A375/R的存活率都降到了5%以内,分别为(4.21±0.01)%、(3.29±0.02)%和(2.56±0.01)%,无显著性差异。
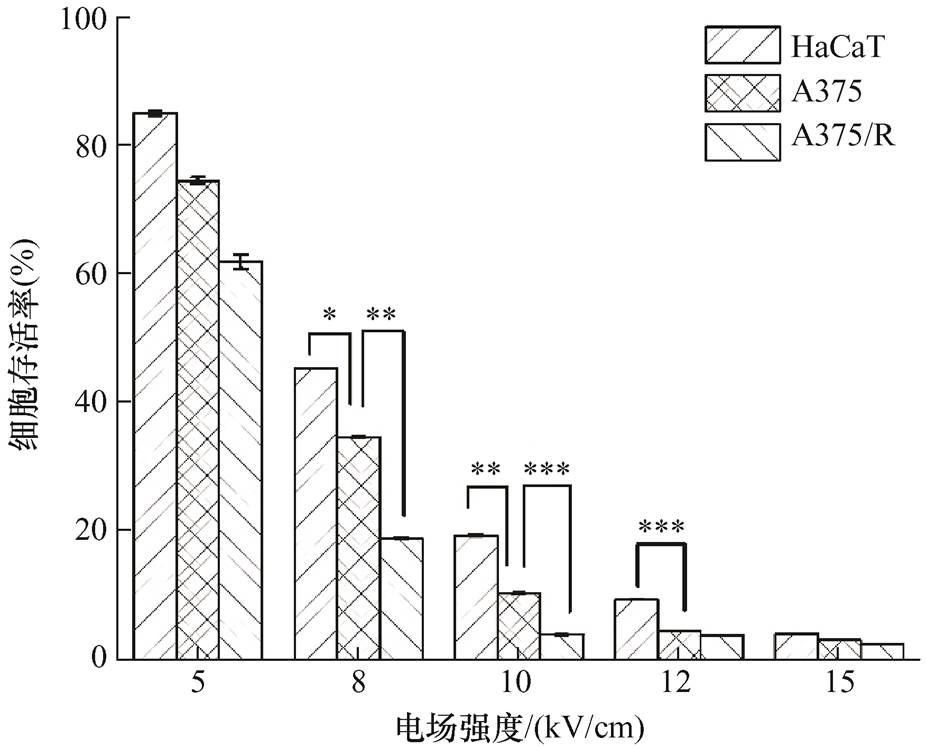
图3 三种细胞的存活率结果
Fig.3 The results of survival rates
综合多组脉冲电场参数实验结果分析,随着电电场强度的提高,高压纳秒脉冲电场作用下HaCaT、A375及A375/R的存活率均逐渐下降,并且杀伤程度趋势是A375/R>A375>HaCaT。当电场强度达到8 kV/cm、10 kV/cm时,三种细胞间均有显著性差异,当电场强度达到15 kV/cm时,存活率都降到5%以下,三种细胞的杀伤效果无显著性差异。上述研究表明,即使是同源细胞,但是由于不同株细胞之间的多样性,其杀伤效果仍存在明显差异,其中高压纳秒脉冲电场对化疗药物抵抗的黑色素瘤细胞表现出了更强的杀伤效果。
经过80个电场强度为15 kV/cm、脉宽为300 ns的高压纳秒脉冲电场处理后3 h的水凝胶模拟组织消融情况如图4所示。图中,绿色区域(Calcein-AM,绿光)代表活细胞,红色区域(Propidium Iodide,红光)代表失去活性的死细胞。直观可见,高压纳秒脉冲电场诱导的三维水凝胶模拟组织的消融边界明显,测量红色区域来计算消融面积,计算结果如图5所示。HaCaT、A375、A375/R的消融面积平均值分别为(10.26±0.49) mm2、(12.37±0.66) mm2和(20.28±0.85) mm2,结果表明,相同高压纳秒脉冲电场对耐药细胞A375/R模拟组织的消融效果更好,区域更大,对正常细胞HaCaT模拟组织的消融效果最差,说明高压纳秒脉冲电场对同源细胞的消融效果具有显著差异性。

图4 脉冲电场消融模拟组织染色结果
Fig.4 Staining results of hydrogel-simulated tissues ablated by pulsed electric fields
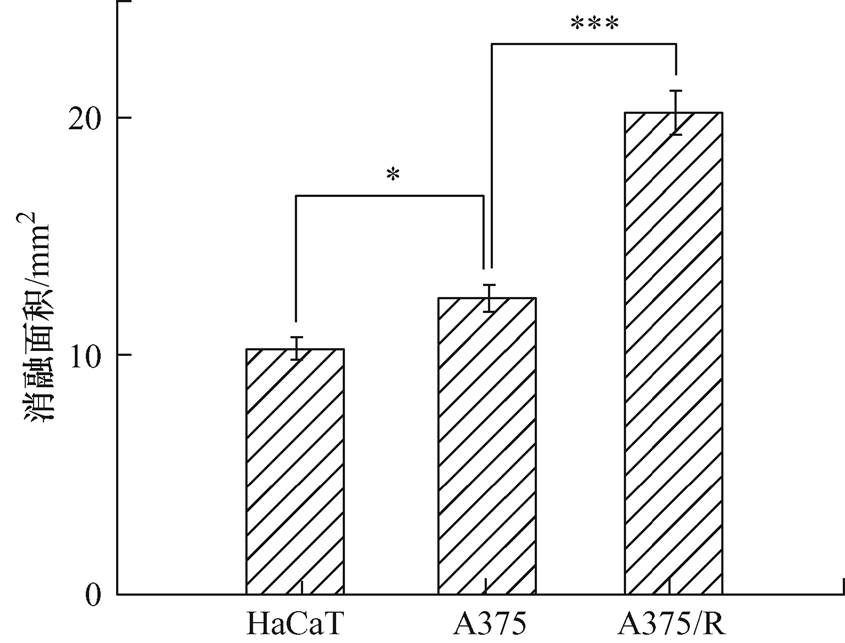
图5 水凝胶模拟组织的消融面积
Fig.5 Ablation areas of hydrogel-simulated tissues
为了进一步确定高压纳秒脉冲电场作用下HaCaT、A375和A375/R的消融效果差异,基于以上获取的实测消融面积结合仿真分析计算三种水凝胶模拟组织在15 kV/cm、300 ns脉冲参数下的消融阈值场强。脉冲电场作用下等值线分布及消融阈值场强如图6所示,HaCaT、A375和A375/R的消融区与正常区的边界线所对应的等值电场线即为消融阈值场强,分别为(7.15±0.65) kV/cm、(6.87±0.35) kV/cm和(4.75±0.15) kV/cm。可见,在同样的高压纳秒脉冲电场参数作用下,HaCaT、A375、A375/R的消融阈值场强呈递减的趋势,即对耐药肿瘤细胞具有最强的杀伤效果。
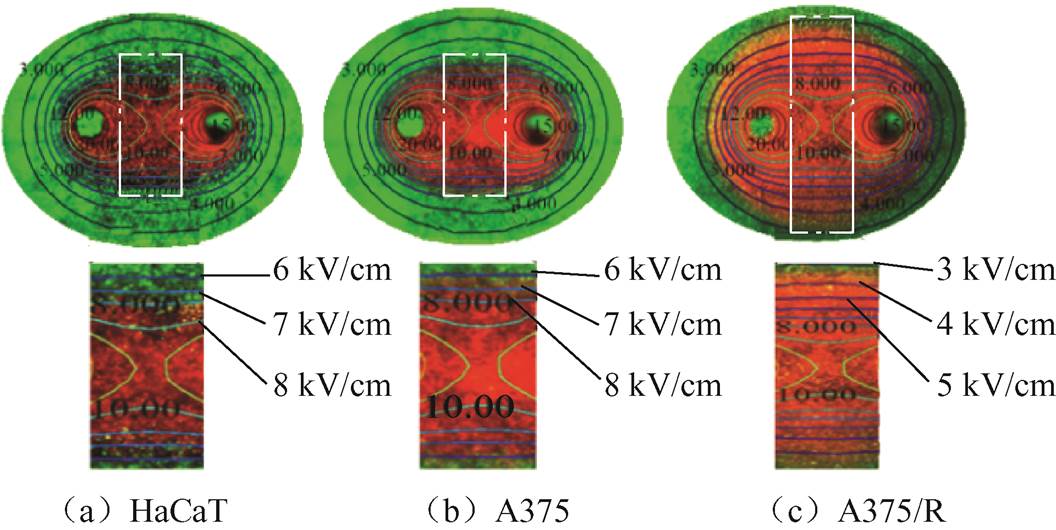
图6 脉冲电场作用下等值线分布及消融阈值场强
Fig.6 Numerical simulation contours and the lethal threshold under pulsed electric field
HaCaT是人永生化表皮细胞,A375/R是A375同源的人黑色素瘤细胞,对化疗药物威罗非尼具有耐药性,在生长速度和细胞形态伸展程度方面,三株细胞呈现一致的变化趋势,恶性程度表现为A375/R>A375>HaCaT。本文通过分析细胞存活率以及三维水凝胶模拟组织消融实验的数据发现,同样的高压纳秒脉冲参数(80个,5~15 kV/cm,300 ns)对细胞的杀伤效果以及消融面积随恶性程度升高而呈现递增的趋势,即杀伤效果A375/R>A375>HaCaT;消融面积:A375/R>A375>HaCaT。模拟组织消融阈值场强表现出递减趋势:A375/R<A375<HaCaT。表明高压纳秒脉冲电场对黑色素瘤以及黑色素瘤耐药细胞的杀伤率更高。
为研究高压纳秒脉冲电场对不同细胞的杀伤率具有差异性的原理,刘红梅等[28]通过单细胞的参数测量与仿真来研究不同细胞对高压纳秒脉冲电场的响应差异。研究发现,高压纳秒脉冲电场靶向作用于细胞核,能够引发细胞核膜电穿孔效应,并且诱导核质比更大的细胞产生更高的跨膜电位以及更大的穿孔面积,该结论在以顺铂耐药(1 μg/mL)的肺癌细胞系A549(称为A549/R)以及同源的肺癌细胞系A549为对象的实验和仿真中得到了证实。文献[21,25]表明,两种正常细胞系对相同剂量高压纳秒脉冲电场的敏感性均低于相对应的癌细胞,并且三维水凝胶模拟组织消融实验也呈现出肿瘤细胞的消融阈值场强低于所对应的正常细胞。基于此,本文以A375/R、A375和HaCaT开展了细胞膜及细胞核膜尺寸测量和单细胞仿真的工作。
通过荧光显微镜扫描得到的HaCaT、A375及A375/R细胞的细胞尺寸以及细胞核尺寸如图7所示。图中,HaCaT、A375和A375/R三种细胞的细胞膜直径分别为(19.03±1.49) μm、(20.04±1.52) μm和(18.55±1.40) μm,细胞核直径分别为(11.08±1.37) μm、(12.06±1.01) μm和(13.15±1.19) μm(统计样本个数n≥50)。可见,HaCaT、A375及A375/R的细胞膜尺寸大小没有显著性差异,但是细胞核尺寸存在显著性差异,从HaCaT、A375到A375/R细胞,细胞核直径呈递增趋势。

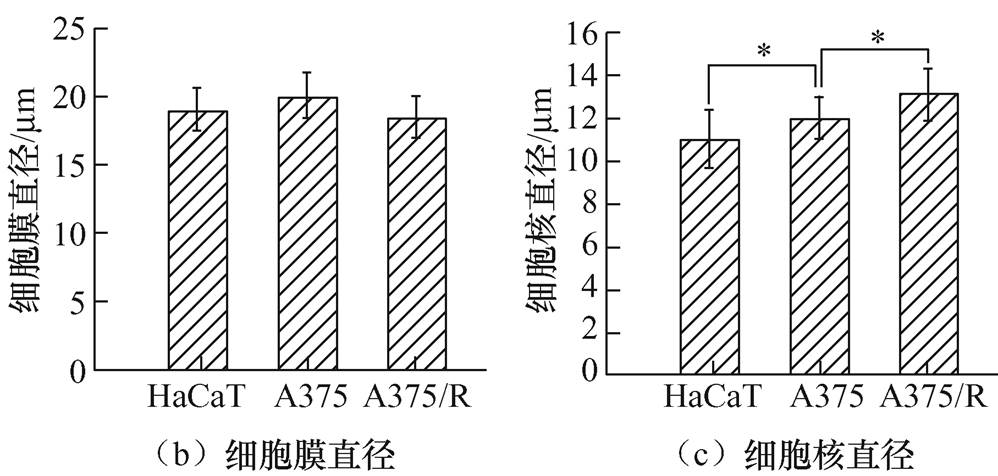
图7 细胞几何尺寸
Fig.7 Geometrical dimensions of cells
在COMSOL Multiphysics有限元仿真软件中建立球形单细胞五层介电模型,引入电穿孔数值模型来仿真研究细胞核膜的穿孔面积以及穿孔数量,具体网格剖分和仿真参数设置以文献[30]为参考。将实验测量得到的HaCaT、A375和A375/R的细胞膜和细胞核几何尺寸数据代入球形细胞模型中,对其在300 ns、15 kV/cm的高压纳秒脉冲作用下的电穿孔效应进行分析,三种细胞孔密度分布情况如图8所示。
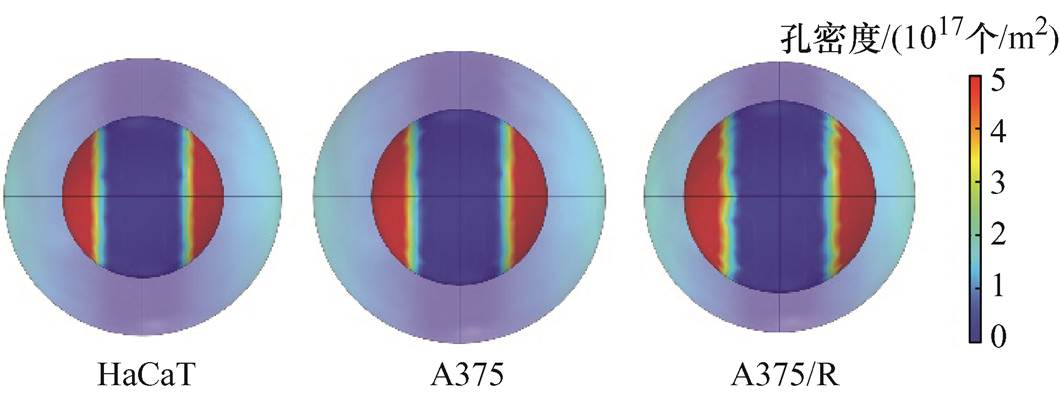
图8 细胞孔密度分布情况
Fig.8 Distribution of cell pore density
细胞核膜仿真结果见表2,在高压纳秒脉冲电场作用下,通过对细胞核膜进行表面积分计算得到HaCaT、A375和A375/R的细胞核膜上穿孔面积分别为296.18、362.55和420.39 μm2,穿孔数量分别为1.47×108、1.81×108和2.08×108个,均呈现从左到右递增的趋势,与本文实验中的消融面积以及杀伤率变化趋势一致。单个细胞穿孔面积越大和穿孔数量越多可能从微观上影响细胞在电穿孔过程中钙离子通道形成[31]、凋亡[32]等,在宏观现象上则表现为消融面积的增加以及杀伤率的增大。说明本文在同时以正常细胞、肿瘤细胞和肿瘤耐药细胞为研究对象的实验和仿真中得出的HaCaT、A375和A375/R对高压纳秒脉冲电场的敏感性从左到右逐渐增强的规律是正确的。
表2 细胞核膜仿真结果
Tab.2 Simulation results of the cell nuclear membrane

细胞穿孔面积/μm2穿孔数量 (108) HaCaT296.181.47 A375362.551.81 A375/R420.392.08
本文的研究从细胞存活率和水凝胶模拟组织消融效果证明了三株同源细胞对高压纳秒脉冲电场的敏感性差异,但这种差异性还不足以实现纳秒脉冲电场在肿瘤消融时不影响周边正常组织的选择性。因此,还需要进一步研究不同脉冲参数(电场强度、脉宽、个数和重复频率等)的细胞杀伤效果,调控脉冲参数以放大这种差异性,进而实现临床应用的可能性。同时,本研究忽略了三种细胞本身各组分介电参数上的差异,后续研究考虑继续开展细胞电气参数测量相关工作,分析HaCaT、A375和A375/R三种细胞的膜电容等电气特性参数对细胞在高压纳秒脉冲电场作用下电穿孔效应差异的影响,进而阐明纳秒脉冲对细胞杀伤效果差异性的机制。
本文以人永生化表皮细胞(HaCaT)、人黑色素瘤细胞(A375)和人黑色素瘤威罗非尼耐药细胞(A375/R)为实验研究对象,通过高压纳秒脉冲电场作用下细胞存活率检测以及三维水凝胶模拟组织消融实验,分析了三株同源细胞对高压纳秒脉冲电场的敏感性差异以及消融阈值场强差异。研究表明,A375/R对高压纳秒脉冲电场响应最敏感,同样的脉冲参数作用下,细胞存活率表现为A375/R<A375<HaCaT,消融面积表现为A375/R>A375>HaCaT,消融阈值场强表现为A375/R<A375<HaCaT。结果表明,同源细胞在高压纳秒脉冲作用下的存活率具有显著性差异,脉冲电场对高恶性程度的黑色素瘤耐药细胞的杀伤和消融效果更强。本研究对高压纳秒脉冲电场在治疗肿瘤及其肿瘤耐药细胞方面具有潜在的医学应用价值。
参考文献
[1] Youlden D R, Khosrotehrani K, Green A C, et al. Diagnosis of an additional in situ melanoma does not influence survival for patients with a single invasive melanoma: a registry-based follow-up study[J]. Australasian Journal of Dermatology, 2016, 57(1): 57-60.
[2] Nornal M, Wright C Y. The epidemiology of cutaneous melanoma in the white and black African population groups in South Africa[M]. Brisbane (AU): Cutaneous Melanoma: Etiology and Therapy, 2017.
[3] 陈敏华, Goldberg N S. 肝癌射频消融: 基础与临床[M]. 北京: 人民卫生出版社, 2009.
[4] 安东均, 郑晓燕, 张成. 358例肝肿瘤微波消融并发症的临床分析[J]. 肝胆外科杂志, 2015, 23(1): 24-26.
An Dongjun, Zheng Xiaoyan, Zhang Cheng. A clinical study of complications arising from micro- wave ablation for 358 liver tumors[J]. Journal of Hepatobiliary Surgery, 2015, 23(1): 24-26.
[5] 张积仁. 氩氦刀冷冻消融治疗肿瘤[J]. 中国肿瘤, 2007, 16(5): 335-337.
Zhang Jiren. Argon-helium cryoablation in the treatment for cancer[J]. Bulletin of Chinese Cancer, 2007, 16(5): 335-337.
[6] 苏海兵, 邹建中, 王智彪. 高强度聚焦超声肿瘤治疗技术原理[J]. 中华肝胆外科杂志, 2011, 17(3): 271-272.
Su Haibing, Zou Jianzhong, Wang Zhibiao. Mechanism of high intensity focused ultrasound thermal ablation therapy[J]. Chinese Journal of Hepatobiliary Surgery, 2011, 17(3): 271-272.
[7] Hamid O, Robert C, Daud A, et al. Five-year survival outcomes for patients with advanced melanoma treated with pembrolizumab in KEYNOTE-001[J]. Annals of Oncology, 2019, 30(4): 582-588.
[8] Si Lu, Kong Yan, Xu Xiaowei, et al. Prevalence of BRAF V600E mutation in Chinese melanoma patients: large scale analysis of BRAF and NRAS mutations in a 432-case cohort[J]. European Journal of Cancer, 2012, 48(1): 94-100.
[9] Zaretsky J M, Garcia-Diaz A, Shin D S, et al. Mutations associated with acquired resistance to PD-1 blockade in melanoma[J]. The New England Journal of Medicine, 2016, 375(9): 819-829.
[10] Shi Wenyin. Radiation therapy for melanoma[M]. Brisbane (AU): Cutaneous Melanoma: Etiology and Therapy, 2017.
[11] Dummer R, Ascierto P A, Gogas H J, et al. Overall survival in patients with BRAF-mutant melanoma receiving encorafenib plus binimetinib versus vemurafenib or encorafenib (COLUMBUS): a multicentre, open-label, randomised, phase 3 trial[J]. The Lancet Oncology, 2018, 19(10): 1315-1327.
[12] Sosman J A, Kim K B, Schuchter L, et al. Survival in BRAF V600-mutant advanced melanoma treated with vemurafenib[J]. The New England Journal of Medicine, 2012, 366(8): 707-714.
[13] 齐忠慧, 斯璐. 恶性黑色素瘤治疗新进展[J]. 中国肿瘤临床, 2019, 46(5): 213-217.
Qi Zhonghui, Si Lu. Advances in the treatment of malignant melanoma[J]. Chinese Journal of Clinical Oncology, 2019, 46(5): 213-217.
[14] Solyanik G I. Multifactorial nature of tumor drug resistance[J]. Experimental Oncology, 2010, 32(3): 181-185.
[15] YuTinghe, Luo Li, Wang Li. Ultrasound as a cancer chemotherapy sensitizer: the gap between laboratory and bedside[J]. Expert Opinion on Drug Delivery, 2016, 13(1): 37-47.
[16] Ren Wei, Beebe S J. An apoptosis targeted stimulus with nanosecond pulsed electric fields (nsPEFs) in E4 squamous cell carcinoma[J]. Apoptosis, 2011, 16(4): 382-393.
[17] Miklavčič D, Serša G, Brecelj E, et al. Electro- chemotherapy: technological advancements for efficient electroporation-based treatment of internal tumors[J]. Medical & Biological Engineering & Computing, 2012, 50(12): 1213-1225.
[18] Nuccitelli R, Berridge J C, Mallon Z, et al. Nanoelectroablation of murine tumors triggers a CD8- dependent inhibition of secondary tumor growth[J]. PLoS One, 2015, 10(7): e0134364.
[19] 程显, 陈硕, 吕彦鹏, 等. 纳秒脉冲作用下核孔复合体影响细胞核膜电穿孔变化的仿真研究[J]. 电工技术学报, 2021, 36(18): 3821-3828.
Cheng Xian, Chen Shuo, Lü Yanpeng, et al. Simulation study on the effect of nuclear pore complexes on cell electroporation under nanosecond pulse[J]. Transactions of China Electrotechnical Society, 2021, 36(18): 3821-3828.
[20] 李成祥, 李新皓, 柯强, 等. 纳/微秒复合脉冲提高细胞电融合效率的仿真与实验研究[J]. 电工技术学报, 2022, 37(6): 1522-1532.
Li Chengxiang, Li Xinhao, Ke Qiang, et al. Simulation and experimental research on improving the efficiency of cell electrofusion by nano-microsecond pulsed electric fields[J]. Transactions of China Electrotechnical Society, 2022, 37(6): 1522-1532.
[21] Peng Wencheng, Polajžer T, Yao Chenguo, et al. Dynamics of cell death due to electroporation using different pulse parameters as revealed by different viability assays[J]. Annals of Biomedical Engineering, 2024, 52(1): 22-35.
[22] 米彦, 代璐健, 刘权, 等. 靶向金纳米棒联合纳秒脉冲电场对体外A375黑色素瘤2D模拟组织的消融效果研究[J]. 电工技术学报, 2021, 36(18): 3766-3775.
Mi Yan, Dai Lujian, Liu Quan, et al. Ablation effects of A375 melanoma cells treated by targeted gold nanorods combined with nanosecond pulsed electric fields[J]. Transactions of China Electrotechnical Society, 2021, 36(18): 3766-3775.
[23] 米彦, 吴晓, 徐进, 等. 细胞膜力学性能对电穿孔影响的仿真研究[J]. 电工技术学报, 2022, 37(17): 4326-4334, 4400.
Mi Yan, Wu Xiao, Xu Jin, et al. Simulation study on the effect of cell membrane mechanical properties on electroporation[J]. Transactions of China Electrotechnical Society, 2022, 37(17): 4326-4334, 4400.
[24] Gianulis E C, Labib C, Saulis G, et al. Selective susceptibility to nanosecond pulsed electric field (nsPEF) across different human cell types[J]. Cellular and Molecular Life Sciences, 2017, 74(9): 1741-1754.
[25] Ivey J W, Latouche E L, Sano M B, et al. Targeted cellular ablation based on the morphology of malignant cells[J]. Scientific Reports, 2015, 5: 17157.
[26] 吴晓, 米彦, 郑伟, 等. 脉冲电场对细胞膜电穿孔面积的影响研究[J]. 电工技术学报, 2023, 38(14): 3779-3788.
Wu Xiao, Mi Yan, Zheng Wei, et al. Effect of pulsed electric field on electroporation area of cell membrane[J]. Transactions of China Electrotechnical Society, 2023, 38(14): 3779-3788.
[27] 姚陈果, 宁郡怡, 刘红梅, 等. 微/纳秒脉冲电场靶向不同尺寸肿瘤细胞内外膜电穿孔效应研究[J]. 电工技术学报, 2020, 35(1): 115-124.
Yao Chenguo, Ning Junyi, Liu Hongmei, et al. Study of electroporation effect of different size tumor cells targeted by micro-nanosecond pulsed electric field[J]. Transactions of China Electrotechnical Society, 2020, 35(1): 115-124.
[28] 刘红梅, 董守龙, 宁郡怡, 等. 纳秒脉冲高频透膜效应优先杀伤化疗抗性肿瘤细胞的仿真与实验研究[J]. 电工技术学报, 2019, 34(22): 4839-4848.
Liu Hongmei, Dong Shoulong, Ning Junyi, et al. Simulation and experimental study on preferential killing of chemoresistance tumor cells induced by the high-frequency permeation effect of nanosecond pulse field[J]. Transactions of China Electrotechnical Society, 2019, 34(22): 4839-4848.
[29] 王昌金, 姚陈果, 董守龙, 等. 基于Marx和LTD拓扑的全固态复合模式脉冲源的研制[J]. 电工技术学报, 2018, 33(13): 3089-3097.
Wang Changjin, Yao Chenguo, Dong Shoulong, et al. The development of all solid-state mixed pulse generator based on Marx and LTD topologies[J]. Transactions of China Electrotechnical Society, 2018, 33(13): 3089-3097.
[30] Yao Chenguo, Liu Hongmei, Zhao Yajun, et al. Analysis of dynamic processes in single-cell electroporation and their effects on parameter selection based on the finite-element model[J]. IEEE Transactions on Plasma Science, 2017, 45(5): 889-900.
[31] Wegner L H, Frey W, Schönwälder S. A critical evaluation of whole cell patch clamp studies on electroporation using the voltage sensitive dye ANNINE-6[J]. Bioelectrochemistry (Amsterdam, Netherlands), 2013, 92: 42-46.
[32] Tolstykh G P, Beier H T, Roth C C, et al. Activation of intracellular phosphoinositide signaling after a single 600 nanosecond electric pulse[J]. Bioelectrochemistry (Amsterdam, Netherlands), 2013, 94: 23-29.
Abstract In terms of biological effects caused by the pulsed electric fields, the duration of the nanosecond pulse is less than the charging time constant of the cell membrane (~1 μs), which has more profound effects on the intracellular organelles, known as the intracellular electron-manipulation. Based on this, the nanosecond pulsed electric fields (nsPEFs) have unique bioelectromagnetic properties in the field of tumor ablation. Therefore, the killing effects of homologous cells under the action of nsPEFs are studied to investigate the difference between homologous cells and high-voltage nsPEFs.
The homologous cells, human immortal keratinocytes (HaCaT), human melanoma cells (A375), and human melanoma chemoresistant cells (A375/R) are chosen as research objects. The homemade pulse generator can output high-voltage nanosecond pulses with flexible and adjustable parameters. The selected pulse parameters are 5 kV/cm to 15 kV/cm field intensity, 300 ns pulse width, 1 Hz repetition frequency, and 80 pulse number. Cell viability assay based on CCK-8 is used to study the survival rate of homologous cells after pulse treatment. The ablation effect of nanosecond pulses is further studied based on hydrogel-simulated tissue. The lethal threshold for a specific ablation area is calculated. Furthermore, the electroporation response of the single cell to the nanosecond pulse is simulated by the finite element simulation model.
The survival rate of the three cells decreases with the increase of the electric field intensity of nsPEFs. The cell viability assay shows that with the same nsPEFs parameters, the survival rate of normal cells is the highest, followed by tumor cells, and tumor chemoresistant cells have the lowest survival rate. The results of the hydrogel simulated tissue ablation experiment show that with the same pulse parameters, the ablation area of tumor chemoresistant cells is the largest, reaching (20.28±0.85) mm2, and the ablation area of normal cells is the smallest, only (10.26±0.49) mm2. Meanwhile, the lethal threshold of normal and chemoresistant cells is (7.15±0.65) kV/cm and (4.75±0.15) kV/cm, respectively, with a difference of approximately 2.4 kV/cm. Significant differences exist in the sensitivity of normal, tumor, and tumor chemoresistant cells to the high- voltage nanosecond pulsed electric fields. The nsPEFs have the least effect on normal cells and the strongest effect on tumor chemoresistant cells.
To analyze the potential reasons for the killing difference of cells by nsPEFs, the cell size and nucleus size of HaCaT, A375, and A375/R cells are measured and recorded by fluorescence microscopy. The differences between HaCaT, A375, and A375/R are significant in the nucleus size. Based on the real cell geometry, the electroporation area and the pore number in the nuclear membrane are simulated. The results suggest that the difference in cell response to nsPEFs may be related to the nucleus size. Hence, tumor chemoresistant cells with larger nuclei are more susceptible to nsPEFs. High-voltage nanosecond pulsed electric fields have potential clinical applications in tumor ablation without affecting surrounding normal tissues.
keywords: Nanosecond pulsed electric fields, homologous cells, cell viability, hydrogel scaffolds, killing difference
中图分类号:TM836; Q64
DOI: 10.19595/j.cnki.1000-6753.tces.231473
国家自然科学基金(52237010)和中央高校基本科研业务费医工融合专项(2023CDJYGRH-ZD04)资助项目。
收稿日期 2023-09-06
改稿日期 2023-09-25
彭文成 男,1994年生,博士研究生,研究方向为脉冲功率技术及其生物医学应用。E-mail: pengwencheng@cqu.edu.cn
姚陈果 男,1975年生,教授,博士生导师,研究方向为脉冲功率技术及其生物医学应用。E-mail: yaochenguo@cqu.edu.cn(通信作者)
(编辑 崔文静)