 表示为
表示为摘要 经颅磁声电刺激(TMAES)是一种新型、无创、可改变不同脑区电活动的神经调控方法。前额叶皮层与基底神经节中各脑区相互影响,在行为决策中起着关键作用,然而目前涉及其调节机理的研究相对较少。前运动皮层神经元活性和前额叶皮层突触可塑性与行为决策关系密切。该文基于皮层-基底神经节回路模型,模拟分别对健康大鼠、帕金森大鼠施加刺激后,不同脑区在奖赏选择任务中的神经活动,仿真分析不同感应电流强度对皮层神经元放电率和脑区间突触权重的影响。并通过行为学实验进一步探讨经颅磁声电刺激对健康大鼠与帕金森模型大鼠行为决策的影响。仿真结果显示,对健康大鼠施加刺激可提高前额叶皮层与纹状体、前运动皮层之间的突触权重;对帕金森大鼠施加刺激可提高前运动皮层神经元放电率,调节前额叶皮层与纹状体、前运动皮层之间的突触权重。实验结果显示,施加刺激后,大鼠的学习探索能力和空间记忆能力均得到了提高,且帕金森模型大鼠受刺激的作用效果更显著。研究结果表明,经颅磁声电刺激可提高大鼠的运动积极性和学习效率,且有助于改善基底神经节的功能失衡。研究结果为进一步探索经颅磁声电刺激调节决策认知功能的作用机制奠定基础。
关键词:经颅磁声电刺激 皮层神经元 基底神经节 行为决策 突触权重
人或动物通过感知视觉、听觉、触觉等信息来认识外部世界,只有大脑对这些信息做出正确的编码和适当的选择,才可形成有效的决策,这一信息处理过程在行为表现、学习和社交等方面发挥重要作用。个体权衡每个选项的付出代价和获得收益,并在此基础上对不同行动方案进行选择的过程称为行为决策,这一过程包括相继五个部分:表征、行动价值评估、行动选择、结果价值评估和更新学 习[1-2]。已有研究表明,前额叶皮层与基底神经节中各脑区相互影响,在行为决策过程中发挥着重要作用[3]。皮层-基底神经节神经环路主要由前额叶皮层(Prefrontal Cortex, PFC)、纹状体(Striatum, STR)、黑质(Substantia Nigra, SN)、苍白球(Globus Pallidus, GP)和前运动皮层(Premotor Cortex, PMC)等多个脑区构成,在行为决策过程中扮演着重要角色。
前额叶皮层接受外周感觉信息的同时,将信息传递到基底神经节,纹状体接收来自皮层的神经投射,编码后传至丘脑,丘脑再传递给前运动皮层,最终由前运动皮层控制目标动作的执行。已有研究指出,在奖励相关的实验中发现,不同脑区参与行为决策的不同过程。其中,前额叶皮层能够基于之前的选择结果更新处理信息策略,在适应性决策中发挥重要作用;纹状体参与了加工处理备选项目以及评价行为结果的过程;前运动皮层主要负责执行选择的行为和行动监测。同时,前额叶皮层与纹状体之间的突触连接可反映大脑评估行动价值的能力,前额叶皮层与前运动皮层之间的突触连接强度主要体现大脑的探索与学习记忆能力[4]。因此,开展对皮层-基底神经节神经环路调控机理的研究对行为决策过程至关重要。
目前,神经科学研究领域代表性的神经调控手段包括脑深部电刺激、经颅磁刺激、经颅超声刺激和经颅直流电刺激,在脑神经调控研究中已取得重要成果[5-7]。经颅磁声电刺激是一种新型、无创的神经调控方法,具有操作简便、安全可靠、空间分辨率高、刺激深度大等优点[8]。早在2003年,S. J. Norton通过理论分析计算,提出了对静磁场中生物组织施加超声刺激的设想,该设想计算出的磁声耦合电场可达到神经调控的有效刺激强度,理论上证实了磁声耦合刺激对脑神经进行精准有效调控的可行性[9]。2018年,刘世坤等对健康、帕金森鼠施加经颅磁声刺激,研究结果表明磁声刺激可提高帕金森鼠的主动探索学习能力和运动能力,且施加刺激后,帕金森鼠海马区黑质神经突触活性提高[10]。2021年,Zhang Yanqiu等通过仿真分析经颅磁声电刺激参数对帕金森病基底神经节-丘脑神经网络的影响,结果表明,当施加声强为0.1~0.3 W/cm2超声刺激丘脑底核时,经颅磁声电刺激可以有效调节帕金森症状[11]。2021年,张帅等通过搭建脑皮层神经网络模型,对神经元局部场电位信号进行时频分析,仿真结果显示,经颅磁声电刺激对神经元电活动产生兴奋、抑制两种作用效果,改变刺激参数可调节生物体神经电活动[12]。以上研究从实验与仿真两个方面验证了经颅磁声电刺激技术调节神经活动的有效性,可提高动物的学习能力与运动能力,然而还需要更多的实验和理论研究探究其如何调控神经回路的生理机制。
本研究首先通过建立经颅磁声电刺激皮层-基底神经节环路模型,仿真分析感应电流强度对健康与帕金森模型大鼠神经元放电率和突触可塑性的影响,然后通过T迷宫行为学实验,探讨经颅磁声电刺激对健康大鼠、帕金森模型大鼠行为决策的影响,为进一步探索经颅磁声电刺激调节决策认知功能的作用机制提供新思路。
经颅磁声电刺激是指超声与静磁场作用于大脑时,神经组织中的带电粒子由超声引起振动,在静磁场下受到洛伦兹力的作用发生定向移动,产生感应电流,进而起到神经调控的作用。
带电粒子在静磁场中受到的洛伦兹力 表示为
表示为
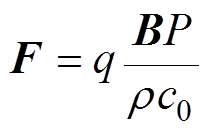 (1)
(1)
式中,q为带电粒子的电荷量;B为磁感应强度;P为超声压强;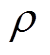 为组织密度;
为组织密度;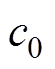 为超声在组织中的传播速度。
为超声在组织中的传播速度。
感应电流密度J0表示为
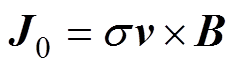 (2)
(2)
式中,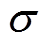 为组织电导率;v为离子振动速度。则组织中产生的感应电流强度Iext可表示为
为组织电导率;v为离子振动速度。则组织中产生的感应电流强度Iext可表示为
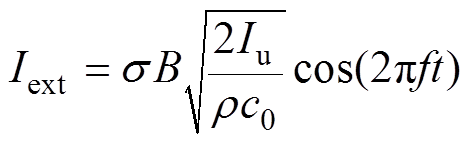 (3)
(3)
式中,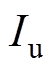 为超声强度;f为超声基波频率。
为超声强度;f为超声基波频率。
图1所示为皮层-基底神经节环路结构示意图。脊椎动物中基底神经节接收来自前额叶皮层(PFC)的输入信号,苍白球(GP)为基底神经节的输出结构,神经信息编码后经由GP投射到相应大脑皮层运动区域。PFC向基底神经节输入信号的关键靶点是纹状体(Str),主要由中型多棘神经元(Medium Spiny Neurons, MSNs)组成。图中,MSN1、MSN2分别表示动作1、2对应的纹状体中神经核团(后文用纹状体神经核团1、2表示)[13]。黑质致密部(Substantia Nigra pars compacta, SNc)主要构成多巴胺能系统,其中的多巴胺能神经元发出奖励预测误差信号,该信号可以改变前额叶皮层与纹状体之间的突触连接强度,促进基于奖赏行为的学习。图中,PMC1、PMC2分别表示动作1、2激活的前运动皮层中神经核团(后文用前运动皮层神经核团1、2表示)[14]。根据中型多棘神经元表达多巴胺受体的不同,神经环路分为直接通路和间接通路,直接通路中纹状体内神经元主要表达D1受体,激活直接通路促进运动皮层活动;间接通路中纹状体内神经元主要表达D2受体,激活间接通路抑制运动皮层活动。这两条通路相互拮抗共同发挥功能,对基底神经节功能平衡起重要调节作用[15-16]。
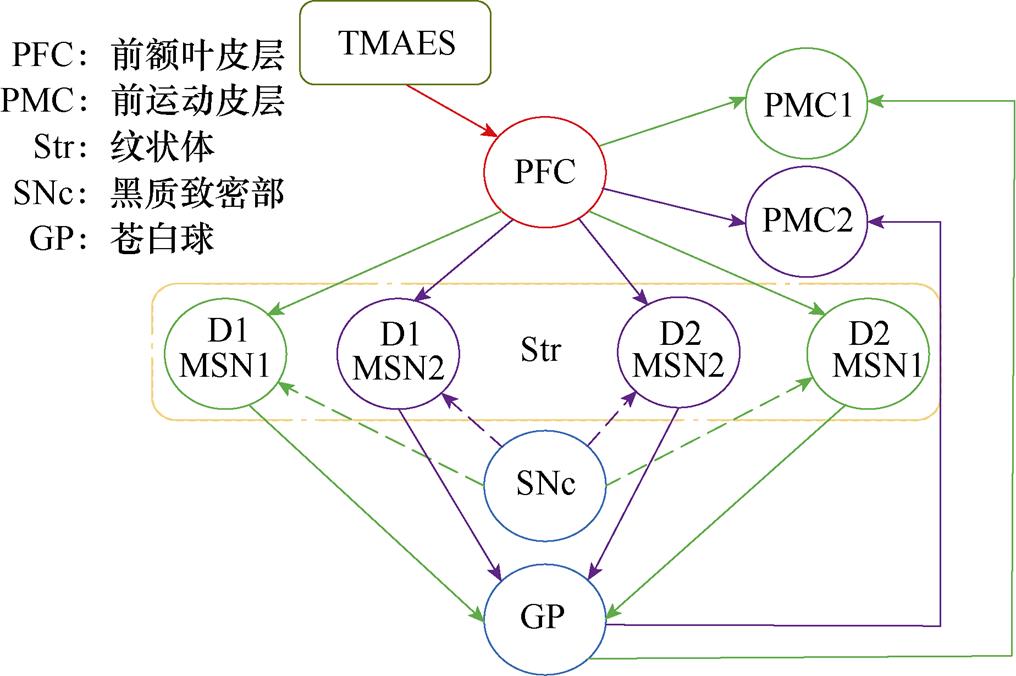
图1 皮层-基底神经节环路结构示意图
Fig.1 Cortex-basal ganglia circuit diagram
本研究通过仿真模拟大鼠执行双选项强迫选择(Two-Alternative Forced Choice, 2AFC)任务,大鼠从向左或者向右两个动作中选择其中一个,向左运动为动作1,向右运动为动作2。在1~200次试验中,大鼠执行动作1会获得食物奖励,执行动作2则不会获得食物奖励,200~400次试验为反转训练,大鼠执行动作2会获得食物奖励,执行动作1将不会获得食物奖励。图1所示结构中的两条通道(绿色通道和紫色通道)表示两个动作之间的竞争关系,系统由两组神经核团组成,分别负责动作1、2的执行。前运动皮层神经核团1、2放电率反映了大鼠的动作选择,在每次试验结束时,当大鼠选择了动作1,前运动皮层神经核团1放电率将超过核团2;当大鼠选择动作2,神经核团2的放电率将超过核团1。前额叶皮层与纹状体之间的突触权重反映了大脑评估行动价值的能力,每次试验结束后,突触权重根据大鼠的行为结果进行更新,体现了大鼠行为决策的能力。前额叶皮层与前运动皮层之间了突触权重反映了的大鼠学习记忆能力,根据Hebbian突触可塑性理论更新。
脊椎动物在执行奖励相关的任务时,前运动皮层神经元放电率可反映动物的运动积极性,通过比较前运动皮层放电率的数值大小可推测大鼠是否选择了有奖行为。根据2003年O. Shriki等提出的神经元放电活动控制方程[17],得出神经元放电率与突触输入之间的关系式见式(4)。该模型中引入了标准化响应函数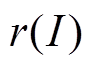 。
。
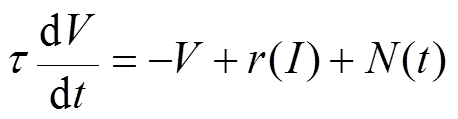 (4)
(4)
式中,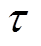 为时间常数;
为时间常数;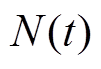 为噪声;
为噪声;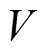 为神经元放电率;I为神经元的突触输入。
为神经元放电率;I为神经元的突触输入。
根据以往实验数据,基底神经节中观察到的神经元放电率差距非常大[15]。为了反映普遍的神经机制,本模型中引入的标准化响应函数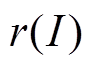 将神经元放电率标准化为0~1之间。
将神经元放电率标准化为0~1之间。
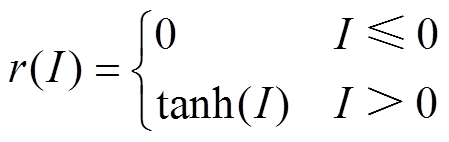 (5)
(5)
研究表明,前额叶皮层与纹状体之间突触权重是可塑的,激活多巴胺受体可诱导二者之间的突触连接增强[18-20]。每次试验结束后,前额叶皮层与纹状体之间突触权重的变化取决于神经元放电率与大鼠行为结果,通过式(6)和式(7)进行增量更新。
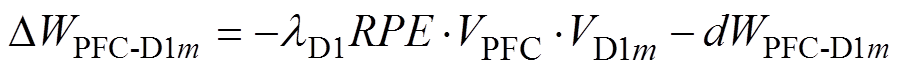 (6)
(6)
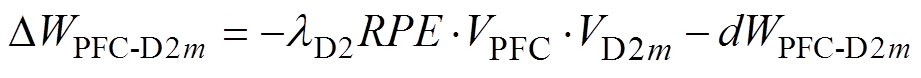 (7)
(7)
式中, 、
、 分别为前额叶皮层与表达D1、D2受体的纹状体之间突触权重增量;
分别为前额叶皮层与表达D1、D2受体的纹状体之间突触权重增量;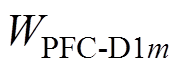 、
、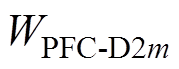 分别为前额叶皮层与表达D1、D2受体的纹状体之间突触权重;
分别为前额叶皮层与表达D1、D2受体的纹状体之间突触权重;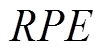 为奖励预测误差值,反映了预期奖励与实际奖励之间的偏差;
为奖励预测误差值,反映了预期奖励与实际奖励之间的偏差;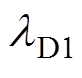 和
和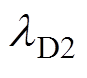 为学习效率常数;d为衰减速率常数;
为学习效率常数;d为衰减速率常数;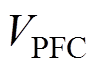 为前额叶皮层神经元放电率;
为前额叶皮层神经元放电率;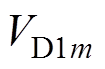 、
、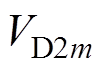 分别为表达D1、D2受体的纹状体内神经元放电率(m= 1, 2)。
分别为表达D1、D2受体的纹状体内神经元放电率(m= 1, 2)。
每次试验结束后,根据Hebbian突触可塑性理论更新前额叶皮层与前运动皮层之间的突触权重,即
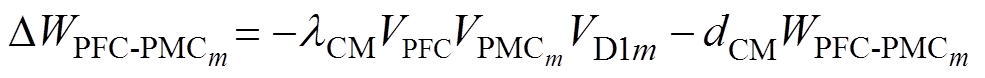 (8)
(8)
式中,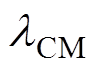 为学习效率;
为学习效率;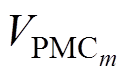 为前运动皮层神经元放电率;dCM为皮层连接的衰减率。
为前运动皮层神经元放电率;dCM为皮层连接的衰减率。
本模型中的电生理参数均根据大鼠的相关参数设置,抑制70%的黑质网状部输出以及改变基底神经节内部神经核团突触权重(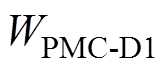 、
、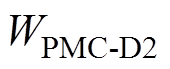 )等参数,可诱导轻度帕金森状态,主要参数取值见表1[18]。通过改变前额叶皮层神经元的突触输入,仿真不同感应电流刺激下各脑区神经核团的放电活动。
)等参数,可诱导轻度帕金森状态,主要参数取值见表1[18]。通过改变前额叶皮层神经元的突触输入,仿真不同感应电流刺激下各脑区神经核团的放电活动。
表1 健康大鼠与帕金森大鼠参数
Tab.1 Parameters of healthy rats and Parkinson rats

参 数数 值 健康大鼠帕金森大鼠 2.001.25 2.002.75
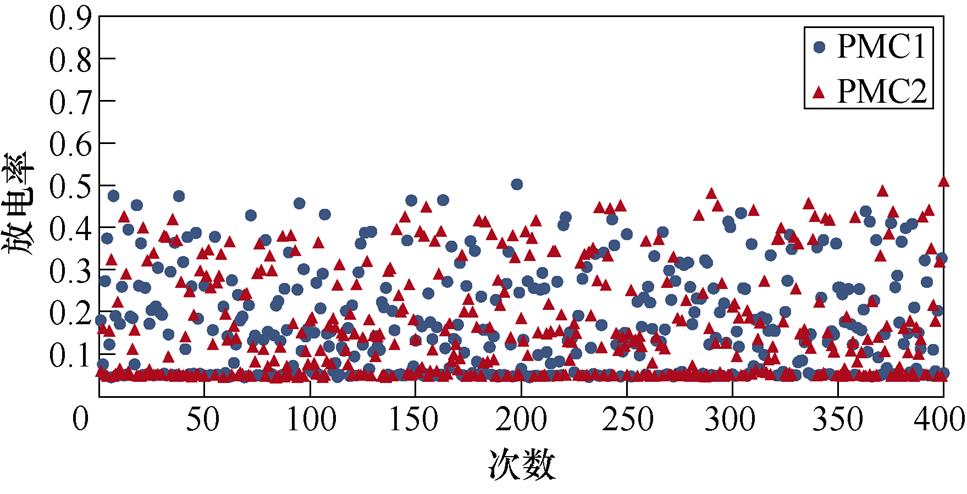
图2所示为不同感应电流刺激下前运动皮层神经元放电情况。PMC1、PMC2分别代表前运动皮层神经核团1、2的放电活动。不加刺激时为对照组,1~200次试验中,多数情况下,前运动皮层神经核团1放电率稳定在0.8左右,神经核团2几乎不放电;200~400次试验中,核团1几乎不放电,核团2的放电率稳定在0.8左右。整个任务中,少数情况下出现神经元放电率在0~0.8之间。施加刺激后,前运动皮层神经元只存在不放电和放电率在0.8左右两种情况。从图2中可以看出,施加刺激后,1~200次试验,前运动皮层神经核团1放电率高于核团2的次数增加;在200~400次试验中,核团2放电率高于核团1的次数增加。
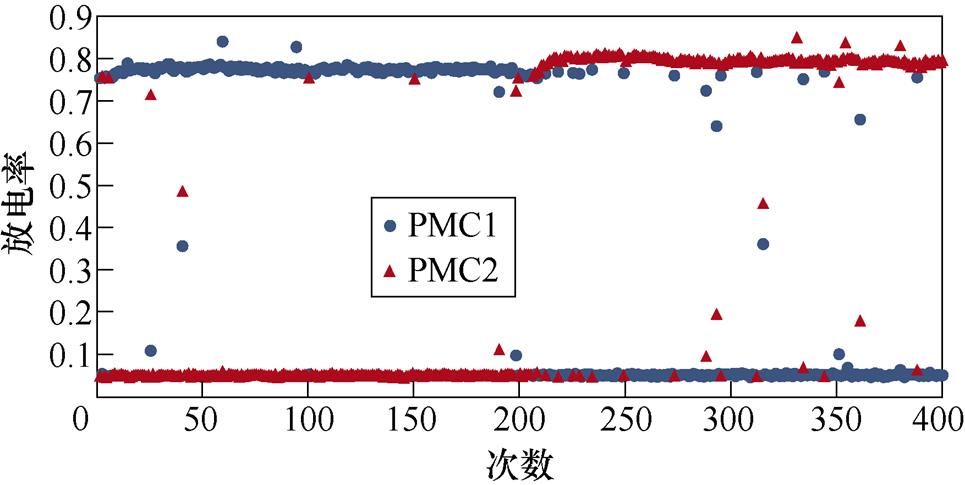
(a)对照组
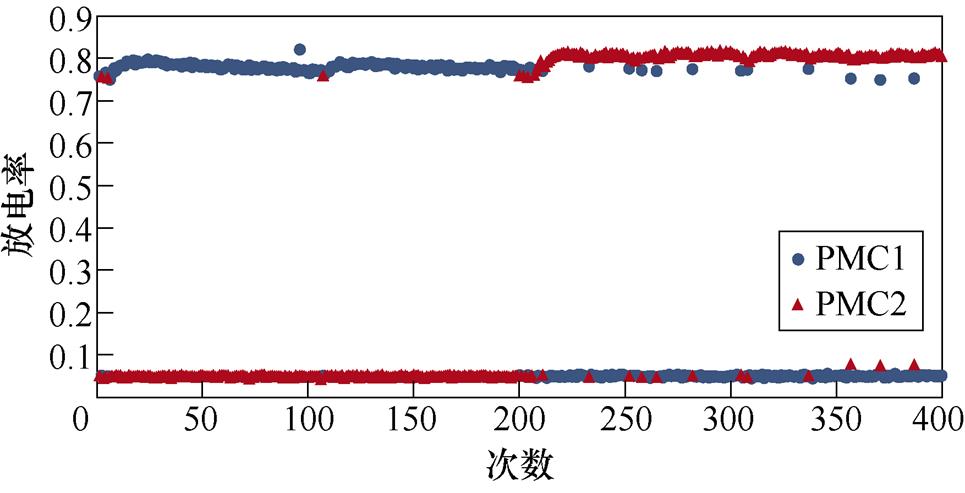
(b)20 mA/cm2
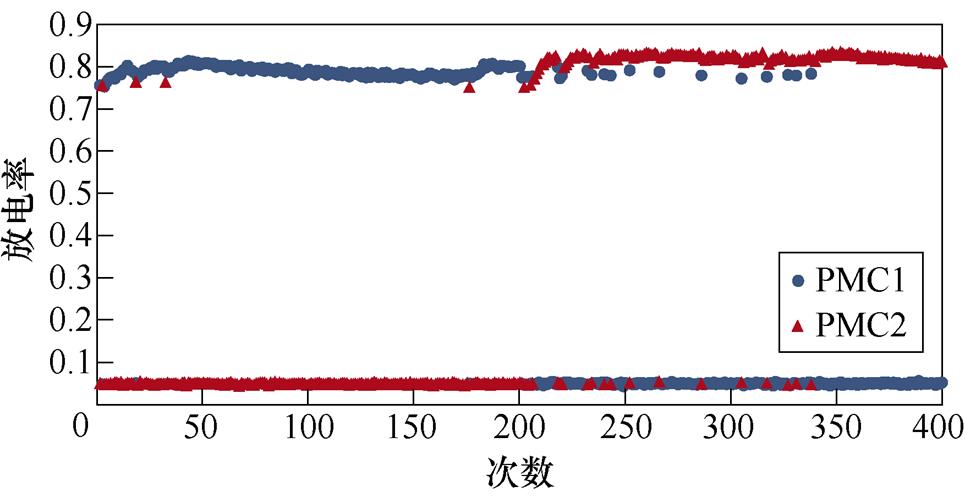
(c)60 mA/cm2
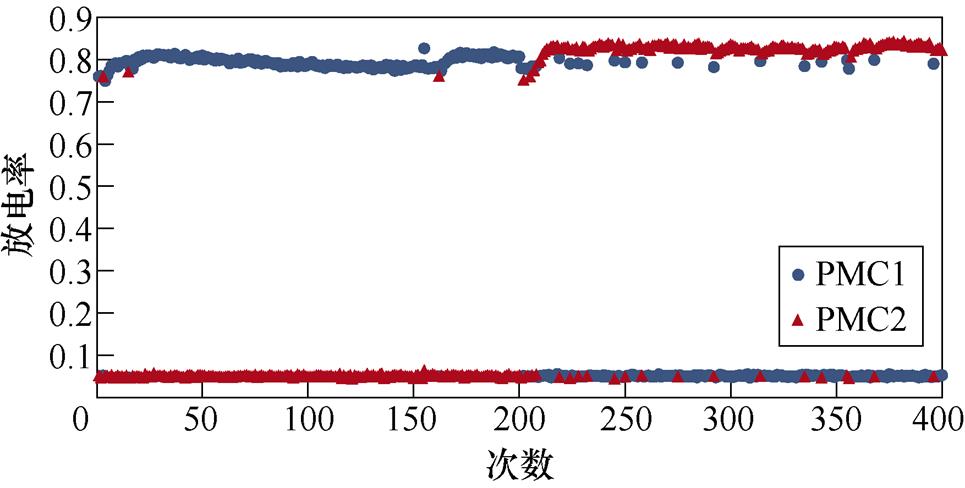
(d)100 mA/cm2
图2 健康大鼠PMC神经元放电活动
Fig.2 PMC neuron activity in healthy rats
图3a、图3b分别为不同感应电流刺激下直接通路中前额叶皮层与纹状体神经核团1、2之间突触权重变化情况。从图3a中可以看出,1~200次试验,施加刺激后,前额叶皮层与纹状体神经核团1之间突触权重增大,且变化程度与感应电流强度呈正相关;200~400次试验中,感应电流的增大对突触权重的影响不明显。从图3b中可以看出,1~200次试验中,施加刺激对前额叶皮层与纹状体神经核团2之间的突触权重几乎无影响;200~400次试验中,不加刺激时,突触权重的幅值约为0.6,施加刺激后,其值随着感应电流的增强而变大,当电流达到100 mA/cm2时,其幅值最大为1.1。
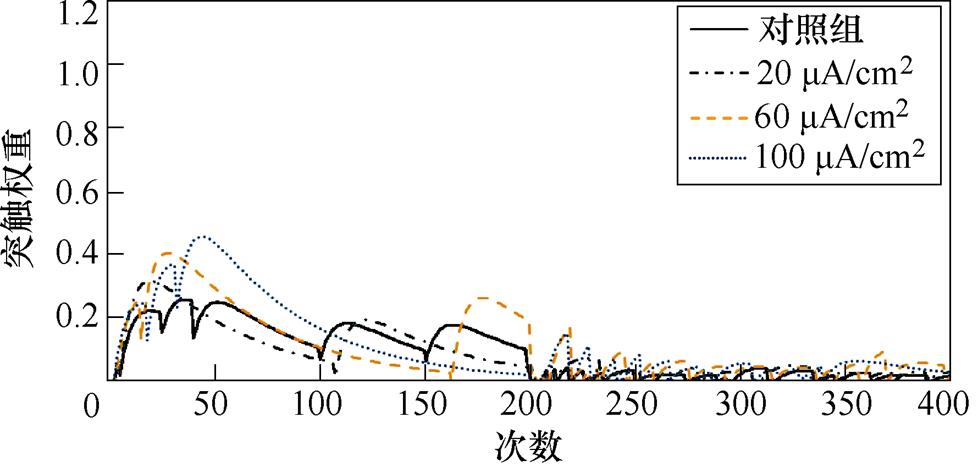
(a)PFC-D1 MSN1
(b)PFC-D1 MSN2
图3 健康大鼠直接通路中PFC-D1 MSNs突触权重
Fig.3 PFC-D1 MSNs synaptic weight in the direct pathway in healthy rats
图4a、图4b分别为不同感应电流刺激下间接通路中前额叶皮层与纹状体神经核团1、2之间突触权重变化情况。从图4a中可以看出,1~200次试验中无论是否施加刺激,前额叶皮层与纹状体神经核团1之间几乎不存在联系,200~400次试验中,其联系强度与感应电流呈正相关。从图4b中可以看出,1~200次试验中,施加刺激后,前额叶皮层与纹状体神经核团2之间突触权重增大,且随着感应电流强度的增大,变化愈发显著;200~400次试验中,感应电流的变化没有对突触权重产生明显影响。
(a)PFC-D2 MSN1
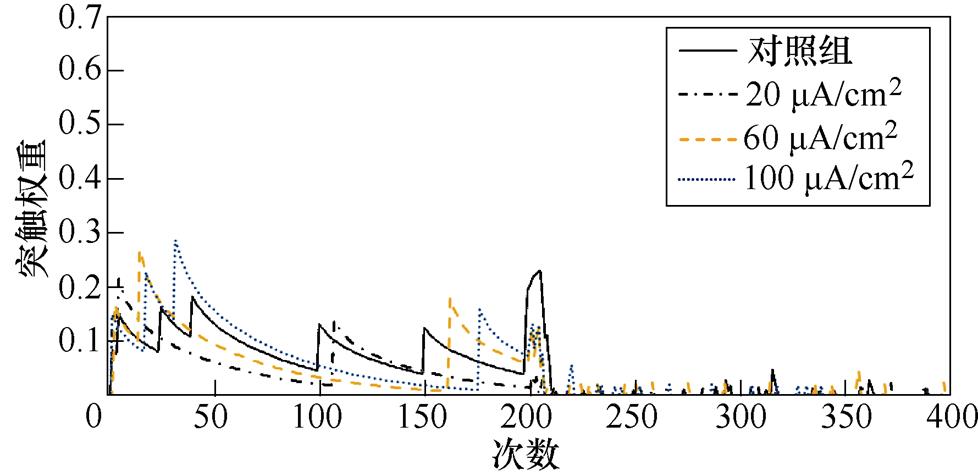
(b)PFC-D2 MSN2
图4 间接通路中PFC-D2 MSNs突触权重
Fig.4 PFC-D2 MSNs synaptic weight in the indirect pathway in healthy rats
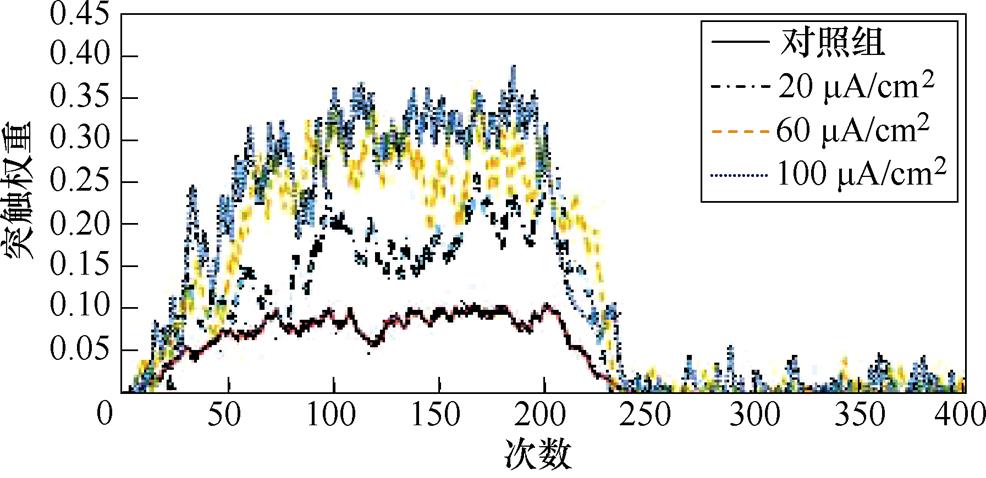
图5a、图5b分别为不同感应电流刺激下前额叶皮层与前运动皮层神经核团1、2之间突触权重变化情况。从图5a中可以看出,对照组在1~200次试验中,突触权重随着试验次数的增加,其值从0开始线性增大,200~400次试验中,其值稳定在0.025左右。施加刺激后,在1~200次试验中,权重增长的幅度随着电流增强明显变大。从图5b中可以看出,1~200次试验中,前额叶皮层与前运动皮层神经核团2之间几乎无联系;200~400次试验中,不加刺激时,突触权重随着试验次数的增加线性增大。施加刺激后,增大尤为明显。
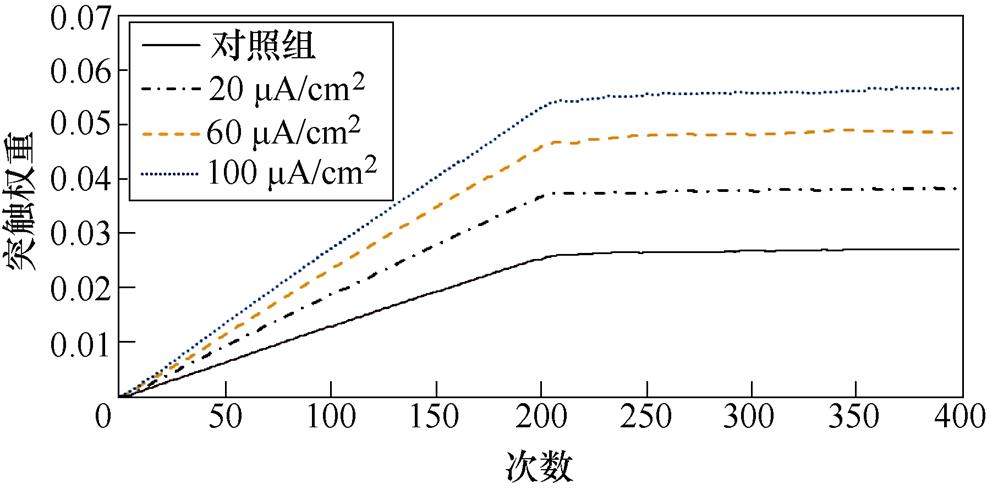
(a)PFC-PMC1
(b)PFC-PMC2
图5 PFC-PMC突触权重
Fig.5 PFC-PMC synaptic weight in healthy rats
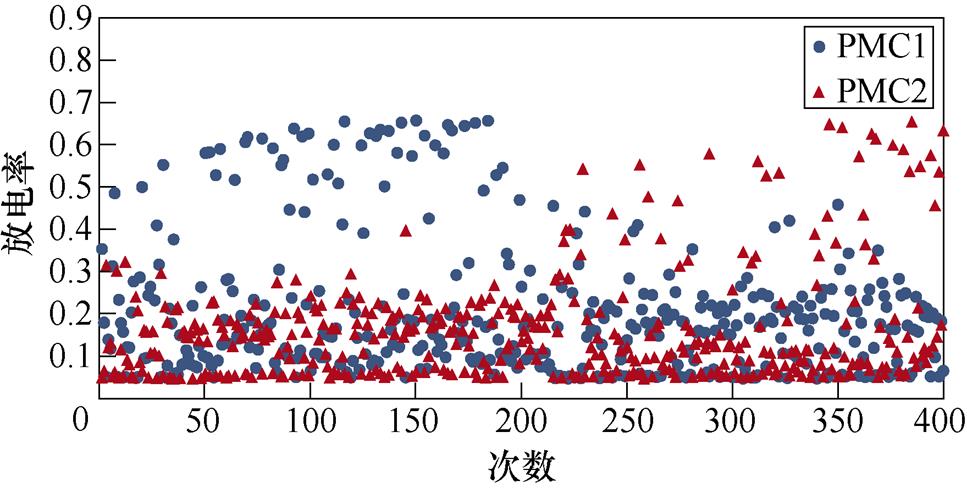
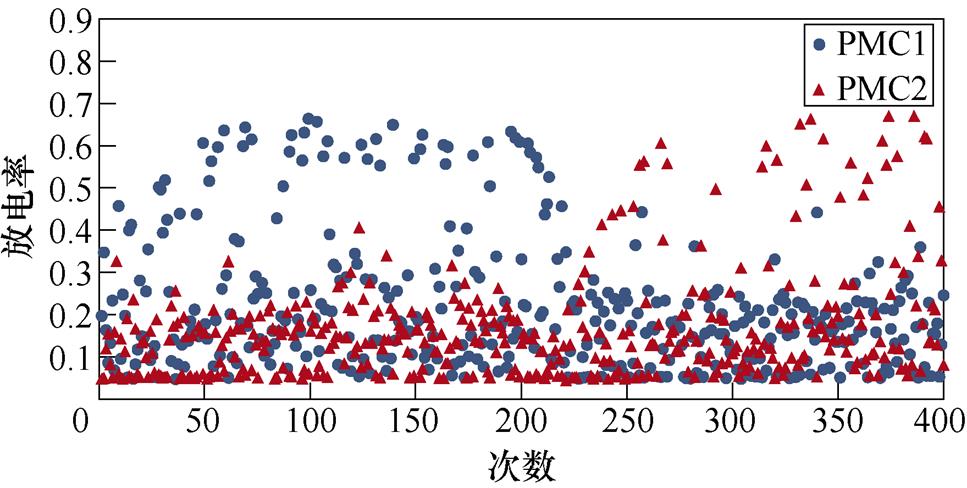
图6所示为不同感应电流刺激下前运动皮层神经元放电情况。不加刺激时,前运动皮层神经核团1、2随机放电,放电率均在0~0.5之间。施加刺激后,1~200次试验中,神经核团1放电率增大,核团2放电率有所减小;200~400次试验中,核团2放电率增大,核团1放电率减小,且随着感应电流强度的增大,变化程度愈发显著。从图中可以明显看出,施加刺激后,随着感应电流的增大,相应的前运动皮层神经元放电率的最大值不断提高,此外,在1~200次试验中,神经核团1的放电率高于核团2的次数有所增加,而在200~400次试验中,核团2的放电率高于核团1的次数不断增加,说明大鼠选择有奖行为的次数增加。表2、表3分别表示健康大鼠和帕金森大鼠在逆转奖励动作前后选择有奖行为的次数。从表中可以看出,帕金森大鼠选择有奖行为的次数明显低于健康大鼠,施加刺激后随着感应电流的增大,大鼠选择有奖行为的能力随之提高。
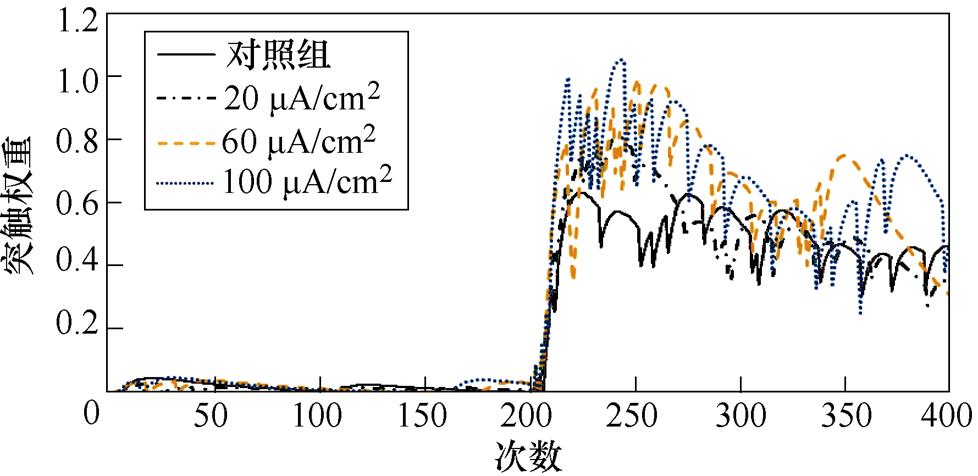
图7a、图7b分别为不同感应电流刺激下直接通路中前额叶皮层与纹状体神经核团1、2之间突触权重变化情况。从图7a中可以看出,帕金森大鼠评估行动价值的能力受损,导致其在230次试验后才能够区分出有奖行为。1~230次试验中,不加刺激时,前额叶皮层与纹状体神经核团1之间的突触权重在0~0.1之间,施加刺激后,其值显著增大,且随着感应电流的提高,增大愈发明显;230~400次试验中,施加刺激对其突触连接几乎无影响。从图7b中可以看出,1~200次试验中感应电流强度不影响前额叶皮层与纹状体神经核团2之间的联系强度;当在第200次试验后逆转有奖行为时,由于帕金森大鼠无法正常评估行动价值,对照组和20 mA/cm2刺激组大鼠在短试验次数内仍维持之前的突触权重,并在每次更新行动价值后缓慢增大,而当感应电流为60 mA/cm2和100 mA/cm2时,逆转有奖行为后,突触权重在短试验次数内降为零后又迅速增大,说明对帕金森大鼠施加感应电流高于60 mA/cm2的刺激后,大鼠对奖赏行为变得更敏感,且在200~400次试验中,每组突触权重的最大值与感应电流强度呈正相关,说明施加刺激后,大鼠评估行动价值的能力随着感应电流的增大而提高。
(a)对照组
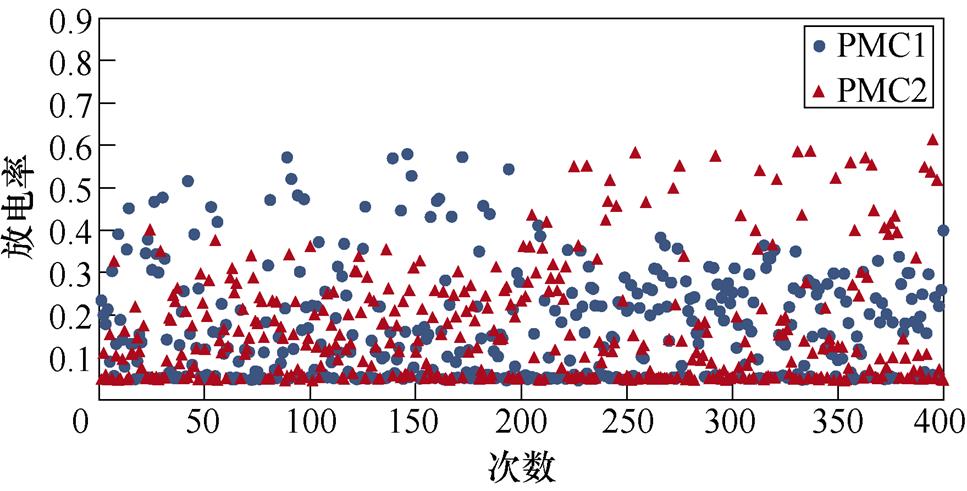
(b)20 mA/cm2
(c)60 mA/cm2
(d)100 mA/cm2
图6 帕金森大鼠PMC神经元放电活动
Fig.6 PMC neuron activity in Parkinson's rats
表2 1~200次试验中选择有奖行为次数
Tab.2 Number of rewarded behaviors selected in 1~200 trials

组别健康大鼠帕金森大鼠 对照组17794 20 mA/cm2189105 60 mA/cm2192127 100 mA/cm2195133
表3 200~400次试验中选择有奖行为次数
Tab.3 Number of rewarded behaviors selected in 200~400 trials

组别健康大鼠帕金森大鼠 对照组16784 20 mA/cm2179101 60 mA/cm2182120 100 mA/cm2187129
(a)PFC-D1 MSN1
(b)PFC-D1 MSN2
图7 帕金森大鼠直接通路中PFC-D1 MSNs突触权重
Fig.7 PFC-D1 MSNs synaptic weight in the direct pathway in Parkinson's rats
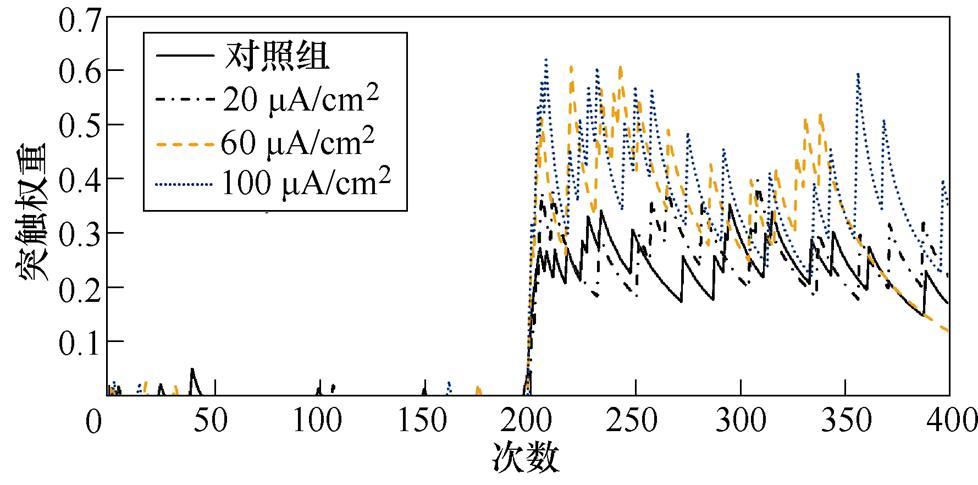
图8a、图8b分别为不同感应电流下间接通路中前额叶皮层与纹状体之间突触权重变化情况。可以看出,帕金森状态下,施加刺激对间接通路中前额叶皮层与纹状体之间的联系强度几乎无影响。1~200次试验中,前额叶皮层与核团1之间的突触权重在0.05~0.2之间;200~400次试验中,与核团2之间的突触权重在0.08~0.18之间。前额叶皮层与纹状体之间的突触权重反映了大脑评估行动价值的能力,直接通路中突触权重值越高表示大脑对行动价值评估越高,而间接通路中突触权重值越高表示大脑对行动价值评估越低。表4、表5分别列出了健康大鼠和帕金森大鼠在直接通路、间接通路中突触权重的最大值,结合以上前额叶皮层与纹状体之间突触权重仿真结果可以看出,其值越大表明大鼠越偏向于选择有奖行为。从表中看出,帕金森大鼠突触权重最大值明显低于健康大鼠,施加刺激后,直接通路中突触权重的最大值与感应电流呈正相关(表4),间接通路中健康大鼠突触权重最大值随着感应电流的增加而增大,而帕金森大鼠突触权重的最大值在施加刺激前后变化不明显(表5),以上结果表明施加刺激后在直接通路与间接通路的共同作用下,健康大鼠与帕金森大鼠选择有奖行为的能力均有所提高。
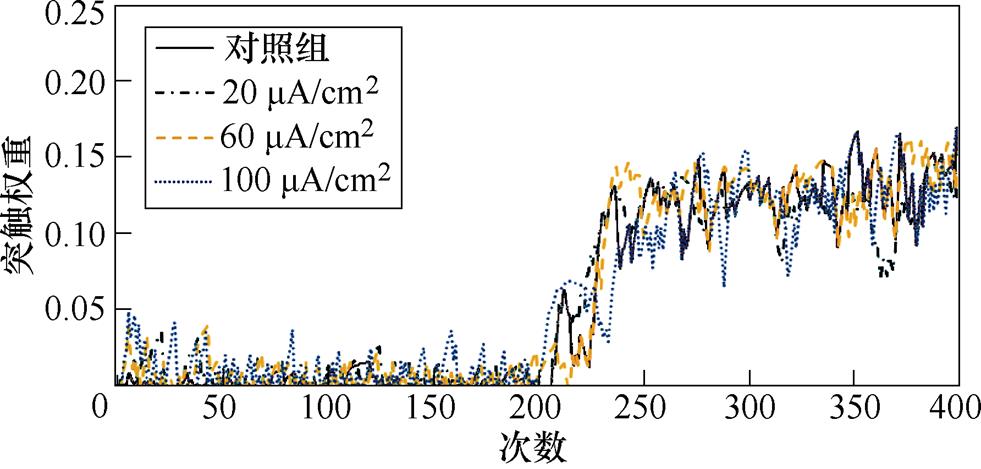
(a)PFC-D2 MSN1
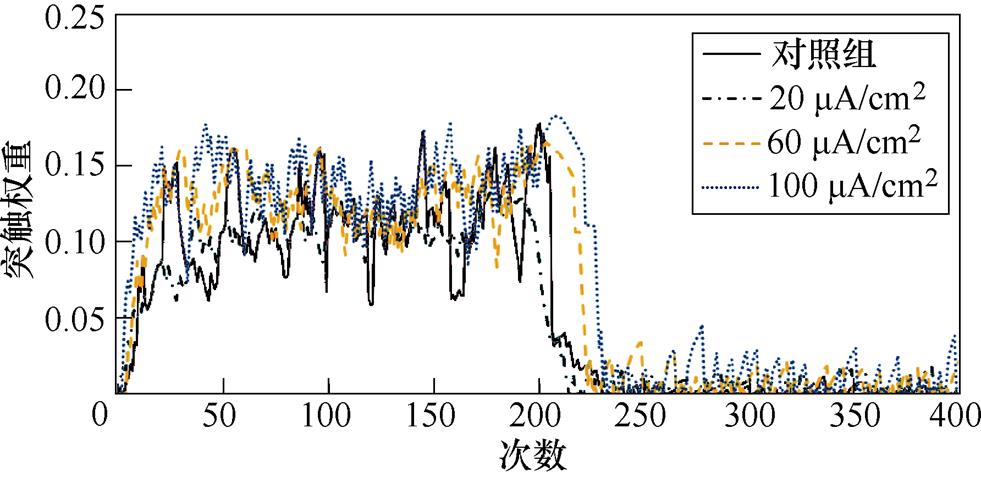
(b)PFC-D2 MSN2
图8 帕金森大鼠间接通路中PFC-D2 MSNs突触权重
Fig.8 PFC-D2 MSNs synaptic weight in the indirect pathway in Parkinson's rats
表4 直接通路中突触权重最大值
Tab.4 Maximum synaptic weight in direct pathway
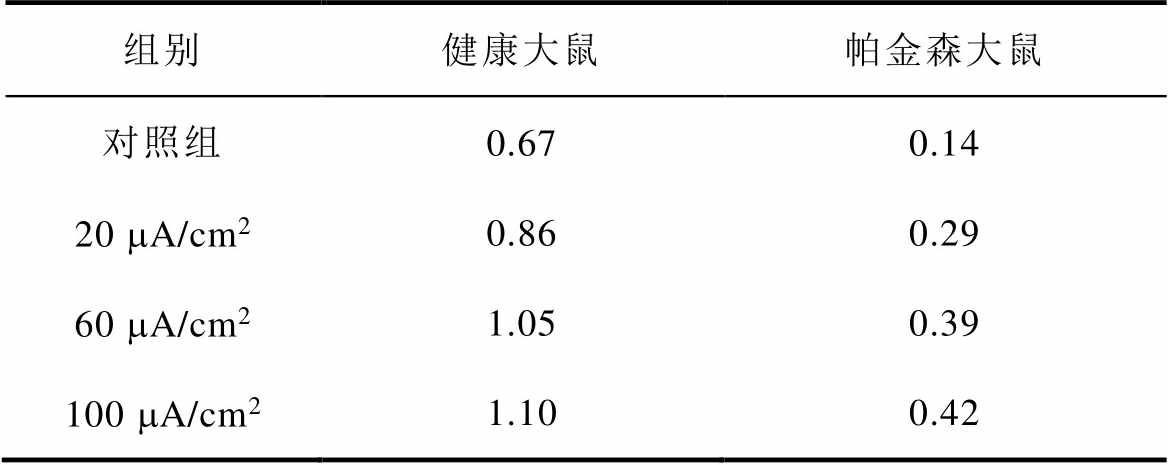
组别健康大鼠帕金森大鼠 对照组0.670.14 20 mA/cm20.860.29 60 mA/cm21.050.39 100 mA/cm21.100.42
表5 间接通路中突触权重最大值
Tab.5 Maximum synaptic weight in indirect pathway
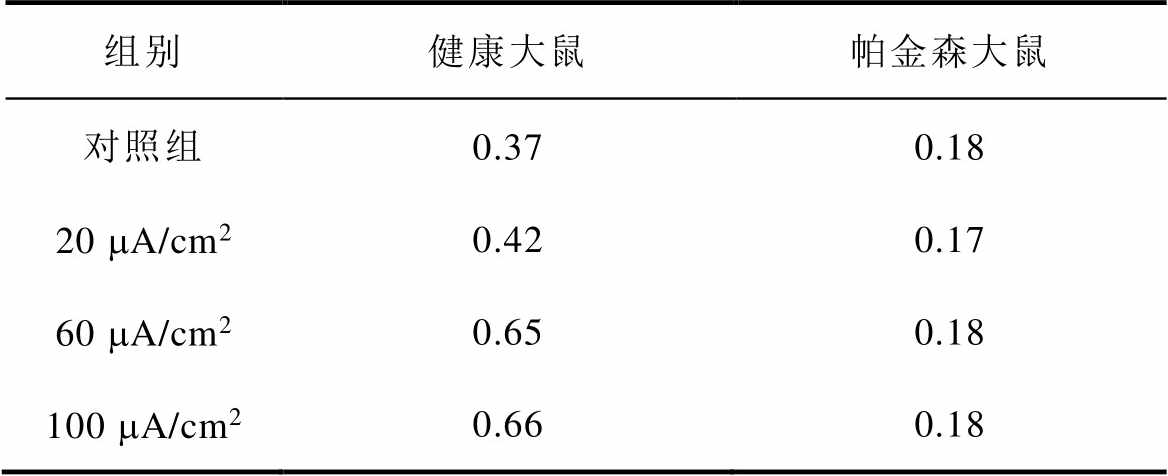
组别健康大鼠帕金森大鼠 对照组0.370.18 20 mA/cm20.420.17 60 mA/cm20.650.18 100 mA/cm20.660.18
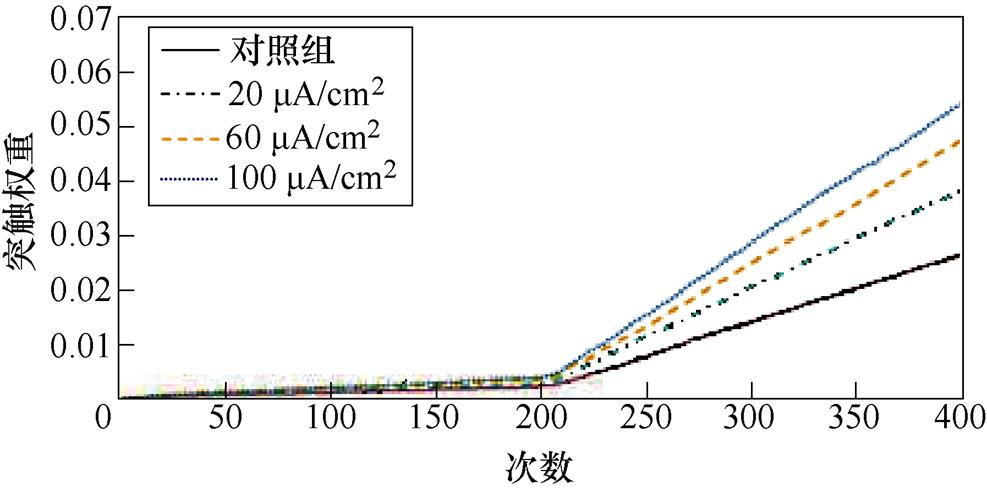
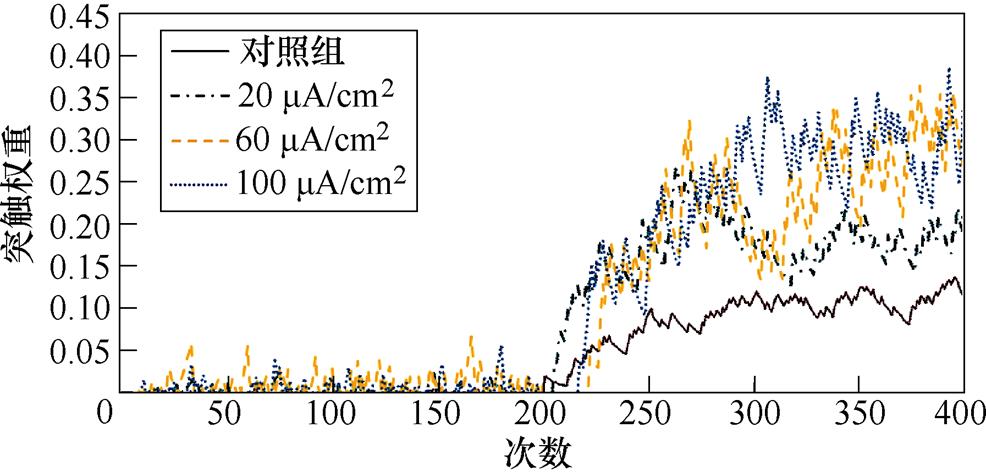
图9a、图9b分别为不同感应电流刺激下前额叶皮层与前运动皮层神经核团1、2之间突触权重变化情况。从图9a中可以看出,不加刺激时,在整个任务中,前额叶皮层与前运动皮层神经核团1之间的突触权重随着试验次数的增加从零开始线性增大,在第400次试验,其值约为0.005。施加刺激后,突触权重的增长幅度有所提高,在200次试验后,其增长速率有所下降,且感应电流越强,现象愈发明显。从图9b中可以看出,不加刺激时,前额叶皮层与前运动皮层神经核团2之间的联系强度随着试验次数的增加线性增大,在第400次试验,其值同样约为0.005。施加刺激后,突触权重的增长幅度有所提高,在200次试验后,其增长速率进一步上升。
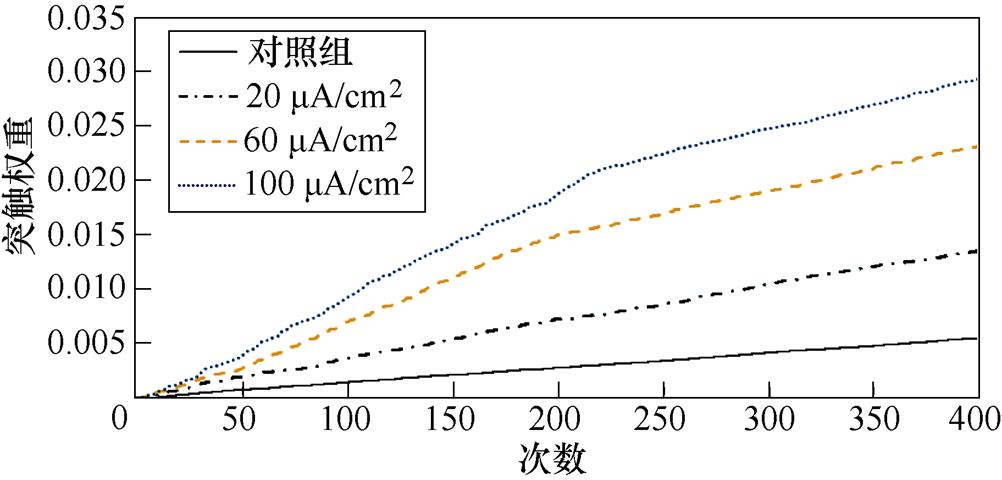
(a)PFC-PMC1
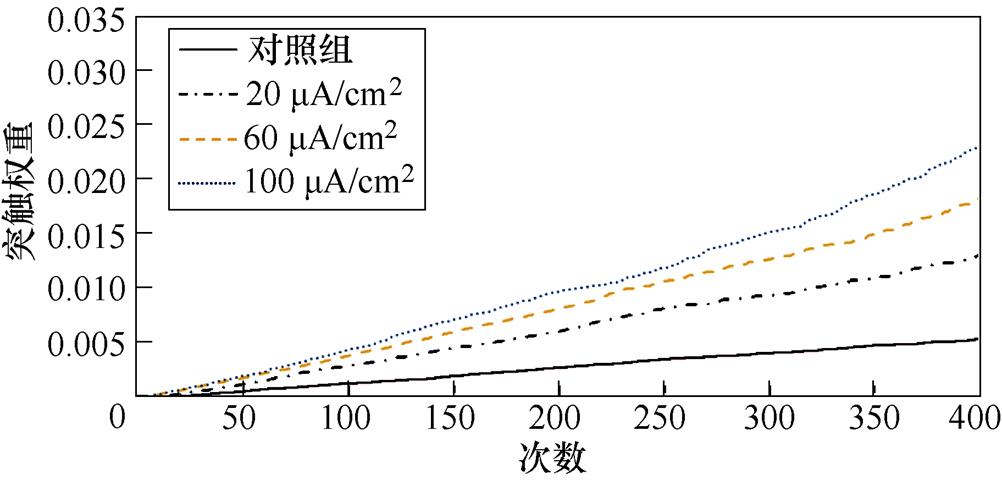
(b)PFC-PMC2
图9 帕金森大鼠PFC-PMC突触权重
Fig.9 PFC-PMC synaptic weight in Parkinson's rats
实验动物为24只SPF级雄性Wistar大鼠(6周龄),体重200~250 g,购买自北京华阜康生物科技有限公司,动物许可证号为SCXK(京)2019- 0008。
为了进一步探究经颅磁声电刺激对大鼠行为决策的影响,本研究开展了健康大鼠与帕金森模型大鼠的T迷宫行为学实验。实验分组前对Wistar大鼠进行爬杆测试,挑选出正常行为能力的大鼠进行下一步实验,试验使用直径35 mm、长度1 000 mm的光滑木杆,与地面呈60°倾斜角放置。正式测试的前三天,每只大鼠每天单独在放置爬杆装置的箱子里30 min适应环境。测试时根据大鼠在木杆上的行为表现计分:若大鼠不能抓杆直接掉下,计0分;在杆上滑行几步后掉下,计0.5分;在杆上间歇性停顿数次后趴下,仍可抓住杆,计1分;一步一步缓慢爬行并同时伴有后肢滑行,计1.5分;四肢并用顺利爬下,计2分。每只大鼠爬杆五次,最终挑选出五次试验均为2分的24只大鼠[21]。将24只大鼠随机分成4组,分别为健康组不刺激(6只)、健康组加刺激(6只)、模型组不刺激(6只)、模型组加刺激(6只)。
腹腔注射1-甲基-4-苯基-1,2,3,6-四氢吡啶(1- Methyl-4-phenyl-1,2,3,6-tetrahydropyridine, MPTP)会损害啮齿动物的记忆和运动功能,已有研究证明注射MPTP可使动物模型神经系统受损,产生帕金森病的运动和非运动症状[22]。将MPTP与生理盐水混合配制成30 g/L的溶液,以1 mL/kg进行大鼠腹腔注射,一天一次,连续注射八天。第九天再次对24只大鼠进行爬杆测试,对评分结果进行统计学分析,检验健康组与模型组大鼠的行为学差异,验证腹腔注射MPTP是否成功诱导出帕金森模型大鼠。
分别将健康组、模型组大鼠随机分出对照组(6只)与实验组(6只)。对实验组大鼠施加经颅磁声电刺激,将大鼠固定于脑立体定位仪上,剃除头皮毛发以减少超声波束在传递过程中的衰减。为使大鼠脑组织中的感应电流在20~100 mA/cm2区间内,根据式(3)使用两个直径为40 mm、厚度为10 mm的圆柱形钕铁硼永磁体固定于大鼠头部两侧提供静磁场,用高斯计测得大鼠脑部两侧的磁感应强度在水平方向为0.3 T,在竖直方向近似为零。利用任意波形发生器和射频功率放大器设置超声刺激参数为基波频率0.5 MHz,脉冲重复频率1 kHz,脉冲长度0.5 ms,脉冲持续时间400 ms。使用超声换能器和超声准直器产生并传输超声信号,调整脑立体定位仪的位置坐标与大鼠前额叶保持一致,将超声信号聚焦于前额叶皮层。对照组执行假刺激,取下脑立体定位仪两侧的永磁体去除静磁场,仅将大鼠固定在脑立体定位仪上不施加任何刺激,其余步骤与刺激组实验流程相同。
每天对大鼠进行时长为2.0 min的刺激,刺激结束,停留3~5 h后,进行大鼠T迷宫探索学习实验。T迷宫实验期间控制大鼠进食量为平时的50%。将大鼠放入T迷宫主干臂的起始位置,打开起始位置的挡板,让大鼠随机选择左右两臂之一,此时大鼠会获得其中一臂末端事先放置的食物奖励,获得奖励后引导大鼠回到起始位置,停留5 s后再次打开挡板,若大鼠第二次选择另一臂,将会再一次获得食物奖励,并记为选择正确,若选择同一臂,则没有食物奖励,记为选择错误。每只大鼠每天进行20次试验,记录行为学正确率,并进行统计学分析。T迷宫实验过程中通过在体多通道神经信号采集系统采集大鼠前额叶皮层局部场电位信号,经0.3~300 Hz低通滤波后,得到原始的16通道局部场电位数据,然后使用陷波滤波的方法去除工频干扰,最后选择第1~4 d刺激实验后(探索学习阶段)的16通道数据,计算任意两通道局部场电位信号间的互信息熵,将每组互信息值计算结果进行叠加平均,得到各组16通道信号间的互信息值。
爬杆试验测得健康组与模型组大鼠行为得分,比较两组数据可用来探究腹腔注射MPTP对大鼠行为能力的影响。表6所示为模型组大鼠MPTP注射结束后第二天,两组大鼠爬杆测试结果。实验数据按mean±SEM的形式给出,为了比较有无注射MPTP两种情况下的得分,对两组大鼠的得分数据作配对T检验。健康组大鼠的得分为1.96±0.14,模型组大鼠的得分为0.17±0.32,两组总体得分差异具有统计学意义(t=18.57,P=0.001),说明腹腔注射MPTP损害了大鼠的行为能力。
表6 健康组与模型组得分
Tab.6 Scores of healthy group and model group

组别得分差值及95%CIT检验 t值P值 健康组1.96±0.141.7918.570.001 模型组0.17±0.321.58~2.00——
将记录到的T迷宫行为正确率数据进行数据处理和统计学分析。采用单因素方差分析方法比较各组大鼠空间学习记忆的能力,每两组之间的比较使用Bonferroni校正的配对T检验分析方法,结果以mean±SEM的形式呈现,检验水准为0.05。每天记录大鼠进行T迷宫试验的行为学正确率,当正确率连续3 d超过85%时,说明大鼠此时“学会”了T迷宫的奖励规则,完成了探索学习阶段,统计每只大鼠完成探索学习阶段所用的天数并对每组数据进行方差分析。完成探索学习阶段所用天数如图10所示。由图10可知,模型组不加刺激的大鼠花费的时间显著高于健康组不加刺激的大鼠,说明腹腔注射MPTP严重影响了大鼠的空间学习记忆能力。不加刺激的健康组与施加刺激的健康组大鼠、不加刺激的模型组与施加刺激的模型组大鼠、施加刺激的健康组与施加刺激的模型组大鼠分别进行配对T检验,结果均具有统计学差异。且模型组之间的统计学差异更显著,这说明施加刺激后,大鼠的空间探索能力得到了提高,同时,帕金森模型大鼠受刺激的作用效果更显著。
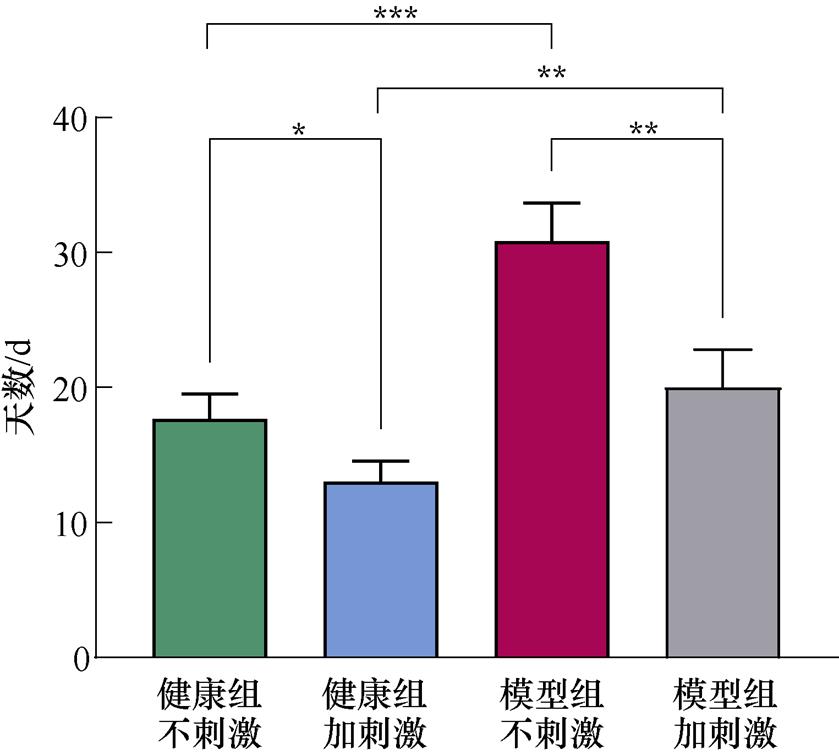
图10 完成探索学习阶段所用天数(*P<0.05, **P<0.01, ***P<0.001)
Fig.10 Number of days to complete the exploratory learning phase
图11所示为16通道局部场电位间的互信息值,其大小反映了两个通道信号间相关性的强弱以及神经核团之间的信息传递情况。横、纵坐标表示每个通道编号,每个方框表示两个通道信号间的互信息值,对角线为通道自身与自身间的互信息值,将其设置为0,颜色深浅代表互信息值的大小。颜色越接近红色,表示互信息值越大,即两通道信号之间的相关性越强;颜色越接近蓝色,则表示相关性越弱。图11中结果显示,大鼠信号间的互信息值大多在0.1~0.2,其中健康组不刺激大鼠部分互信息值在0.4~0.6,且个别通道信号间互信息值超过了0.6,而健康组加刺激大鼠有较多通道间的互信息值高于0.6,说明对正常大鼠施加刺激增强了通道之间的相关性。模型组不刺激大鼠存在少数通道的互信息值在0.2~0.4之间,而模型组加刺激大鼠较模型组不刺激大鼠有更多通道互信息值高于0.2,且个别通道信号间互信息值超过了0.4,可以看出帕金森模型大鼠通道间的相关性明显低于正常大鼠,施加刺激后模型大鼠互信息值有所增大,反映出经颅磁声电刺激能够提高帕金森模型大鼠通道间的相关性并有助于促进神经核团之间的信息传递。
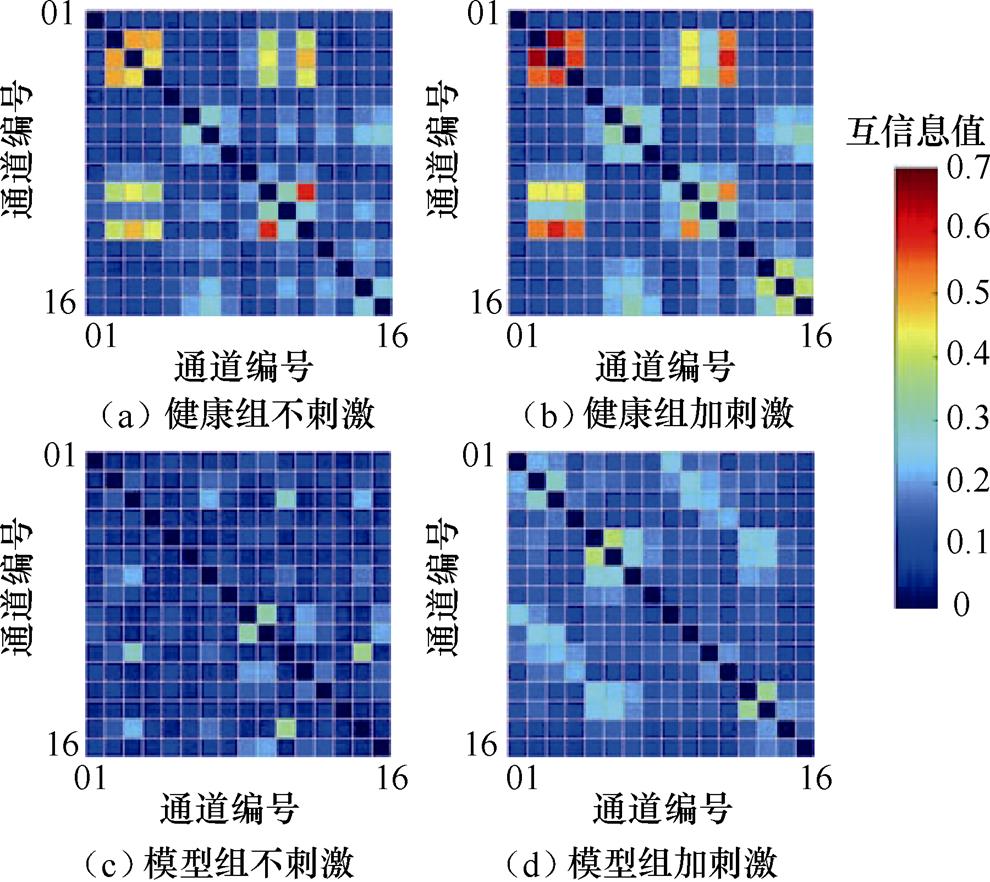
图11 局部场电位信号间互信息值
Fig.11 Mutual information value between local field potential signals
前运动皮层在行为决策过程中发挥执行选择、监测行动等作用。相关研究显示,帕金森患者中多巴胺严重损耗,降低了中脑向运动皮层投射的多巴胺,前运动皮层接受运动指令减少使运动积极性降低,致使皮层活性下降,进而引起前运动皮层神经元放电率降低[23]。有学者发现帕金森病患者前运动皮层神经元放电率明显低于健康成年人,并推测前运动皮层神经元放电率减少可能与皮质下多通路损伤有关[24]。在图2中,对健康大鼠施加刺激后,神经元放电率在0~0.8之间的情况减少,这说明施加刺激后皮层活性选择性上升或下降,由此推测大鼠在执行任务中的运动积极性有所提高。图6中,对帕金森大鼠施加刺激后,有奖行为对应的神经核团的放电率提高,而无奖行为对应的核团放电率有所减少,说明施加刺激提高了有奖行为对应的皮层神经元活性,因此,进一步推测,经颅磁声电刺激可提高大鼠执行奖赏选择任务中的行为学正确率。
纹状体在强化、逆向学习过程中发挥编码奖赏、预测错误等作用。已有研究表明,前额叶-纹状体环路与行为决策神经机制有关,具有评估行动价值的能力[25-26]。突触可塑性被认为是生物体适应性学习的基本机制,受奖励或期望相关信号影响后可引起生物不同的决策。奖励信号可以引起前额叶皮层可塑性突触产生两种状态:当动物正确决策获得奖励时,可塑性突触连接处于增强状态;当做出错误决策时,突触连接变为减弱状态[27]。前额叶皮层与纹状体之间的突触连接反映了大脑评估行动价值的能力,行动收益越大将导致突触权重值越高,在图3b、图4a中,前额叶皮层与纹状体之间的突触权重值近似为零,感应电流的变化对突触连接几乎无影响,说明此时大脑在抵制无奖行为。而大脑评估行动价值需要一个过程,因此在图3a、图4b中前额叶皮层与纹状体之间仍然存在较小的突触权重,但感应电流的变化对突触权重影响不明显。在图3中,施加刺激提高了直接通路中有奖行为对应的突触权重,而图4中,施加刺激提高了间接通路中无奖行为对应的突触权重,由此推测,经颅磁声电刺激可调节脑区间的联系强度,进而有助于大鼠根据之前的选择结果更新行动价值。直接通路活性降低、间接通路过度激活将导致基底神经节功能失衡,这与皮层-纹状体功能性连接密切相关[28-29]。有文献同样证实,帕金森病的主要原因是多巴胺丢失使直接通路和间接通路失去原有平衡,最终导致基底神经节网络的各种结构呈现异常同步放电[30]。健康情况下,直接通路与间接通路活性彼此平衡。而在帕金森患者中,多巴胺能系统释放多巴胺减少,导致D1、D2介导的两条通路受到不同的影响(直接通路兴奋性被抑制,间接通路兴奋性被增强),其严重破坏了基底神经节的功能平衡。从图7中可以看出,对帕金森大鼠施加刺激,提高了直接通路中有奖行为对应的突触权重,而图8中,施加刺激并不改变间接通路中前额叶皮层与纹状体之间的联系强度。由此推测,经颅磁声电刺激通过增加直接通路兴奋性,而保持间接通路兴奋性不变的方法来维持两条通路活性平衡,从而有助于改善基底神经节功能失衡。
根据Hebbian突触可塑性理论,在试验次数达到一定数目后,前额叶皮层与纹状体之间的突触连接强度开始下降并接近于零,同时,前额叶皮层与前运动皮层产生直接连接。有研究表明,大鼠学习能力与皮层间突触连接强度呈正相关[31]。图5中,施加刺激后,有奖行为对应突触权重的增长幅度变大,且增长速率与感应电流呈正相关,这说明施加刺激加快了皮层间联系强度的增长,进而推测,经颅磁声电刺激有助于提高大鼠的学习效率。从图9可以看出,不加刺激时,帕金森大鼠前额叶皮层与前运动皮层神经核团1、2之间的联系强度几乎相等,施加刺激后,有奖行为对应的突触权重增长的速率更大。帕金森大鼠对奖赏效应不敏感,因此两组突触连接几乎相等,而施加刺激后,其突触权重产生差异,这说明施加刺激可能提高了大鼠区分有奖行为的能力,且学习效率与感应电流强度变化趋势一致。
本研究通过建立经颅磁声电刺激皮层-基底神经节环路模型,模拟大鼠执行有奖选择任务,仿真分析感应电流强度对健康与帕金森大鼠神经元放电率和突触可塑性的影响。根据仿真结果推测,施加刺激可提高大鼠执行有奖选择任务中的运动积极性、评估行动价值的能力和探索学习的效率,且有助于平衡基底神经节的功能失衡。通过大鼠T迷宫实验发现,施加刺激后,大鼠的空间探索能力得到了提高,且帕金森模型大鼠受刺激的作用效果更显著。综上,本文的结果有助于揭示行为决策过程中各脑区协同工作机理,为进一步探索经颅磁声电刺激调控决策认知功能的作用机制奠定了基础。仿真研究中,在帕金森状态下前运动皮层神经元放电活动异常,推测这与皮层-基底神经节环路中产生的振荡有关,有待在后续的研究中展开分析;动物实验方面,有必要进一步探究刺激参数对大鼠空间探索学习能力的影响规律。
参考文献
[1] Gangopadhyay P, Chawla M, Dal Monte O, et al. Prefrontal-amygdala circuits in social decision- making[J]. Nature Neuroscience, 2021, 24(1): 5-18.
[2] 陶然, 赵冬梅, 王浩翔. 基于信息间隙决策理论的配电网韧性提升规划方法[J]. 电力系统自动化, 2022, 46(9): 32-41.
Tao Ran, Zhao Dongmei, Wang Haoxiang. Planning method for resilience enhancement of distribution network based on information gap decision theory[J]. Automation of Electric Power Systems, 2022, 46(9): 32-41.
[3] Jonathan J. How beat perception Co-opts motor neurophysiology[J]. Trends in Cognitive Sciences, 2021, 25(2): 137-150.
[4] Caiola M, Holmes M H. Model and analysis for the onset of Parkinsonian firing patterns in a simplified basal Ganglia[J]. International Journal of Neural Systems, 2019, 29(1): 1850021.
[5] 郭磊, 陈云阁, 王瑶, 等. 基于C0复杂度的磁刺激内关穴的脑功能网络构建与分析[J]. 电工技术学报, 2017, 32(12): 155-163.
Guo Lei, Chen Yunge, Wang Yao, et al. Construction and analysis of brain functional network based on C0 complexity under magnetic stimulation at acupoint of Neiguan[J]. Transactions of China Electrotechnical Society, 2017, 32(12): 155-163.
[6] 熊慧, 王玉领, 付浩, 等. 一种应用于经颅磁刺激脉冲宽度可调的节能型激励源[J]. 电工技术学报, 2020, 35(4): 679-686.
Xiong Hui, Wang Yuling, Fu Hao, et al. An energy efficient excitation source for transcranial magnetic stimulation with controllable pulse width[J]. Transa- ctions of China Electrotechnical Society, 2020, 35(4): 679-686.
[7] 尚莹春, 张涛. 重复经颅磁刺激对认知功能的作用及其分子机理的研究进展[J]. 电工技术学报, 2021, 36(4): 685-692.
Shang Yingchun, Zhang Tao. The role of repetitive transcranial magnetic stimulation on cognitive function and its underlying molecular mechanism[J]. Transactions of China Electrotechnical Society, 2021, 36(4): 685-692.
[8] 张帅, 崔琨, 史勋, 等. 经颅磁声电刺激参数对神经元放电模式的影响分析[J]. 电工技术学报, 2019, 34(18): 3741-3749.
Zhang Shuai, Cui Kun, Shi Xun, et al. Effect analysis of transcranial magneto-acousto-electrical stimulation parameters on neural firing patterns[J]. Transactions of China Electrotechnical Society, 2019, 34(18): 3741-3749.
[9] Norton S J. Can ultrasound be used to stimulate nerve tissue?[J]. Biomedical Engineering Online, 2003, 2: 6.
[10] 刘世坤, 张鑫山, 周晓青, 等. 经颅磁声耦合电刺激技术应用于小鼠的实验研究[J]. 生物医学工程研究, 2018, 37(1): 11-15.
Liu Shikun, Zhang Xinshan, Zhou Xiaoqing, et al. Experimental study in mice on the technology of transcranial magneto-acoustic coupling electrical stimulation[J]. Journal of Biomedical Engineering Research, 2018, 37(1): 11-15.
[11] Zhang Yanqiu, Zhang Mohan, Ling Zichao, et al. The influence of transcranial magnetoacoustic stimulation parameters on the basal Ganglia-thalamus neural network in Parkinson’s disease[J]. Frontiers in Neuroscience, 2021, 15: 761720.
[12] 张帅, 许家悦, 李梦迪, 等. 基于皮层神经元模型的经颅磁声电刺激神经网络放电活动仿真分析[J]. 电工技术学报, 2021, 36(18): 3851-3859.
Zhang Shuai, Xu Jiayue, Li Mengdi, et al. Simulation of the discharge activity of neural network under transcranial magneto-acousto-electrical stimulation based on cortical neuron model[J]. Transactions of China Electrotechnical Society, 2021, 36(18): 3851- 3859.
[13] Valsky D, Heiman Grosberg S, Israel Z, et al. What is the true discharge rate and pattern of the striatal projection neurons in Parkinson’s disease and dystonia?[J]. eLife, 2020, 9: e57445.
[14] 王芳, 沈文超, 胡笑楠, 等. 皮质-基底神经节-丘脑- 皮质环路与抑郁症状调节的机制探讨[J]. 临床精神医学杂志, 2021, 31(4): 326-329.
Wang Fang, Shen Wenchao, Hu Xiaonan, et al. Discussion on the mechanism of cortical-striatum- thalamus-cortical circuit and symptom regulation of depression[J]. Journal of Clinical Psychiatry, 2021, 31(4): 326-329.
[15] Rubin J E, Vich C, Clapp M, et al. The credit assignment problem in cortico-basal Ganglia-thalamic networks: a review, a problem and a possible solution[J]. The European Journal of Neuroscience, 2021, 53(7): 2234-2253.
[16] Khawaldeh S, Tinkhauser G, Shah S A, et al. Subthalamic nucleus activity dynamics and limb movement prediction in Parkinson’s disease[J]. Brain, 2020, 143(2): 582-596.
[17] Shriki O, Hansel D, Sompolinsky H. Rate models for conductance-based cortical neuronal networks[J]. Neural Computation, 2003, 15(8): 1809-1841.
[18] Mulcahy G, Atwood B, Kuznetsov A. Basal Ganglia role in learning rewarded actions and executing previously learned choices: healthy and diseased states[J]. PLoS One, 2020, 15(2): e0228081.
[19] Lerner T N, Holloway A L, Seiler J L. Dopamine, updated: reward prediction error and beyond[J]. Current Opinion in Neurobiology, 2021, 67: 123- 130.
[20] Martje G. Subthalamic nucleus conditioning reduces premotor-motor interaction in Parkinson’s disease[J]. Parkinsonism & Related Disorders, 2022, 96: 6-12.
[21] 曾朝蓉, 岳冬, 孙伟, 等. 亚硒酸钠对帕金森模型大鼠运动功能及脑黑质抗氧化能力的影响[J]. 中华行为医学与脑科学杂志, 2020, 29(5): 413-418.
Zeng Chaorong, Yue Dong, Sun Wei, et al. Effects of sodium selenite on motor function and antioxidant capacity of substantia nigra in rats with Parkinson’s disease[J]. Chinese Journal of Behavioral Medicine and Brain Science, 2020, 29(5): 413-418.
[22] Narmashiri A, Abbaszadeh M, Ghazizadeh A.The effects of 1-methyl-4-phenyl-1, 2, 3, 6-tetrahydropyridine (MPTP) on the cognitive and motor functions in rodents: A systematic review and meta-analysis[J]. Neuroscience & Biobehavioral Reviews, 2022, 140: 104792.
[23] Palmisano C, Brandt G, Vissani M, et al. Gait initiation in Parkinson’s disease: impact of dopamine depletion and initial stance condition[J]. Frontiers in Bioengineering and Biotechnology, 2020, 8: 137.
[24] Pelicioni P, Lord S, Okubo Y, et al. People with Parkinson’s disease exhibit reduced cognitive and motor cortical activity when undertaking complex stepping tasks requiring inhibitory control[J]. Neurorehabilitation and Neural Repair, 2020, 34(12): 1088-1098.
[25] Vich C. Corticostriatal synaptic weight evolution in a two-alternative forced choice task: a computational study[J]. Communications in Nonlinear Science and Numerical Simulation, 2020, 82: 105048.
[26] Tseng P, Chang C, Chiau H Y, et al. The dorsal attentional system in oculomotor learning of predi- ctive information[J]. Frontiers in Human Neurosci- ence, 2013, 7: 404.
[27] 郭磊, 刘东钊, 黄凤荣, 等. 基于突触可塑性的自适应脉冲神经网络在高斯白噪声刺激下的抗扰功能研究[J]. 电工技术学报, 2020, 35(2): 225-235.
Guo Lei, Liu Dongzhao, Huang Fengrong, et al. Research on disturbance rejection of adaptive spiking neural network based on synaptic plasticity under white Gaussian noise[J]. Transactions of China Electrotechnical Society, 2020, 35(2): 225-235.
[28] 时凯旋, 刘晓莉, 乔德才. 皮层-基底神经节环路功能性连接与PD运动防治的神经可塑性机制研究进展[J]. 生理科学进展, 2019, 50(1): 25-29.
Shi Kaixuan, Liu Xiaoli, Qiao Decai. Exercise- induced neuroplasticity targeting cortico-basal gang- lionic functional circuits in Parkinson’s disease[J]. Progress in Physiological Sciences, 2019, 50(1): 25-29.
[29] Grafton S T, Volz L J. From ideas to action: the prefrontal-premotor connections that shape motor behavior[J]. Handbook of Clinical Neurology, 2019, 163: 237-255.
[30] Calabresi P, Picconi B, Tozzi A, et al. Direct and indirect pathways of basal Ganglia: a critical reappraisal[J]. Nature Neuroscience, 2014, 17(8): 1022-1030.
[31] Kim T, Hamade K C, Todorov D, et al. Reward based motor adaptation mediated by basal Ganglia[J]. Frontiers in Computational Neuroscience, 2017, 11: 19.
Abstract Transcranial magneto-acousto-electrical stimulation (TMAES) is a novel noninvasive neuromodulation technique that can modulate electrical activity in different brain regions. Brain regions in the cortex and basal ganglia interact with each other and play a key role in behavioral selection and reinforcement learning. Based on the cortical-basal ganglia circuit model, this study explored the effect of TMAES on the behavioral decision-making ability of rats and further discussed the effect of stimulation on neural information transmission and spatial exploration ability of rats through animal experiments.
TMAES uses the coupling effect of magnetic field and ultrasound to generate induced current in nerve tissue, which affects the neural activity of the cortex-basal ganglia circuit. The discharge rate of premotor cortex (PMC) neurons is related to exercise enthusiasm. The synaptic connection between the prefrontal cortex (PFC) and striatum (STR) is involved in evaluating brain action value. The synaptic connection between PFC and PMC is closely related to learning and memory. This paper aims to investigate the regulatory mechanism of TMAES on the cortical-basal ganglia-cortical neural network in healthy and Parkinsonian states. Based on the cortical-basal ganglia-cortical circuit model, this paper simulated the neural activity of different brain regions in a reward selection task. The effects of different induced current strengths on the firing rate of neurons and the synaptic weight between nuclei were also analyzed.
The simulation results showed that when TMAES was applied to healthy rats, the discharge rate of PMC nuclei corresponding to rewarding and non-rewarding behaviors increased and decreased, respectively. When the induced current was 100 mA/cm2, the number of rewarding behaviors in 1~200 trials increased from 177 to 195 and increased from 167 to 187 in 200~400 trials. At the same time, stimulation increased the synaptic weight and was positively correlated with the induced current. The discharge rate of the PMC nucleus and the prominent weight in Parkinson's rats were significantly lower than those in healthy rats. After stimulation, the discharge rate corresponding to reward behavior increased, and corresponding to non-reward behavior decreased. Stimulation increased the prominent weight between PFC and STR corresponding to rewarding behavior in the direct pathway. It increased with the increase of induced current, but did not change the prominent weight between PFC and STR in the indirect pathway. In this study, the rat T maze experiment was carried out, and the local field potential signal of rat PFC was obtained in the vivo multi-channel neural signal acquisition system. One-way ANOVA analysis of the number of days spent in the exploratory learning stage of rats showed that the spatial exploration ability of rats was improved after stimulation. Correlation analysis of 16-channel local field potential signals showed that TMAES could improve the correlation between rat channels and help promote information transmission between neural nuclei. The results showed that TMAES could improve rats’ exercise enthusiasm and learning efficiency and help improve the functional imbalance of basal ganglia in Parkinson's rats.
keywords:Transcranial magneto-acousto-electrical stimulation, cortical neurons, basal ganglion, decision- making, synaptic weights
中图分类号:TM12; R318
DOI: 10.19595/j.cnki.1000-6753.tces.221807
国家自然科学基金(51877069、52107236)和河北省科技计划等(E2021202184、236Z7711G、QN2021043)资助项目。
收稿日期 2022-09-21
改稿日期 2022-12-26
张 帅 男,1978年生,博士生导师,主要从事生物电磁技术研究。E-mail: zs@hebut.edu.cn(通信作者)
由胜男 女,1996年生,硕士研究生,主要从事生物电磁技术研究。E-mail: 1601001467@qq.com
(编辑 郭丽军)