Tab.1 PDA solid medium formulation

成分用量/(g/L) 马铃薯5 葡萄糖20 琼脂15 氯霉素0.1
摘要 近年来,随着电缆批量退役,有机固体废物大量堆积,严重威胁环境清洁和人类生命健康。微生物降解废旧电缆比传统的焚烧填埋更为清洁、经济,因此可以采用菌群降解手段实现废旧电缆环保处理。为了研究微生物降解废弃聚乙烯(PE)组分的过程,该文选取黑曲霉菌对聚乙烯粉末进行降解处理,利用傅里叶红外光谱(FTIR)和X射线光电子能谱(XPS)进行官能团分析及样品表面碳、氧元素的含量分析,使用X射线衍射实验(XRD)进行样品的晶体结构分析,采用差示扫描量热-热重分析(DSC-TGA)联用热分析方法开展样品的变温热性能分析,同时基于扫描电子显微镜(SEM)进行10 000~50 000倍下样品的微观形貌观测。实验结果表明,在黑曲霉菌降解低密度聚乙烯的过程中发生了氧化反应,产生了羟基、羰基等亲水基团,在菌群处理聚乙烯天数为14天时,氧元素含量从1.38%增加至13.60%,同时聚乙烯结晶度从53.4%下降到34.18%,起始热解温度降低200℃,最终热解温度降低10℃,熔融峰降低0.87 mW/mg,表面形貌出现明显的孔隙和沟壑。该文解析了黑曲霉菌降解低密度聚乙烯的化学机制为醇化、羰基化以及酶促氧化反应。
关键词:废旧电缆 微生物 聚乙烯 生物降解
高压电缆的使用寿命一般在20年左右,随着特高压直流输电技术的迅速发展,以及线路运行年限的延长,大量电缆劣化退出运行[1]。电缆退役后,产生大量有机固体废弃物闲置堆积,埋入湿润土壤的聚乙烯(Polyethylene, PE)在12~32年中发生的质量损失可以忽略不计,在自然条件下降解缓慢。我国废弃电缆中的金属材料回收率可达到95%,而经粉碎重塑和改性再生回收的非金属电缆废料不足3%[2]。据统计,我国每年产生的电缆废料可达1 000万t,这不仅给环境带来了严重危害,同时也造成了资源的浪费。目前,国家已明令禁止采用焚烧方式处理电缆固体废料,但还没有行之有效的方法解决废旧电缆堆积的问题[3]。因此,亟须一种无害化降解方法,解决废旧电缆的环保处理难题。
电力电缆主要的绝缘基料为低密度聚乙烯(Low Density Polyethylene, LDPE)[4]。LDPE具有耐低温、耐腐蚀、电绝缘性能良好、柔韧性好等特点,化学性能稳定,因此废弃后处理具有极高的技术难度[5-6]。传统的物理破碎法只能将聚乙烯废料研磨至mm或μm量级,不能改变其化学结构,无法从根本上解决废料问题[7]。在包装行业领域,目前广泛采用微生物降解塑料薄膜制品,而塑料薄膜与聚乙烯的化学结构类似,因此,有望通过微生物降解的方法解决废旧电缆的环保处理这一难题。
生物降解聚乙烯首先由国外研究人员提出,并通过实验验证了其可行性。2010年,印度研究人员在垃圾场分离得到两株细菌,分别为关节杆菌和假单胞菌,两株细菌与高密度聚乙烯(High Density Polyethylene, HDPE)作用30天后,样品均有不同程度的质量损失[8]。2013年,研究人员在海水中分离了中上层水域的60多种细菌,并发现一种潜在的菌株B. subtilis H1584,将该细菌与LDPE在液体环境培养14天后,细胞表面的亲水性增强且细胞活力上升,说明了该细菌具备高效的降解能力[9]。在此基础上,P. Tribedi在倾倒固体废物的土壤中分离出AKS2假单胞菌,该菌可以高效降解LDPE,能在45天内降解5%±1%的原始废弃物材料[10]。
我国生物降解聚乙烯相关研究开展较晚,但是随着环境保护工作的开展,绿色降解方面研究发展较快。2016年,四川师范大学冯静[11]发现白浅灰链霉菌对聚乙烯具有高效的降解能力,经过其处理聚乙烯薄膜后,在电镜下可观测到薄膜结构化的损伤。2020年,北京化工大学李忠宇等[12]在富含木质素的纸浆厂废水中分离出了一种海洋细菌IRE-31,将此细菌与LDPE共混培养30天后,通过傅里叶红外光谱仪(Fourier Transform Infrared spectroscopy, FTIR)监测到羟基和羰基等亲水基团的形成,并通过电镜观测到颗粒结构破碎现象,表明该细菌对聚乙烯具有一定破坏能力。
目前评判聚乙烯降解程度的主要方法是通过试验解析其化学结构变化。2023年,山西农业大学的李玮等[13]用聚乙烯喂养大麦虫,使用FTIR分析其粪便中的成分,检测到了C—O—C基团和羰基官能团(—C=O)。2023年,西北民族大学吴慧[14]使用细菌TW-2处理聚乙烯薄膜,通过X射线光电子能谱(X-ray Photoelectron Spectroscopy, XPS)发现薄膜表面出现含氧官能团,并推测微生物分泌了细胞外氧化酶。2021年,埃及研究人员使用碳曲霉和熏蒸曲霉协同降解低密度聚乙烯,使用X射线衍射实验(X-Ray Diffraction, XRD)发现降解后的聚乙烯晶体尺寸减小,结晶度降低[15]。2022年,印度研究人员使用包括两种马里诺杆菌属(H-244和H-246)和一种枯草芽孢杆菌(H-248)在内的三种海洋细菌降解LDPE薄膜,通过热重分析(Thermogravimetric Analysis, TGA)发现薄膜热稳定性降低,并推测是细菌分泌的酶所导致[16]。2023年,印度研究人员使用短芽孢杆菌处理聚乙烯,通过差示扫描量热仪(Differential Scanning Calorimetry, DSC)发现样品的熔点降低,表明聚合物链尺寸减小[17]。
微生物降解聚乙烯的机理是酶促理论。菌群降解聚乙烯的过程是蛋白酶的活性位点与底物结合,通过外源性生物酶催化作用降低反应所需活化能,形成各阶段过渡态及最终产物的过程。微生物降解聚乙烯的关键环节体现在其分泌酶的可用性、聚乙烯中存在酶可作用的靶位以及辅酶的存在[18]。漆酶能够参与聚乙烯的降解并且会在长链的末端引入羟基,提高基团亲和力从而易于被微生物降解[19];烷烃羟化酶AlkB对聚乙烯的作用部位为末端和亚末端[20];此外细胞色素P450酶还可以作用在链内[21]。2022年,西北农林科技大学Hou Lijun等[22]在污水处理厂中分离得到假单胞菌菌株,通过全基因组测序证明了假单胞菌菌株侵蚀聚乙烯后,分泌出单加氧酶、双加氧酶和羟化酶等塑料降解酶,为进一步研究微生物降解聚乙烯的机制提供了理论指导。
然而,目前关于微生物降解聚乙烯的研究缺乏完整的微观参量表征体系[23],也没有提出完整的LDPE微生物降解全反应路径,尚未能阐释微生物降解LDPE的微观机理。
综上所述,本文选取真菌菌株对电缆料低密度聚乙烯进行降解反应,用FTIR检测官能团变化,通过XPS分析碳元素和氧元素含量的变化,采用XRD方法计算样品相对结晶度,构建DSC-TGA联用的变温热分析方法描述聚乙烯的热性能,用扫描电子显微镜(Scanning Electron Microscope, SEM)观察样品的微观形貌,并通过上述微观手段表征菌类对聚乙烯的降解能力,根据实验结果推测了降解过程中的主要化学反应式,解析了降解反应机理。
本文选用上海亿塑诚电子有限公司生产的低密度聚乙烯粉末(7042)作为基料,选用山东和众康源生物科技有限公司生产的黑曲霉菌(Aspergillus niger)ACCC30312作为降解微生物。首先制备马铃薯葡萄糖琼脂(Potato Dextrose Agar, PDA)固体培养基,为黑曲霉菌提供所需的碳源、氮源等。依据表1所示的配方称取40.1 g PDA粉末与1 000 mL去离子水混合,使用力辰科技HJ-4A数显磁力恒温搅拌器,设定转速为1 000 r/min,温度为100℃,待粉末溶解后,观察到溶液呈透明状态。溶液冷却至50℃后,用透气封口膜封装瓶口,转移至北京永光明医疗仪器DGL-50GI立体蒸汽灭菌器,在121℃条件下持续杀菌15 min。杀菌后的溶液冷却至50℃时,在HVS-1000洁净工作台中使用移液器将杀菌后的PDA溶液转移至直径为90 mm、厚度为16 mm的圆形培养皿中,PDA培养基的厚度为4.8 mm。静置24 h后,观察培养基表面无杂菌污染,用接种环接种黑曲霉菌孢子。孢子为直径为2 μm的均匀球体,接种密度为1.5×104个/cm2,此操作在通垂直风的洁净操作台中进行,避免杂菌的干扰和污染。接种完毕后,将预备的经100目钢筛过滤的聚乙烯粉末均匀撒在培养皿上,单层聚乙烯粉末的厚度为1.5 mm,形成培养基-黑曲霉菌-聚乙烯粉末基本组合结构。
表1 PDA固体培养基配方
Tab.1 PDA solid medium formulation

成分用量/(g/L) 马铃薯5 葡萄糖20 琼脂15 氯霉素0.1
注:使用氢氧化钠调节培养基pH值为6.8左右。
在此基础上,本文设计了三种混合形式进行黑曲霉菌生长效果宏观现象观察,以选择最优样品配置方法。样品A纵切面如图1a所示,在基本混合形貌的上表面再增加一层黑曲霉菌和聚乙烯粉末;样品B纵切面如图1b所示,遮挡住已接种黑曲霉菌的培养皿的右侧,在另一半均匀撒上聚乙烯粉末;样品C纵切面如图1c所示,在基本混合形貌的上表面左侧增加一层黑曲霉菌。同时,单独制备过滤后的聚乙烯粉末为对照组。将样品放在温度为30℃、相对湿度为80%的恒温恒湿箱培养2 h,待黑曲霉菌适应环境后,开始计时,观察样品现象。
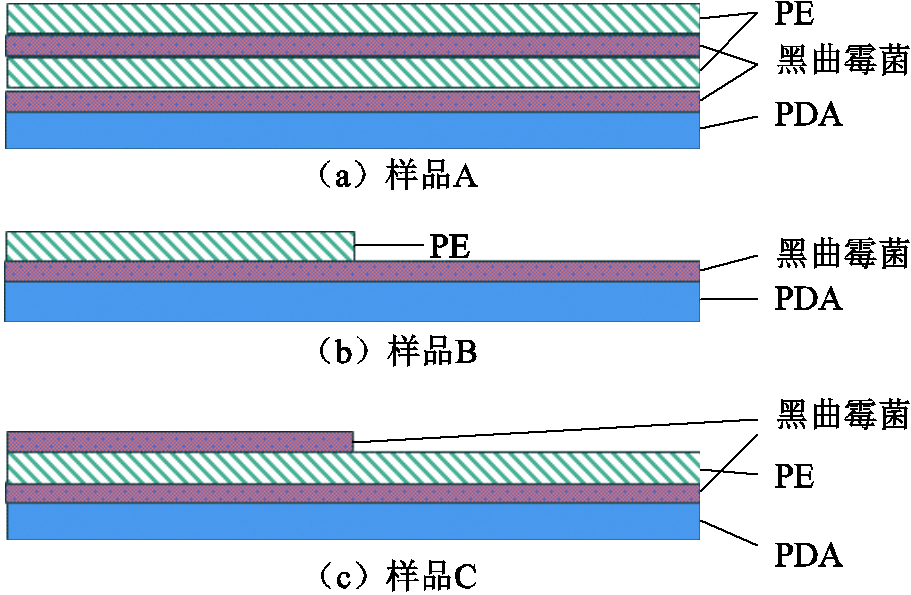
图1 黑曲霉菌与聚乙烯混合形貌类型
Fig.1 Aspergillus niger mixed morphology type with polyethylene
培育两天后,由于聚乙烯覆盖在霉菌上方,样品A并未发现明显的孢子萌发和菌丝生长现象,PE侵蚀缓慢,证明充足的空气是孢子萌发的必要条件;样品B的黑曲霉菌形成连续的成熟菌落,聚乙烯表面出现明显的菌丝寄生和侵蚀现象,如图2所示;样品C的两层黑曲霉菌孢子均未同时满足接触培养基和空气的条件,因此该样品中的聚乙烯侵蚀效果也比较微弱。综上所述,样品A、样品C中黑曲霉菌侵蚀聚乙烯速度缓慢,需长时间培育才可达到降解效果,因此本文选择图1b所示结构进行实验。
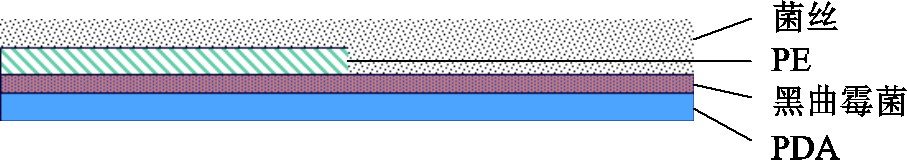
图2 样品B菌丝侵蚀示意图
Fig.2 Schematic diagram of morphology B hyphae erosion
降解反应过程中,跟踪观测LDPE成分及其微观形貌的变化,探究降解过程反应机理。实验手段包括傅里叶红外分析(FTIR)、X射线光电子能谱(XPS)、X射线衍射实验(XRD)、热重分析(TGA)、差示扫描量热扫描(DSC)、扫描电子显微镜(SEM)等,监测周期为24 h。
FTIR能够根据吸收波长鉴定分子中的官能团。收集不同降解时间的聚乙烯粉末,取2 mg聚乙烯样品与16 mg干燥溴化钾颗粒于玛瑙研钵中充分研磨后转移至不锈钢模具中,用压片机在10 MPa的压力下压制40 s。采用德国Bruker公司生产的TENSOR Ⅱ仪器对样品在500~4 000 cm-1波数范围内进行扫描,测量LDPE试样的FTIR光谱。
XPS能够分析样品表面的元素组成、元素化合态等,对表征降解效果具有重要作用。将聚乙烯粉末放入贴好导电胶的锡箔纸中,用压片机进行制样。将压制后的样品用导电胶粘贴在样品盘内,校验高度后置入仪器样品槽内开始测试。对样品中的C1s、O1s元素进行扫描分析,以C1s=284.8 eV为标准进行电荷校正。
XRD可以分析样品的晶体结构,进而获得相对结晶度计算值。实验采用德国布鲁克AXS有限公司生产的X射线衍射仪进行。使用载玻片将干燥后的样品压平放入仪器的样品台,在管电压为40 kV、管电流为40 mA的条件下,对样品进行3°<2θ<50°范围的扫描。
TGA可以分析样品成分的变化。将坩埚质量调零,称取4~8 mg样品,使用美国PerkinElmer公司研发的TGA 4000热重分析仪,在氮气的氛围下测试样品的热重曲线,测试温度范围为30~600℃,升温速率为10℃/min。
采用德国NETZSCH公司生产的差示扫描量热仪测试聚乙烯的熔融曲线。取10~20 mg样品放入坩埚内,用压片机将坩埚盖压紧后放入仪器中,在50~150℃下对样品进行测试,用氮气作为保护气。
使用SEM观测样品表面形态。将长为2 cm的导电胶贴在样品盘上,用棉签蘸取少量样品涂抹到导电胶表面,用洗耳球吹去多余样品。因样品导电性较差,需经过喷金、抽真空后进行观察。
聚乙烯材料的主要特征吸收峰见表2。通过基团吸收峰的波数、峰强和面积等参数表征材料的微观结构[24]。经黑曲霉菌处理两周,样品的FTIR曲线如图3所示,其特征峰包括饱和C—H伸缩振动(2 960~2 853 cm-1)、—CH3反对称变形振动及—CH2变形振动(1 468 cm-1)以及(—CH2—)n的面内摇摆振动(720 cm-1)。
表2 聚乙烯主要特征峰
Tab.2 Polyethylene main characteristic peak
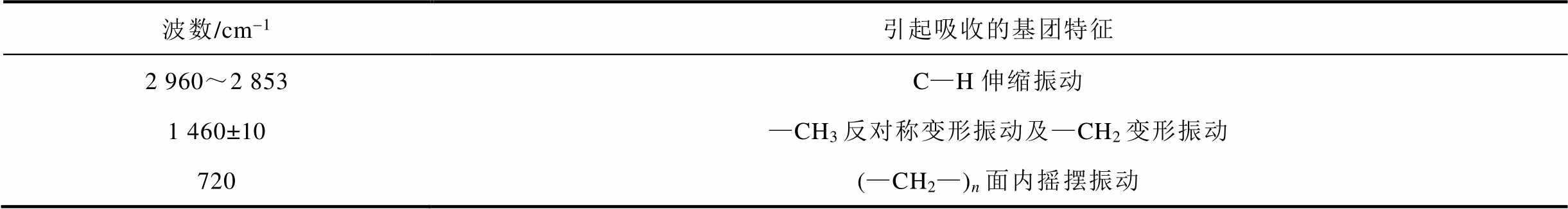
波数/cm-1引起吸收的基团特征 2 960~2 853C—H伸缩振动 1 460±10—CH3反对称变形振动及—CH2变形振动 720(—CH2—)n面内摇摆振动
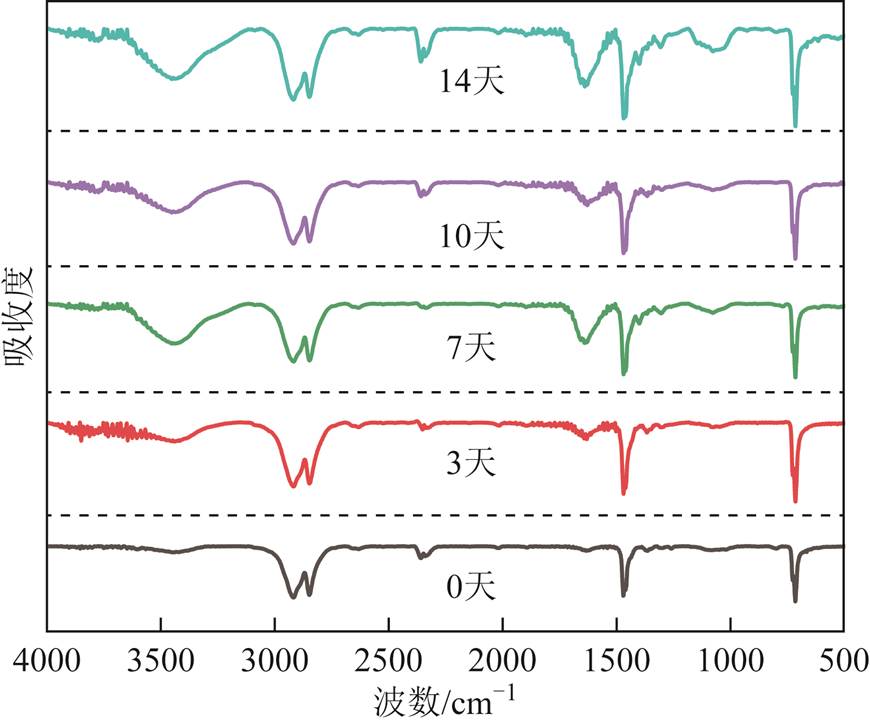
图3 LDPE经黑曲霉处理不同时间的红外吸收谱
Fig.3 Infrared absorption spectra treated with Aspergillus niger at different times
降解期间聚乙烯特征官能团变化如图4所示。由图4a可知,样品中羟基的伸缩运动主要集中在3 450 cm-1左右,随着黑曲霉菌作用时间的增加,该吸收峰逐渐增强;如图4b所示,随着处理时间的增加,红外曲线中C—H伸缩振动对应的峰强降低;如图4c所示,在1 641 cm-1处的吸收峰呈递增趋势,表明羰基(—C=O)的伸缩振动逐渐增强;在1 083 cm-1处的特征峰代表醚类基团(C—O—C)的对称伸缩振动随时间增强。
微生物降解聚乙烯主要为酶促反应,当微生物侵蚀聚乙烯表面时,微生物会分泌细胞外酶与聚乙烯结合[25],主要包括醇脱氢酶、单加氧酶、酯酶、醛脱氢酶等。在醇脱氢酶的作用下,与碳链相连的羟基会变为羰基(—C=O);在单加氧酶的作用下,碳链中的C—C键中会引入两个C—O键形成醚类基团(C—O—C);在酯酶和醛脱氢酶的作用下可以形成脂肪酸,脂肪酸可以透过细胞膜进入细胞内参与新陈代谢和氧化还原反应[26]。
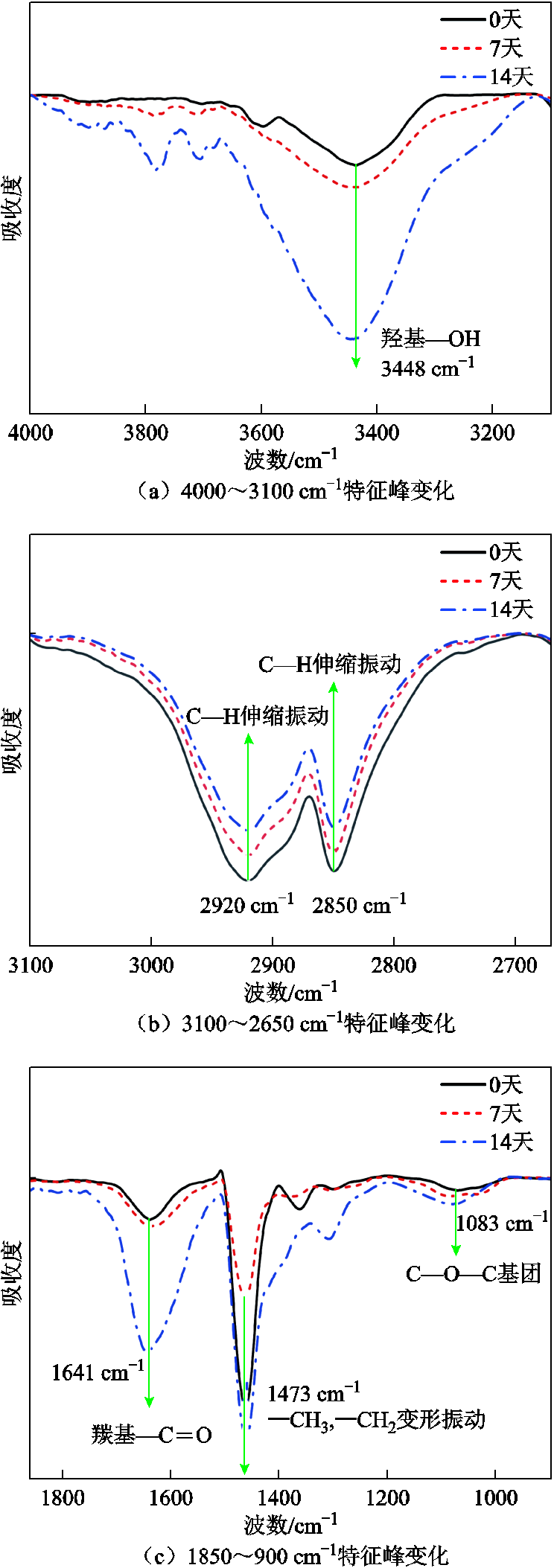
图4 降解期间官能团变化
Fig.4 Degradation of functional group changes in 14 days
实验结果证明降解过程中出现了新的物质,根据峰变化的强弱,可以推测聚乙烯在黑曲霉菌的作用下引入了羟基,又在酶的进一步作用下形成了羰基(—C=O),接着在单加氧酶的作用下出现醚类基团(C—O—C)[27]。峰值信号强度的变化表明羟基和羰基的形成是降解过程中的关键环节。
为了进一步研究黑曲霉菌对样品表面元素的影响,对样品进行XPS测试,结果如图5所示。其中,图5a、图5d和图5g分别为对照组聚乙烯(即处理0天)的XPS全谱、C1s的分峰拟合曲线及O1s拟合曲线;图5b、图5e和图5h分别为处理7天样品的XPS全谱、C1s分峰拟合曲线及O1s拟合曲线;图5c、图5f和图5i分别为处理14天样品的XPS全谱、C1s分峰拟合曲线及O1s拟合曲线。
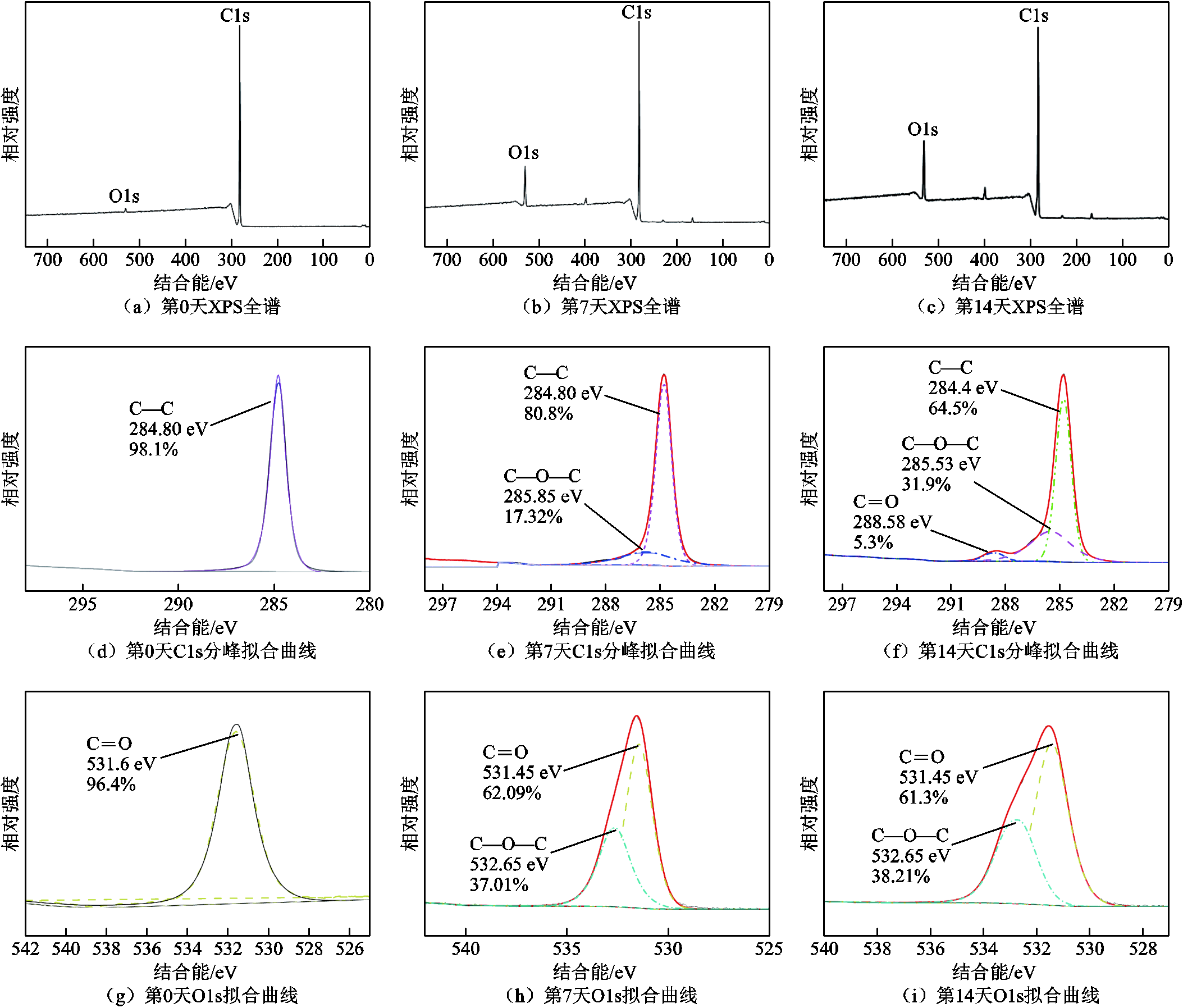
图5 X射线光电子能谱测试结果
Fig.5 X-ray photoelectron spectroscopy test results
根据XPS全谱分析,C、O元素主要符合以下规律:对照组样品几乎均为C元素,O1s峰只存在微弱信号,这是由于样品的自氧化所致;随着黑曲霉菌处理时间的增加,O1s峰值逐渐递增,说明样品表面O元素增多。不同处理时长样品表面元素原子比见表3。
XPS全谱只能定性分析样品表面的元素种类,为区分样品元素化合态差异,对C1s进行分峰拟合。图5d中C1s分峰拟合曲线的特征峰代表C—C键(284.80 eV);图5e中C1s分峰拟合曲线284.8 eV处为C—C键,285.85 eV处为C—O—C基团;在图5h和图5i的O1s拟合曲线中,532.65 eV处为C—O—C基团;图5f中,288.58 eV特征峰代表C=O化学键。与对照组相比,C—C拟合峰面积随作用时间呈递减趋势,基团C—O—C拟合峰面积呈递增趋势,表明黑曲霉菌攻击了聚乙烯样品原有的C—C键,与FTIR分析中出现新的含氧官能团结论相一致。
表3 样品表面元素原子比
Tab.3 Atomic ratio of sample surface elements
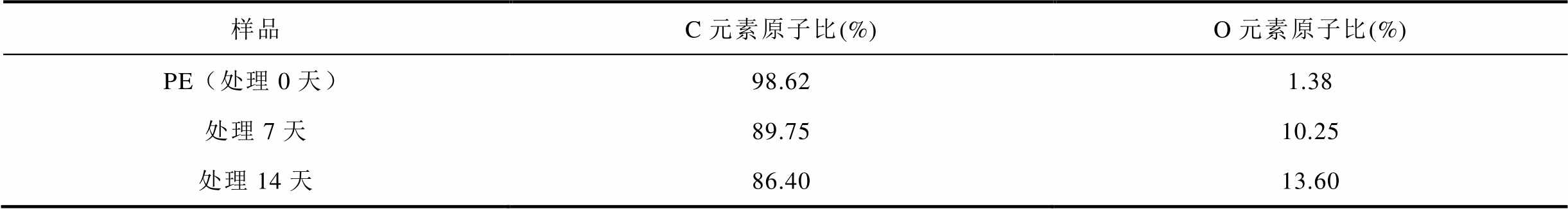
样品C元素原子比(%)O元素原子比(%) PE(处理0天)98.621.38 处理7天89.7510.25 处理14天86.4013.60
从XPS和FTIR得到的光谱中可以看到,黑曲霉菌处理聚乙烯电缆料后,样品有新的化学键和新结构的出现,表明在黑曲霉菌的作用下,聚乙烯的结构发生了改变。样品出现新的官能团,说明黑曲霉菌可以攻击样品的分子链,破坏聚乙烯分子链或可水解键,再通过进一步的氧化生成羟基、羰基等基团。
经黑曲霉菌处理的聚乙烯样品XRD曲线如图6所示。2θ=21.4°和2θ=23.8°为样品的两个主要晶峰,分别为(110)和(220)晶格面的特征[28-29]。在2θ为30.1°以及35°~45°之间存在多个微弱峰,其中,在36.2°处的峰对应(020)晶格面的特征[30]。经黑曲霉菌处理过的样品结晶点波峰强度则随着时间的延长呈现下降的趋势。
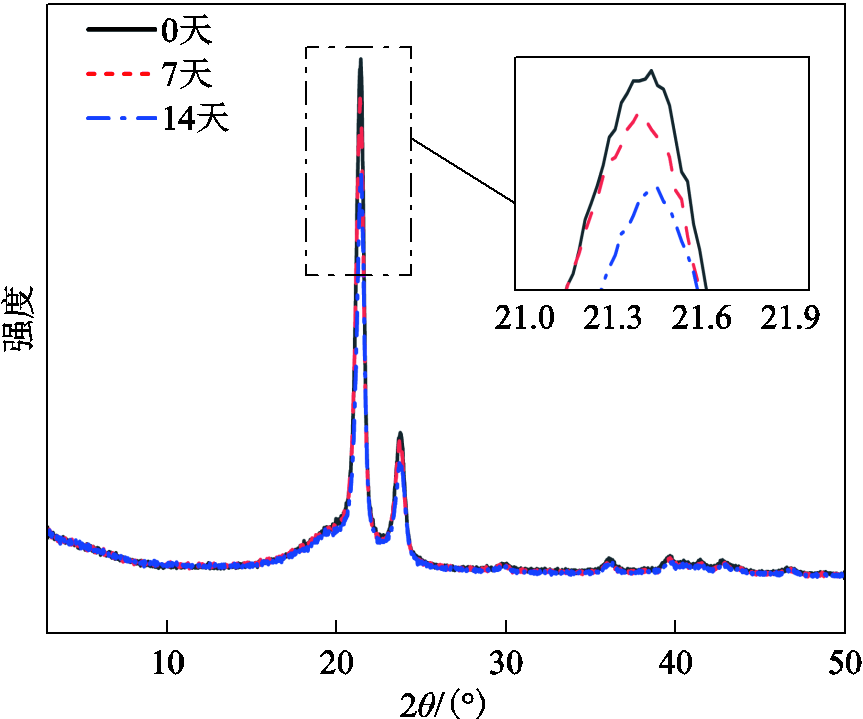
图6 黑曲霉菌处理后的聚乙烯XRD曲线
Fig.6 XRD curves of PE after Aspergillus niger treatment
在管电压为40 kV、管电流为40 mA条件下进行测试,利用式(1)计算样品的相对结晶度XC,R。
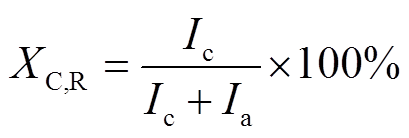 (1)
(1)
式中,Ic为晶体部分的衍射积分强度;Ia为非晶部分的衍射积分强度。计算可得聚乙烯经黑曲霉菌处理7天和14天后,相对结晶度从53.4%分别下降到47.03%和34.18%。由此可见,黑曲霉菌可以改变聚乙烯分子的排列结构,从而造成结晶度的下降。
对照组聚乙烯的热重(Thermogravimetric, TG)曲线和热重微分(Derivative Thermogravimetric, DTG)曲线如图7所示。当温度小于390℃时,样品的质量几乎保持不变,在DTG曲线中表现为曲线的起始阶段为水平线;当温度达到390℃后,DTG曲线上升,样品开始出现热分解,且热分解速率近似于线性增加;温度至481.8℃时,分解速率达到最大,在DTG曲线中体现为曲线的极值点,此时样品质量百分比接近于0;随着温度进一步的升高,热分解速率急速下降,在499.4℃时降为零,样品已全部被热分解。
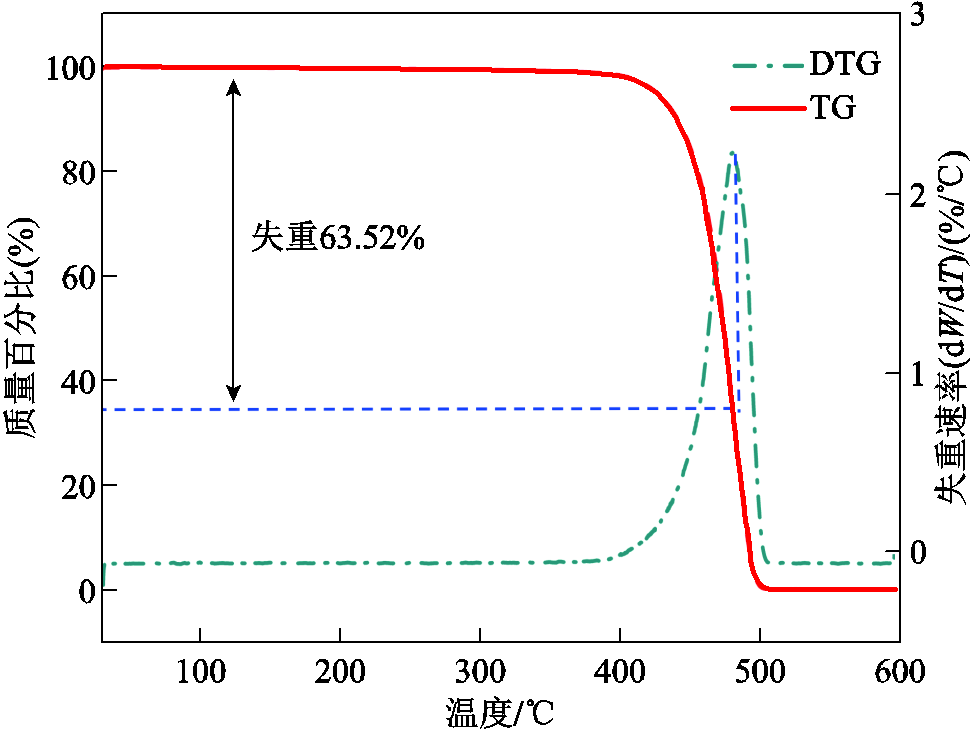
图7 对照组聚乙烯的TG曲线和DTG曲线
Fig.7 TG and DTG curves of untreated polyethylene samples
图8a为经黑曲霉菌处理不同时间的LDPE的TG曲线,图8b是与其相对应的DTG曲线。黑曲霉菌处理的样品TG曲线的总体趋势与对照组相似,但随着处理时间的增加,曲线出现了左移趋势,且起始温度和结束温度都呈现降低趋势。同时,DTG曲线的极值点也有向左移动的趋势。TG曲线的拐点和DTG曲线的峰值温度都呈现出向左移动的趋势,表明样品的热分解温度降低,热稳定性变差。由此可见,黑曲霉菌会破坏聚乙烯的分子结构使其热稳定性降低。
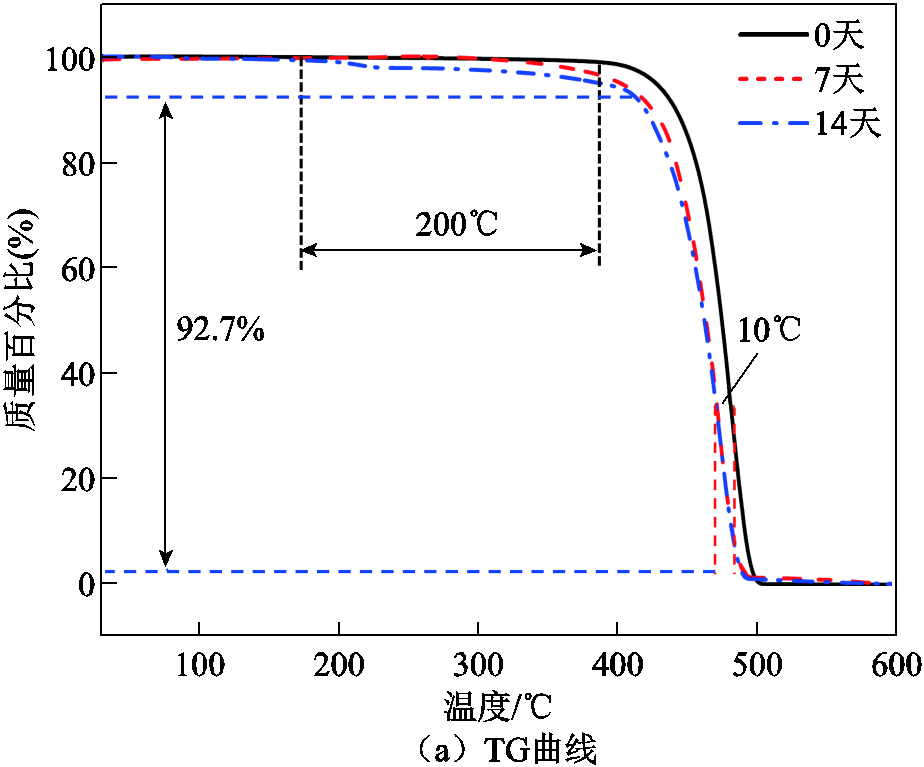
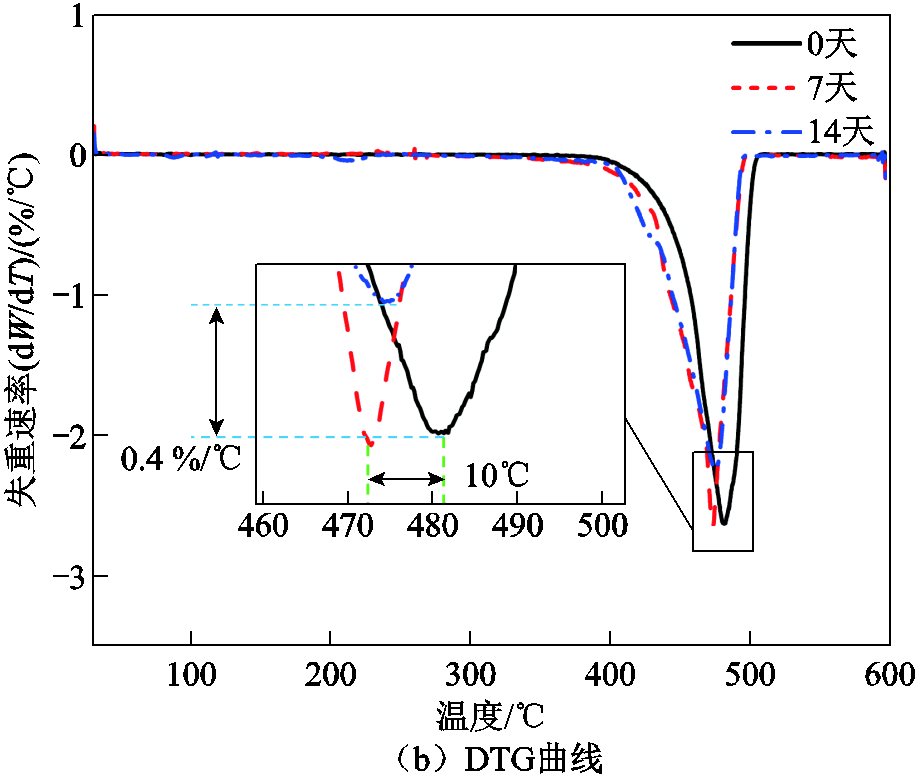
图8 经黑曲霉菌处理不同时间的LDPE的TG曲线和DTG曲线
Fig.8 TG curves and DTG curves of LDPE treated with Aspergillus niger at different times
从上述实验中可以推断,黑曲霉菌能够破坏聚乙烯的分子结构,使得细胞外酶可以更好地作用在样品上,从而进一步引入羟基/羰基和含氧基团,提高样品的亲水性,促进降解反应的深入。
处理14天后的DSC测试曲线如图9所示。在图9a的熔融曲线中,120℃内曲线有略微增长(图中箭头方向)的趋势;当温度超过120℃时,曲线呈现迅速上升趋势;在120~140℃形成熔化峰。纵向对比熔融曲线发现,随着处理时间的增加,曲线熔融峰的峰值有所下降。图9b为处理14天后样品的结晶曲线,随着处理时间的增加,其衍射峰呈降低趋势。图9c为样品熔融峰变化趋势(图9a)的局部放大图,通过Proteus Analysis寻峰发现,经黑曲霉菌处理14天后,样品熔融峰温度降低1.1℃。
由图9a可知,用黑曲霉菌处理14天后,聚乙烯的熔融峰峰值下降,并且其峰值存在向左移动的趋势。如图9b所示,处理14天后,样品的结晶峰峰值下降0.42 mW/mg,说明在黑曲霉菌的作用下,样品的晶体结构发生了一定的退化,表明样品有被降解的趋势。在黑曲霉菌降解的过程中,PE样品的非晶态位置受到微生物的攻击,因此,导致PE样品整体的熔化热降低(图9c)。
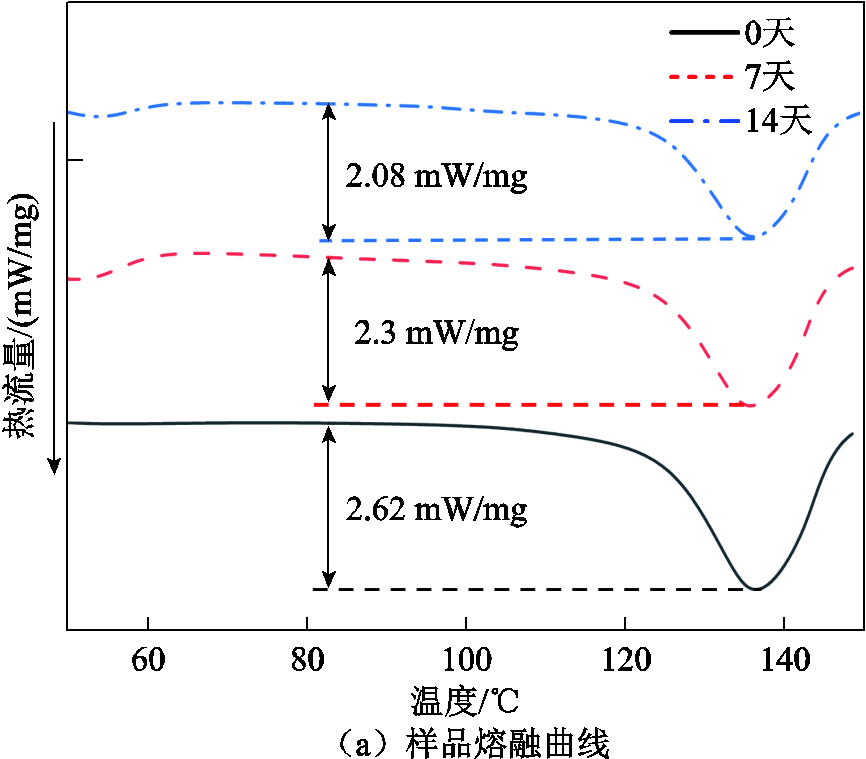
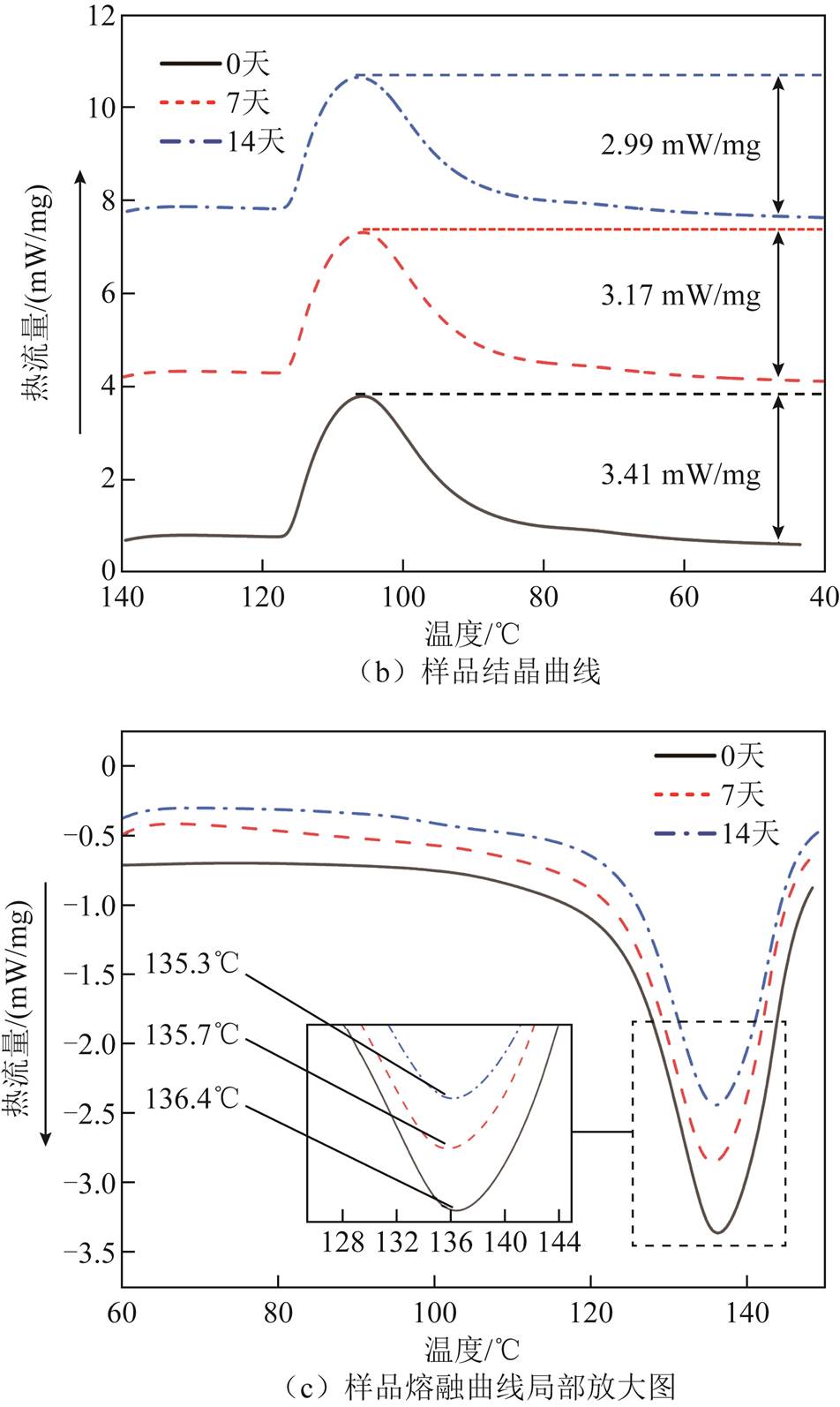
图9 处理14天后的DSC测试曲线
Fig.9 DSC test results after 14days treatment
在不作处理的条件下,PE有自氧化特性[31]。自氧化会增加分子中的亲水官能团,使得水能够扩散进入样品从而使样品膨胀,此时一旦黑曲霉菌作用于PE样品,其生物降解速率将会得到增强[32],宏观表现为熔化热的降低。
用SEM对样品进行微观形貌分析,如图10所示。由图10a可知,处理0天的样品(对照组)放大10 000倍的微观形貌呈现为颗粒饱满,表面相对光滑且无明显裂痕。将处理0天样品(对照组)放大50 000倍,其微观形貌如图10b所示,样品表面虽存在凹陷,但并无明显交联断裂现象。图10c为实验7天的样品放大10 000倍的微观形貌,其表面形貌粗糙多孔、凹凸不平,出现明显的孔隙和沟壑。图10d为实验7天样品放大50 000倍的微观形貌,可见样品存在明显的交联断裂现象,微观形貌受到破坏。处理14天样品放大10 000倍的微观形貌如图10e所示,可见样品表层裂痕加深。将处理14天样品放大50 000倍,如图10f所示,样品产生更加明显的交联断裂现象。

图10 黑曲霉菌处理后的聚乙烯微观形貌
Fig.10 Micromorphology of PE after treatment
与对照组聚乙烯样品进行对比可见,用黑曲霉菌处理后的样品均出现了不同程度的裂痕,且数量和断裂的程度也随着时间的增加而增加。实验组出现明显的裂痕、沟壑,表明黑曲霉菌对LDPE具有降解能力,能破坏聚乙烯的微观结构。
聚乙烯的降解需要两类酶的作用,为了分别引入羟基和氧化官能团,第一类酶包含细胞色素P450酶、烷烃羟化酶AlkB、漆酶和过氧化物酶等;第二类酶包含醇脱氢酶、醛脱氢酶、单加氧酶和酯酶等[33]。上述两类酶与聚乙烯结合破坏聚乙烯主链结构,将其转化为含氧低聚物。
第一类酶作用在聚合物链中的位置有末端、亚末端和链内三种,这类酶与聚乙烯的反应会导致长链的断裂。长链断裂后的低聚物又会在第二类酶的作用下形成脂肪酸。进一步地,形成的脂肪酸就可以反向地通过微生物细胞膜进入细胞内部并参与氧化还原反应,最终通过微生物细胞内的β-氧化途径和三羧酸循环分解为无污染的水和CO2[34]。
上述反应流程可以通过本文的实验分析结果得到印证:在FTIR分析中新出现的吸收峰,与降解过程中出现的羟基、羰基以及C—O—C基团相对应,说明在醇脱氢酶和单加氧酶的作用下,部分反应过程已经实现;在XPS分析中发现,随着降解时间的延长,样品的表面的C元素含量减少,O元素含量增加,并且在C1s分峰拟合曲线中发现有羰基(—C=O)和C—O—C基团的出现,进一步印证了FTIR分析的结果;在DSC-TGA联合分析中发现,黑曲霉菌处理14天后的聚乙烯样品热分解能力和吸热能力明显降低:热分解的起始温度降低200℃,终止温度降低10℃,样品的熔融峰峰值降低0.54 mW/mg,峰值温度降低1.1℃,这说明降解过程中引入了键能较低的C—O键。
基于以上实验对降解的物理过程和化学过程表征结果,结合之前的文献报道,本文提出一个合理的聚乙烯降解过程,如图11所示。聚乙烯的降解可分为四个阶段:侵蚀、解聚、同化、矿化[35-36]。
侵蚀阶段,微生物在聚乙烯表面附着形成生物膜,通过分泌多种细胞外酶降低聚乙烯样品的疏水性,促进聚乙烯的降解。在XRD实验中,根据式(1)的计算结果可发现,随着处理时间的增加,样品的结晶度逐渐降低。在SEM的观察下,处理0天的样品颗粒交联完整,无明显破坏痕迹;随着降解时间的增加,能发现明显的裂痕、沟壑及交联断裂现象,并且随着时间继续增加,此现象更为明显。这表明微生物分泌的外酶会攻击聚乙烯的长链使大分子的聚乙烯链断裂。
解聚阶段,断裂后的低聚合度聚乙烯首先在羟基化酶的作用下在链内、亚末端及末端三种位置形成羟基;接着通过醇脱氢酶和单加氧酶的作用形成酯类;再在酯酶的作用下分解为脂肪酸和脂肪醇;最后,脂肪醇在醇脱氢酶和醛脱氢酶的作用下进一步被氧化为脂肪酸,产生解聚阶段的最终产物。
同化阶段,经过侵蚀及解聚阶段形成的低聚物可以通过微生物的细胞膜进入微生物细胞内,作为黑曲霉菌生长和代谢的碳源[37]。由于聚乙烯和烷烃的化学物质结构类似,可认为聚乙烯的生物降解机理和烷烃也是类似的[38]。
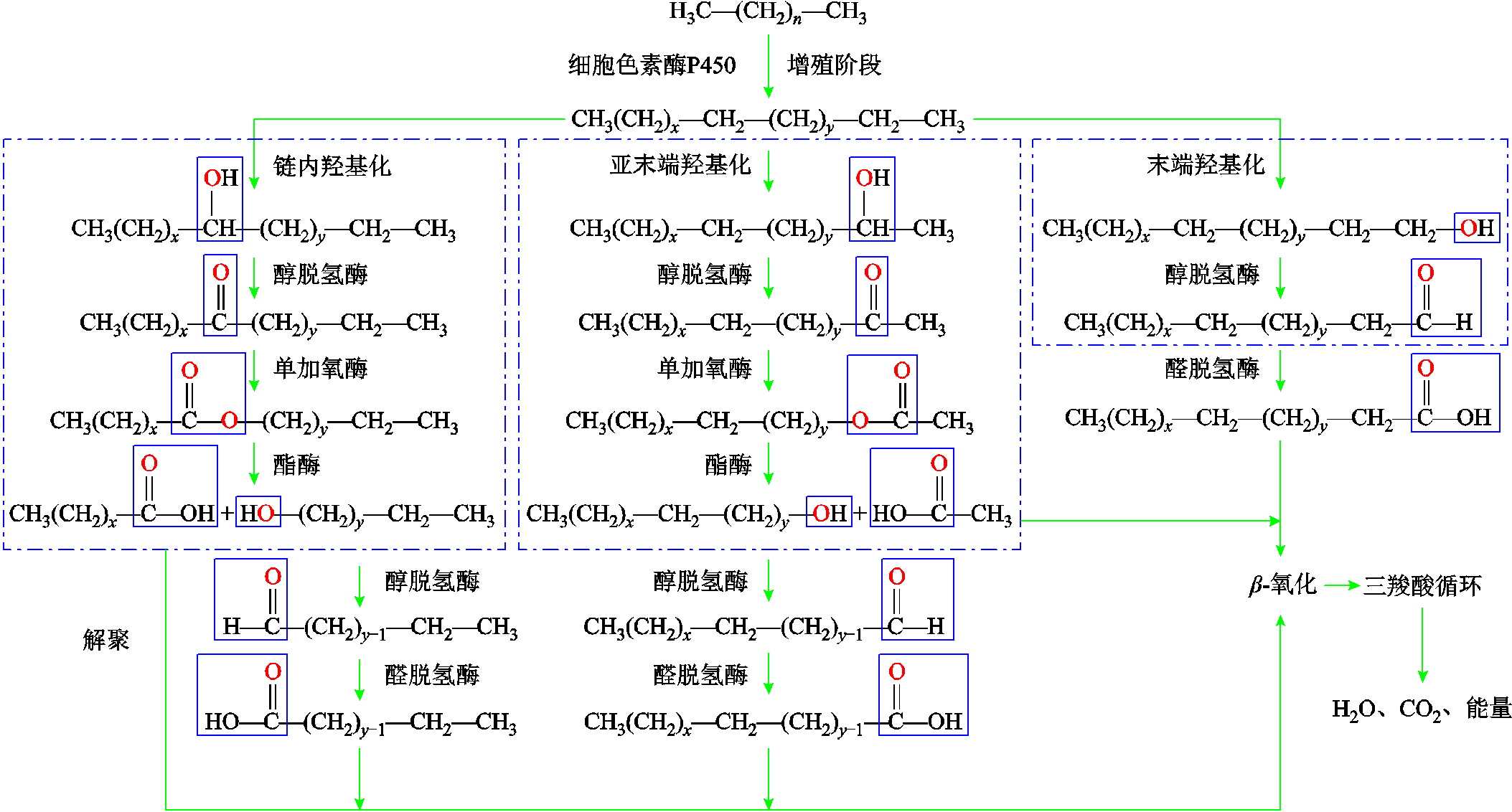
图11 微生物降解聚乙烯机理
Fig.11 Mechanism of microbial degradation of polyethylene
矿化阶段,在同化阶段中产生的一些代谢产物和未被同化的产物在矿化阶段中被完全吸收和利用,并进一步转化为能源、碳源、CO2和水。
综上所述,黑曲霉菌降解聚乙烯过程的中间产物与FTIR、TGA实验结果对应良好。
黑曲霉菌与聚乙烯的反应产物脂肪酸可以进入细胞内参与氧化还原反应,生成CO2和水,采用微生物降解电缆的聚乙烯组分是环境友好的。
目前,聚乙烯生物降解仍在研究阶段,已发现多种微生物能够降解聚乙烯。可以通过纯化菌种、培养合成微生物群落、研究聚乙烯降解酶等方式,提高微生物降解的效率,使微生物降解应用到电缆行业,为解决电缆有机固体废弃物闲置堆积提供一个绿色环保的方法。
本文通过分析黑曲霉菌降解聚乙烯过程中官能团、晶体结构以及变温热特性等理化特性的实验结果,根据特征官能团的变化将降解过程划分为四个阶段,提出了降解过程中的不同阶段的化学反应机理,得到以下主要结论:
1)经黑曲霉菌处理14天的聚乙烯电缆基料样品的微观形貌出现明显的沟壑、孔隙和交联断裂现象,表明黑曲霉菌在增殖阶段分泌的细胞外酶攻击了聚乙烯分子链,使其长分子链断裂成小分子链。
2)与未处理样品相比,经黑曲霉菌处理14天的聚乙烯样品的TG曲线起始温度降低了200℃,热分解最终温度降低了10℃,且DTG曲线的峰值向左移动了10℃,样品的热流量降低了0.54 mW/mg,表明处理后的样品热分解温度降低,热稳定性变差。
3)XPS和FTIR分析结果表明,在降解过程中样品羟基、羰基、C—O—C基团的含量逐渐增加,而C—H键的伸缩振动和变形振动呈衰弱趋势。黑曲霉菌分泌的细胞外酶引入羟基,生成的醇类物质的羟基又在醇脱氢酶的作用下生成羰基,进一步在单加氧酶的作用下生成了C—O—C基团。
4)黑曲霉菌侵蚀14天后,聚乙烯样品的两个特征衍射峰分别下降19.5%和14.3%,并且相对结晶度随着时间的延长从53.4%下降至34.18%,说明经黑曲霉菌作用后,引入的羟基、羰基、C—O—C基团破坏了原有分子链的规整性和对称性,导致结晶度降低。
参考文献
[1] 王镜然, 王英杰, 庄宏伟, 等. 低压电缆绝缘热氧老化过程中介电响应的Davidson-Cole分析[J]. 电工技术学报, 2023, 38(15): 4030-4039. Wang Jingran, Wang Yingjie, Zhuang Hongwei, et al. Dielectric response during thermal-oxidative aging of low-voltage cable insulation analyzed by davidson-cole[J]. Transactions of China Electrotechnical Society, 2023, 38(15): 4030-4039.
[2] 王湄, 黄斯平, 林远, 等. 浅析绿色环保概念在电线电缆中的应用[J]. 质量探索, 2022, 19(2): 91-94. Wang Mei, Huang Siping, Lin Yuan, et al. Application of green environmental concept in wires and cables[J]. Quality Exploration, 2022, 19(2): 91-94.
[3] 王昊月, 李成榕, 王伟, 等. 高压频域介电谱诊断XLPE电缆局部绝缘老化缺陷的研究[J]. 电工技术学报, 2022, 37(6): 1542-1553. Wang Haoyue, Li Chengrong, Wang Wei, et al. Local aging diagnosis of XLPE cables using high voltage frequency domain dielectric spectroscopy[J]. Transactions of China Electrotechnical Society, 2022, 37(6): 1542-1553.
[4] 陈向荣, 洪泽林, 朱光宇, 等. 高温下电压稳定剂对交联聚乙烯电树枝化及局部放电特性的影响[J]. 电工技术学报, 2023, 38(3): 577-586. Chen Xiangrong, Hong Zelin, Zhu Guangyu, et al. Effect of voltage stabilizer on electrical treeing and partial discharge characteristics of crosslinked polyethylene at high temperature[J]. Transactions of China Electrotechnical Society, 2023, 38(3): 577-586.
[5] 王国栋, 周凯, 李原, 等. 基于失效时间统计特性的交联聚乙烯电寿命模型修正[J]. 电工技术学报, 2023, 38(4): 1042-1050. Wang Guodong, Zhou Kai, Li Yuan, et al. Modification of cross-linked polyethylene electrical life model based on statistical characteristics of failure time[J]. Transactions of China Electrotechnical Society, 2023, 38(4): 1042-1050.
[6] 王昊月, 王晓威, 孙茂伦, 等. XLPE电缆绝缘热老化的高压频域介电谱诊断方法[J]. 电工技术学报, 2022, 37(17): 4497-4507. Wang Haoyue, Wang Xiaowei, Sun Maolun, et al. High voltage frequency domain dielectric spectro-scopy diagnosis method for thermal aging of XPLE cables[J]. Transactions of China Electrotechnical Society, 2022, 37(17): 4497-4507.
[7] 刘文杰, 陈杰, 江平开, 等. 环境友好热固性电工绝缘材料与制备技术[J]. 电工技术学报, 2022, 37(5): 1115-1127. Liu Wenjie, Chen Jie, Jiang Pingkai, et al. Environmental-friendly electrical insulating thermosets and preparation technology[J]. Transactions of China Electrotechnical Society, 2022, 37(5): 1115-1127.
[8] Balasubramanian V, Natarajan K, Hemambika B, et al. High-density polyethylene (HDPE)-degrading potential bacteria from marine ecosystem of Gulf of Mannar, India[J]. Letters in Applied Microbiology, 2010, 51(2): 205-211.
[9] Harshvardhan K, Jha B. Biodegradation of low-density polyethylene by marine bacteria from pelagic waters, Arabian Sea, India[J]. Marine Pollution Bulletin, 2013, 77(1/2): 100-106.
[10] Tribedi P, Sil A K. Low-density polyethylene degradation by pseudomonas sp. AKS2 biofilm[J]. Environmental Science and Pollution Research, 2013, 20(6): 4146-4153.
[11] 冯静. 白浅灰链霉菌对聚乙烯降解效果研究及降解酶的基因克隆[D]. 成都: 四川师范大学, 2016.
[12] Li Zhongyu, Wei Ren, Gao Meixi, et al. Biodegradation of low-density polyethylene by Microbulbifer hydrolyticus IRE-31[J]. Journal of Environmental Management, 2020, 263: 110402.
[13] 李玮, 王丹丹, 庞诗琪, 等. 大麦虫及其肠道微生物对聚乙烯的生物降解[J]. 微生物学通报, 2023, 50(4): 1422-1431. Li Wei, Wang Dandan, Pang Shiqi, et al. Biodegradation of polyethylene by zophobas atratus and its gut microorganisms[J]. Microbiology China, 2023, 50(4): 1422-1431.
[14] 吴慧. 生物降解高密度聚乙烯基农用覆盖地膜及降解机理研究[D]. 兰州: 西北民族大学, 2023.
[15] El-Sayed M T, Rabie G H, Hamed E A. Biodegradation of low-density polyethylene (LDPE) using the mixed culture of Aspergillus carbonarius and A. fumigates[J]. Environment, Development and Sustainability, 2021, 23(10): 14556-14584.
[16] Khandare S D, Agrawal D, Mehru N, et al. Marine bacterial based enzymatic degradation of low-density polyethylene (LDPE) plastic[J]. Journal of Environmental Chemical Engineering, 2022, 10(3): 107437.
[17] Tiwari N, Santhiya D, Sharma J G. Degradation of polyethylene microplastics through microbial action by a soil isolate of BreviBacillus brevis[J]. Polymer Degradation and Stability, 2023, 215: 110436.
[18] Canevarolo S V. Chain scission distribution function for polypropylene degradation during multiple extrusions[J]. Polymer Degradation and Stability, 2000, 70(1): 71-76.
[19] Ojha N, Pradhan N, Singh S, et al. Evaluation of HDPE and LDPE degradation by fungus, implemented by statistical optimization[J]. Scientific Reports, 2017, 7: 39515.
[20] Ji Y, Mao G, Wang Y, et al. Structural insights into diversity and n-alkane biodegradation mechanisms of alkane hydroxylases[J]. Frontiers in microbiology, 2013, 4: 58.
[21] Yeom S J, Le T K, Yun C H. P450-driven plastic-degrading synthetic bacteria[J]. Trends in Bio-technology, 2022, 40(2): 166-179.
[22] Hou Lijun, Xi Jiao, Liu Jiaxi, et al. Biodegradability of polyethylene mulching film by two Pseudomonas bacteria and their potential degradation mechanism[J]. Chemosphere, 2022, 286: 131758.
[23] 唐俊, 赵文强, 侍乔明, 等. 混合级联特高压直流系统解/闭锁问题分析及对策[J]. 电力系统自动化, 2023, 47(16): 171-180. Tang Jun, Zhao Wenqiang, Shi Qiaoming, et al. Analysis and countermeasures of deblocking/blocking problems in hybrid cascaded UHVDC system[J]. Automation of Electric Power Systems, 2023, 47(16): 171-180.
[24] 李忠磊, 赵宇彤, 韩涛, 等. 高压电缆半导电屏蔽材料研究进展与展望[J]. 电工技术学报, 2022, 37(9): 2341-2354. Li Zhonglei, Zhao Yutong, Han Tao, et al. Research progress and prospect of semi-conductive shielding composites for high-voltage cables[J]. Transactions of China Electrotechnical Society, 2022, 37(9): 2341-2354.
[25] 王昱力, 黄凯文, 王格, 等. 基于Comsol仿真的高压直流电缆附件材料电导率特性研究[J]. 高压电器, 2023, 59(9): 258-267. Wang Yuli, Huang Kaiwen, Wang Ge, et al. Research on conductivity characteristics of HVDC cable accessory material based on comsol simulation[J]. High Voltage Apparatus, 2023, 59(9): 258-267.
[26] Kawai F, Watanabe M, Shibata M, et al. Comparative study on biodegradability of polyethylene wax by bacteria and fungi[J]. Polymer Degradation and Stability, 2004, 86(1): 105-114.
[27] Gao Rongrong, Liu Rui, Sun Chaomin. A marine fungus Alternaria alternata FB1 efficiently degrades polyethylene[J]. Journal of Hazardous Materials, 2022, 431: 128617.
[28] Sarathi R, Das S, Anil Kumar C R, et al. Analysis of failure of crosslinked polyethylene cables because of electrical treeing: a physicochemical approach[J]. Journal of Applied Polymer Science, 2004, 92(4): 2169-2178.
[29] Gulmine J V, Akcelrud L. Correlations between the processing variables and morphology of crosslinked polyethylene[J]. Journal of Applied Polymer Science, 2004, 94(1): 222-230.
[30] Ratner S, Weinberg A, Marom G. Morphology and mechanical properties of crosslinked PE/PE composite materials[J]. Polymer Composites, 2003, 24(3): 422-427.
[31] Rummel C D, Jahnke A, Gorokhova E, et al. Impacts of biofilm formation on the fate and potential effects of microplastic in the aquatic environment[J]. Environmental Science & Technology Letters, 2017, 4(7): 258-267.
[32] Kasirajan S, Ngouajio M. Polyethylene and biodegradable mulches for agricultural applications: a review[J]. Agronomy for Sustainable Development, 2012, 32(2): 501-529.
[33] Ivshina I B, Kuyukina M S, Krivoruchko A V, et al. Responses to ecopollutants and pathogenization risks of saprotrophic rhodococcus species[J]. Pathogens, 2021, 10(8): 974.
[34] Jeon H J, Kim M N. Functional analysis of alkane hydroxylase system derived from Pseudomonas aeruginosa E7 for low molecular weight polyethylene biodegradation[J]. International Biodeterioration & Biodegradation, 2015, 103: 141-146.
[35] Restrepo-Flórez J M, Bassi A, Thompson M R. Microbial degradation and deterioration of polyethylene-a review[J]. International Biodeterioration & Biodegradation, 2014, 88: 83-90.
[36] Ali S S, Elsamahy T, Al-Tohamy R, et al. Plastic wastes biodegradation: mechanisms, challenges and future prospects[J]. Science of the Total Environment, 2021, 780: 146590.
[37] Ali Shah A, Hasan F, Hameed A, et al. Biological degradation of plastics: a comprehensive review[J]. Biotechnology Advances, 2008, 26(3): 246-265.
[38] Van Beilen J B, Li Z, Duetz W A, et al. Diversity of alkane hydroxylase systems in the environment[J]. Oil & Gas Science and Technology, 2003, 58(4): 427-440.
Abstract In recent years, the accumulation of organic solid waste, particularly from the retirement of extensive cable systems, poses a significant threat to environmental cleanliness and human health.However, traditional incineration methods only exacerbate environmental pollution. Therefore, there is an urgent need for a safe and environmentally friendly degradation method to address the challenge of managing discarded cables. To investigate the process of microbial degradation of discarded polyethylene (PE) components, this study selected Aspergillus niger to treat polyethylene powder. The study examined the effects and reaction mechanisms of Aspergillus niger on the degradation of polyethylene in discarded cables by analyzing changes in functional groups, crystallinity, elemental composition, and the microscopic morphology of the samples.
First, Fourier-transform infrared analysis (FTIR) was used to detect changes in the functional groups of the samples after treatment with Aspergillus niger. New functional groups, such as hydroxyl and carbonyl groups, were observed. Subsequently, the possible degradation products, such as alcohols and aldehydes, were analyzed through the newly formed chemical bonds. X-ray photoelectron spectroscopy (XPS) was employed to scan and analyze the changes in the carbon-oxygen elements on the sample's surface. After two weeks of treatment, the atomic ratio of oxygen elements on the surface increased from 1.38% to 13.6%. Further analysis of the sample's crystalline structure through X-ray diffraction (XRD) experiments revealed a decrease in crystallinity from 53.4% to 34.18%, indicating the disruption of the regularity of polymer molecular chains. In addition to these findings, a combined differential scanning calorimetry-thermogravimetric analysis (DSC-TGA) method was used to analyze the sample's thermal properties at different temperatures. The initial decomposition temperature decreased by 200℃, and the final decomposition temperature declined by 10℃. This phenomenon suggested the presence of lower-energy carbon-oxygen bonds during the degradation process, corresponding to the new functional groups observed in the FTIR analysis. Finally, scanning electron microscopy (SEM) was employed to observe the microscopic morphology of the samples at magnifications ranging from 10 000 to 50 000 times, revealing the presence of pores, grooves, cross-linking fractures, and other features on the sample's surface. This led to the inference that the samples had been attacked by extracellular enzymes produced by the Aspergillus niger.
From the experimental results, the following conclusions can be drawn: (1)Aspergillus niger produces hydroxyl groups during the degradation of low-density polyethylene cable material. Subsequently, under the action of enzymes such as alcohol dehydrogenase and monooxygenase, these hydroxyl groups are converted into carbonyl and C—O—C groups, promoting the degradation process. (2)With increasing treatment time by Aspergillus niger, thermal decomposition and melting experiments indicate the presence of lower-energy carbon-oxygen bonds during the degradation process. This is consistent with the appearance of new functional groups in FTIR analysis and the increase in the atomic ratio of oxygen elements in XPS. (3)After being attacked by Aspergillus niger, the relative crystallinity of polyethylene samples decreased from 53.4% to 34.18% with prolonged treatment time. This phenomenon indicates that Aspergillus niger. can attack the polymer chains of polyethylene, disrupting their regularity and symmetry, leading to a reduction in crystallinity. (4)Microscopic observations of the sample's morphology revealed the presence of clear pores, grooves, and cross-linking fractures. This suggests that Aspergillus niger. can secrete extracellular enzymes to attack the polyethylene molecular chains, causing long-chain molecules to break into smaller chains and promoting degradation.
keywords:Obsolete cables, microorganism, polyethylene, biodegradation
DOI:10.19595/j.cnki.1000-6753.tces.231446
中图分类号:TM212;X705
国家自然科学基金(52207154, 52007065)、河北省自然科学基金(E2023502087)和中央高校基本科研业务费专项资金(2023MS104)资助项目。
收稿日期 2023-08-31
改稿日期 2023-09-28
杨世芳 女,1994年生,博士,讲师,硕士生导师,研究方向为高电压外绝缘生物染污问题、退役绝缘材料无害化处理等。E-mail:yangsf@ncepu.edu.cn
谢 军 男,1988年生,博士,副教授,硕士生导师,研究方向为电工绝缘材料劣化机理,高电压与绝缘技术等。E-mail:junxie@ncepu.edu.cn(通信作者)
(编辑 李 冰)