等离子体活化水溶液用于癌症治疗的研究综述
张 浩 张基珅 许德晖 刘定新 荣命哲
(西安交通大学等离子体生物医学研究中心 西安 710049)
摘要 大气压冷等离子体作为高效产生外源活性粒子的新技术,很有可能成为安全、高效的癌症治疗新方法,但等离子体直接处理人体组织存在渗透深度浅、有效时间短的固有局限,使得应用潜力难以有效释放。等离子体活化水溶液(PAS)作为大气压冷等离子体的一种间接应用形式,具有活性时间长、穿透能力强和作用范围大等优势,近年来被广泛用于癌症治疗研究。该文主要围绕PAS制备、体外抗癌效应和生物学机制、活体抗癌应用及生物安全性三个层面,对近十年来的国内外相关研究进展进行了综述。PAS癌症治疗研究方兴未艾,该综述将为相关的理论和应用研究提供参考。
关键词:大气压冷等离子体 等离子体活化水溶液 活性粒子 癌症治疗
0 引言
癌症是全球最严重的公共卫生问题之一,据世界卫生组织国际癌症研究中心统计显示,2020年全球癌症新发病例1 929万例,死亡病例996万例;其中我国癌症新发457万例,死亡300万例,呈逐年上升趋势[1]。为了进一步提升国民健康水平,2018年的国务院政府工作报告中首次明确提出“加强癌症等重大疾病防治攻关”,并将其列为人口与健康领域优先部署的重点任务。当前的医疗技术不能很好地满足癌症治疗需求,其中的关键挑战包括选择性差、副作用大、易产生耐药性、适用人群少等[2-4]。癌症作为现代医学久攻不下的顽疾,有必要超越常规思维,开发颠覆性的抗癌新技术,助力“健康中国”战略。
高压放电产生的大气压冷等离子体(以下简称等离子体)具有电子温度超过10 000℃、气体温度接近室温的特点。高的电子温度可以有效产生具有生物效应的多种活性粒子,而低的气体温度可以使等离子体与人体友好接触,从而于20世纪末诞生出新的交叉学科方向——等离子体医学[5-8]。等离子体医学的一个重要应用是癌症治疗。近年来,大量研究表明合适剂量的等离子体辐照可以选择性杀灭癌细胞,甚至耐药癌细胞[9-11],且不会对正常细胞造成明显损伤[12-13]。进一步研究发现,等离子体抗癌作用主要通过其产生的活性氧粒子(Reactive Oxygen Species, ROS)和活性氮粒子(Reactive Nitrogen Species, RNS)来实现[14-15]。虽然等离子体很有可能发展成为安全、有效的癌症治疗新方法,有实现精准治疗的巨大潜力,但目前等离子体癌症治疗研究仅推进至临床Ⅰ期阶段。导致发展缓慢的关键挑战包括:①等离子体作用深度浅。研究发现,等离子体活性粒子对机体组织的渗透深度往往小于100 μm[16],难以直接治疗组织深层的肿瘤病灶。②等离子体有效时间短。研究表明大部分等离子体活性粒子在机体组织中的寿命小于1 min,难以起到持续性的抗癌作用。③等离子体作用强度和均匀性受机体组织形貌和电特性影响大,难以保持抗癌效果的稳定性。亟待突破这些瓶颈问题,以推动等离子体癌症治疗技术快速向临床应用发展。
由于肿瘤病灶往往位于组织内部,而人体组织又含有约70%的水,这就意味着在等离子体直接辐照治疗过程中,等离子体必须经历细胞周围的液体环境并将气相活性粒子转化为液相活性粒子,才能最终作用到癌细胞。所以人们常说的“等离子体直接抗癌”,其实是通过等离子体与组织表面水溶液相互作用来实现的。随着研究的深入,国内外学者发现利用等离子体对溶液进行辐照处理时,等离子体中的气相活性粒子通过复杂的气-液、液-液反应会转化生成种类丰富的液相ROS和RNS粒子,例如1O2、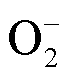 、H2O2、ONOOH、O2NOOH、
、H2O2、ONOOH、O2NOOH、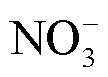 等[17-18]。这种等离子体辐照处理后的水溶液又被称为等离子体活化水溶液(Plasma-Activated Solutions, PAS)。从活性粒子层面来讲,由于PAS也能提供丰富的外源ROS和RNS,那么PAS是否像等离子体一样也具有良好的抗癌效应?为了验证这一猜想,H. Tanaka等早在2011年利用等离子体活化的培养液处理细胞,发现等离子体活化培养液可以选择性杀灭体外培养的恶性胶质瘤细胞[19];随后的大量研究也证实了PAS对卵巢癌细胞、膀胱癌细胞、肺癌细胞等多种癌细胞都具有高效灭活效应[20-22]。此外,F. Utsumi等在2013年率先开展了PAS活体抗癌研究,并发现癌旁注射等离子体活化培养液能够有效抑制裸鼠皮下卵巢瘤的生长[23];而S. Takeda等发现通过腹腔注射等离子体活化培养液后,可使小鼠腹膜肿瘤转移结节减少60%[24]。上述相关研究很好地回答了PAS抗癌“有效性”的问题,同时也为进一步开发等离子体癌症治疗技术提供了一条新思路。作为等离子体的一种间接应用形式,PAS可以采用局部注射、腔内灌注、创面冲洗等方式直接作用到组织深处的肿瘤病灶(见图1),这极大拓展了等离子体的抗癌作用深度和范围。另外,研究表明PAS中的部分长寿命活性粒子可存在数小时乃至几天[25],且低温保存一周的PAS仍具有一定的抗癌性能[22]。而且PAS制备与抗癌应用实现了完全分离,其治疗过程可以避免肿瘤组织形貌和电特性对等离子体放电的影响,在一定程度上保证了抗癌效果的稳定性。因此,PAS有望突破直接使用等离子体治疗癌症的诸多局限,进一步释放等离子体抗癌潜力,对PAS的研究已成为等离子体医学的热点方向之一。
等[17-18]。这种等离子体辐照处理后的水溶液又被称为等离子体活化水溶液(Plasma-Activated Solutions, PAS)。从活性粒子层面来讲,由于PAS也能提供丰富的外源ROS和RNS,那么PAS是否像等离子体一样也具有良好的抗癌效应?为了验证这一猜想,H. Tanaka等早在2011年利用等离子体活化的培养液处理细胞,发现等离子体活化培养液可以选择性杀灭体外培养的恶性胶质瘤细胞[19];随后的大量研究也证实了PAS对卵巢癌细胞、膀胱癌细胞、肺癌细胞等多种癌细胞都具有高效灭活效应[20-22]。此外,F. Utsumi等在2013年率先开展了PAS活体抗癌研究,并发现癌旁注射等离子体活化培养液能够有效抑制裸鼠皮下卵巢瘤的生长[23];而S. Takeda等发现通过腹腔注射等离子体活化培养液后,可使小鼠腹膜肿瘤转移结节减少60%[24]。上述相关研究很好地回答了PAS抗癌“有效性”的问题,同时也为进一步开发等离子体癌症治疗技术提供了一条新思路。作为等离子体的一种间接应用形式,PAS可以采用局部注射、腔内灌注、创面冲洗等方式直接作用到组织深处的肿瘤病灶(见图1),这极大拓展了等离子体的抗癌作用深度和范围。另外,研究表明PAS中的部分长寿命活性粒子可存在数小时乃至几天[25],且低温保存一周的PAS仍具有一定的抗癌性能[22]。而且PAS制备与抗癌应用实现了完全分离,其治疗过程可以避免肿瘤组织形貌和电特性对等离子体放电的影响,在一定程度上保证了抗癌效果的稳定性。因此,PAS有望突破直接使用等离子体治疗癌症的诸多局限,进一步释放等离子体抗癌潜力,对PAS的研究已成为等离子体医学的热点方向之一。
为了方便读者全面了解PAS用于癌症治疗的效果和机制,本文将从以下几个方面综述国内外有关PAS抗癌的研究进展,包括:PAS的制备、体外抗癌效应与机制、活体抗癌应用和安全性,并在最后对PAS抗癌研究存在的几个关键科学问题进行了总结与展望。
1 等离子体活化水溶液的制备
PAS制备过程实际上就是等离子体与水溶液的相互作用过程。其中,等离子体发生装置类型、不同水溶液提供的初始环境以及活化方式的选择均决定了水溶液的活化效率,并影响着水溶液中的活性粒子组成。鉴于此,本节主要从等离子体类型、水溶液种类、活化处理方式三个方面来阐述PAS的制备及调控过程。
1.1 用于水溶液活化的等离子体类型
在等离子体生物医学应用研究中,PAS主要通过介质阻挡放电等离子体、射流放电等离子体、滑动弧放电等离子体以及高频(微波、射频)放电等离子体处理水溶液获得[26-27]。对于介质阻挡放电等离子体装置,其通常由两个金属电极及其间隙中绝缘介质构成(见图2a)[28-29]。由于普通介质阻挡放电等离子体装置的放电气隙仅为毫米至几个厘米,对被处理物的尺寸范围有较高要求,因此研究人员进一步开发了一种表面放电结构的介质阻挡放电等离子体装置,其特点是高压电极和地电极紧贴在绝缘介质板的两侧,从而没有空气间隙,施加电压后等离子体产生于地电极侧的介质板表面(见图2b)[30],活性粒子通过对流、浓度梯度扩散以及电磁场等综合作用抵达水溶液表面。该类型等离子体装置拥有独立的放电回路,可以直接在空气中产生等离子体,而且其放电特性对被处理物及周围环境没有强烈的依赖性[31],适合对大面积样品进行处理[32]。但是由于表面放电是对电极附近的气体放电,因此等离子体只能沿电极表面分布,这使得短寿命活性粒子很难输送至水溶液中,一些中性粒子只能通过扩散穿过气体间隙作用到水溶液上[33],从而降低了等离子体对水溶液的活化效率。
对于等离子体射流装置,其在电极等基本要素方面与介质阻挡放电相同,区别在于射流放电需要流动的工作气体。这里的工作气体通常使用稀有气体如氦气或氩气,有时为增加等离子体射流产生的活性粒子种类和浓度会在稀有气体中掺杂少量空气或氧气等[34-37]。放电时,等离子体产生的活性粒子在电场和气流场双重作用下由放电区域输送到管口喷出(见图2c)[38]。笔者课题组曾对平行场和垂直场两种射流放电结构进行比较,发现使用平行场射流结构可以更有效地将活性粒子输送到水溶液中[39]。与表面放电相比,射流放电产生的等离子体直径最大仅为几个毫米,能够处理的样品面积较小。但由于等离子体射流不受电极结构约束,其可以直接与水溶液接触,从而提高了活性粒子的输送效率。
在等离子体的直接应用中,研究人员常采用稀有气体作为放电气体,此时等离子体产生的主要是短寿命活性粒子,因而无法在活化水溶液中有效存储,所以使用稀有气体放电处理水溶液的活化效率很低。由于液相活性粒子浓度实质上取决于气相活性粒子浓度,为了提高液相活性粒子浓度,必须首先获得高浓度的气相活性粒子。等离子体活化水溶液的制备常采用空气作为放电气体,它可以产生高密度的长寿命活性粒子,而长寿命活性粒子在水中又能相互反应,持续产生短寿命活性粒子,从而使得活化水溶液可以在相对比较长的时间内保持生物活性。同时为了减少放电过程中水溶液的蒸发,等离子体的气体温度不宜太高,其作用到液面的气温应低于100℃。目前,除前文介绍的介质阻挡放电等离子体外,滑动电弧放电和微波放电(见图2d和图2e)可以在满足上述要求的同时用于制备PAS[40-41],但目前相关的研究开展不多。
1.2 常用的水溶液种类
由于不同种类水溶液提供的初始环境不同,这就使得等离子体与不同溶液相互作用后产生的液相活性粒子组分会有显著差异,进而影响PAS的生物医学效应。目前常用于等离子体活化的水溶液主要有以下几种:
1)去离子水:去离子水是通过离子交换树脂除去水中的离子态杂质而得到的近于纯净的水。相较于其他溶液,去离子水中的粒子种类最为简单,仅包含H2O、H+与OH-。故而研究人员在探索其他种类PAS的生物医学效应时,通常会借助等离子体活化去离子水中活性粒子的物理化学过程来进行分析[42]。目前,针对等离子体活化去离子水的研究,主要通过实验检测来获得某些液相活性粒子在其中的平均浓度,而大多数活性粒子在溶液中的时空演变过程则通过仿真模拟来进行描述。例如,笔者课题组利用氦直流等离子体射流处理去离子水,探讨了水中H2O2的产生机理[43];同时借助数值模拟方法发现经空气表面放电处理的去离子水溶液中存在大量以H2O2、O3、HNO2、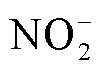 与
与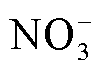 为主的ROS与RNS,且液相短寿命活性粒子可在溶液中原位产生[30]。此外,大量研究表明等离子体功率、溶液体积、处理时间等因素均会对活化去离子水中活性粒子浓度及其生物效应产生影响[44-45]。但由于去离子水无法提供人体所需要的渗透压值与pH值,因此其在临床上的应用受到很大限制。
为主的ROS与RNS,且液相短寿命活性粒子可在溶液中原位产生[30]。此外,大量研究表明等离子体功率、溶液体积、处理时间等因素均会对活化去离子水中活性粒子浓度及其生物效应产生影响[44-45]。但由于去离子水无法提供人体所需要的渗透压值与pH值,因此其在临床上的应用受到很大限制。
2)生理盐水:生理盐水是指浓度为0.9%的医用NaCl水溶液,与去离子水相比,其渗透压值与正常人体内的血液和组织液相似,因此等离子体活化的生理盐水可直接用于临床治疗。由于NaCl溶液中的无机盐溶质NaCl会电离产生Na+与Cl-,而Cl-会与ROS和RNS反应产生ClO-等活性粒子[46-47]。笔者课题组于2016年通过数值模型对活化生理盐水溶液中含氯活性粒子的产生途径进行了阐述[48];2019年,V. Jirásek与P. Lukeš采用紫外分光光度计验证了活化NaCl溶液中HClO与ClO-粒子的产生[49]。研究表明这些含氯粒子具有很强的化学活性,以HClO为例,该粒子可与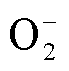 发生反应,产生OH自由基这一具有强氧化性的关键抗癌粒子,其反应速率高达7.5×106 L/(mol·s)[50]。目前等离子体活化生理盐水的抗癌效应在体外细胞和动物实验中均已得到证实[51-52]。
发生反应,产生OH自由基这一具有强氧化性的关键抗癌粒子,其反应速率高达7.5×106 L/(mol·s)[50]。目前等离子体活化生理盐水的抗癌效应在体外细胞和动物实验中均已得到证实[51-52]。
3)磷酸缓冲盐溶液(Phosphate Buffer Saline,PBS):PBS溶液是一种在生物化学研究中广泛使用的pH缓冲溶液,其溶质包括NaCl、KCl、Na2HPO4与KH2PO4。相比于去离子水和生理盐水,PBS溶液既可以维持渗透压平衡,又可以通过Na2HPO4和KH2PO4缓冲对中和过量的H+或OH-,从而稳定溶液的pH值。为了避免溶液pH变化对细胞的影响,在生物实验中PBS溶液常被作为基底溶液以确保细胞生存。由于活化溶液的pH值是影响人体生理过程的因素之一[53],所以缓冲溶液稳定pH值的特性对PAS在抗癌方面的应用是不可或缺的。此外,等离子体活化PBS溶液还需要考虑含磷粒子与ROS和RNS之间的反应。研究表明含磷粒子对ROS/RNS的液相化学过程有一定影响,如溶液中OH自由基可与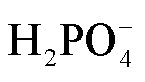 反应生成H2PO4自由基[54]。目前已有多篇文章报道等离子体活化PBS溶液对多种癌细胞的灭活效应[55-56]。
反应生成H2PO4自由基[54]。目前已有多篇文章报道等离子体活化PBS溶液对多种癌细胞的灭活效应[55-56]。
4)细胞培养液:细胞培养液是用于维持体外细胞生长的营养溶液。等离子体活化的培养液是当前癌症治疗研究中最常用的一种PAS。培养液一般包含约30种成分,包括无机盐、氨基酸、维生素和葡萄糖等等,其成分复杂且种类繁多,与之前三种溶液相比,更能反映活体内实际包含的初始反应物。研究人员一直在尝试分析培养液中各成分与等离子体中活性粒子反应后的产物在抗癌过程中所扮演的角色,并试图从中筛选出关键的抗癌活性粒子。例如,Yan Dayun等发现等离子体活化培养液中活性粒子主要与半胱氨酸反应,并且他们发现,与NO相比,H2O2更可能是导致癌细胞死亡的关键粒子[57];N. Kurake等发现等离子体活化培养液中的胎牛血清对ROS有清除作用,而对RNS影响较小[58]。此外,S. Mohades等证实等离子体活化培养液的疗效要优于凋亡诱导药物Staurosporine,其抗癌效应可以在室温下储存长达8 h[21];T. Adachi等发现当储存在-80℃下时,等离子体活化培养液可保持其抑制细胞活力的能力至少1周[22]。
1.3 等离子体对水溶液的活化处理方式
等离子体对水溶液的活化处理方式按照等离子体是否接触水溶液,可分为等离子体直接活化和间接活化两种。对于直接活化而言,除了等离子体-气体相互作用积累的活性粒子外,等离子体-水溶液相互作用产生的活性粒子也被一起输送到溶液中(见图3a)[59]。在这种活化方式下,气相活性粒子与周围的气体分子以及水分子结合在一起,使得整体反应产物的形成明显增强[25]。然而,因为等离子体直接与水溶液接触,水溶液会对等离子体本身的一些特性产生影响。例如C. E. Anderson等发现在恒定施加电压下,等离子体放电功率会随溶液电导率的降低而增加[59],而且放电中的一些物理过程,如泰勒锥、界面湍动等也会影响等离子体的均匀性和稳定性[60]。
在间接活化中,等离子体与水溶液之间不存在直接接触(见图3b)[61]。该活化方式中等离子体放电区域与水溶液之间有一定的气隙间距,因此等离子体放电特性受水溶液的影响小,实验结果重复性较好。然而,等离子体与水溶液之间的气隙间距会导致等离子体中的带电粒子以及部分短寿命活性粒子无法进入溶液,从而降低活化效率。例如笔者课题组发现大气压下带电粒子在空气中的有效扩散距离不会超过100 μm[30];S. A. Norberg等则证实间接处理时等离子体射流产生的液相活性粒子浓度远小于直接处理时[18]。
2 等离子体活化水溶液的体外抗癌研究
通过开展体外细胞实验可以方便、精确地分析PAS的选择性抗癌效应及作用机制,同时也能为进一步开展动物实验和临床研究提供定量参考依据。在实际研究中,研究人员主要通过对细胞培养液进行活化处理或将一定体积的PAS溶液添加到细胞培养液中来处理癌细胞。而目前PAS体外抗癌的研究对象主要有癌细胞、耐药癌细胞以及三维(3D)肿瘤组织模型三种。其中,癌细胞是从患者身上分离并经过贴壁或悬浮培养获得的非耐药癌细胞;耐药癌细胞是由癌细胞与化疗药物进行长期接触获得的特定药物耐受癌细胞;3D肿瘤组织模型是通过3D培养技术将癌细胞在体外培养获得,可以很好地还原癌细胞在体内的空间特性和异质性等。基于这三种体外细胞模型,可以全面地评估PAS对不同状态下癌细胞的灭活效应,相关研究进展概述如下。
2.1 PAS对癌细胞的灭活效应研究
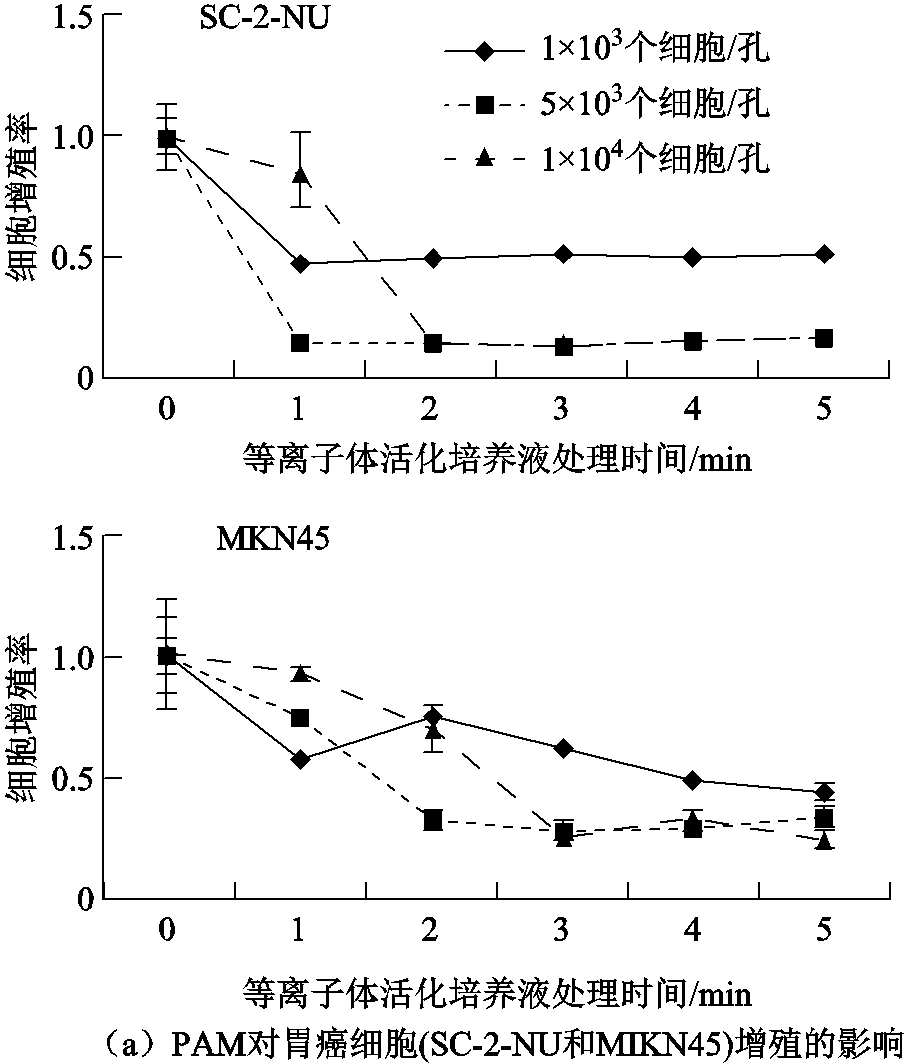
大多数PAS抗癌效应研究采用的是体外培养的二维(2D)单层癌细胞。利用这种传统的细胞培养模型,国内外同行对PAS体外抗癌效应和机制进行了详细的研究。例如,K. Torii等发现等离子体活化培养液会诱导胃癌细胞凋亡,而且活化培养液的细胞毒性受活化时间、癌细胞种类和接种细胞数量的影响(见图4a)[62];Yan Dayun等比较了等离子体活化培养液和等离子体活化缓冲液对胰腺癌和脑癌细胞的作用效果,并指出通过控制溶液稀释度可以有效调节活化液对不同癌细胞的毒性[63]。此外,基于2D培养模型,J. Duan等首次在肝癌细胞株HepG2和正常细胞株L02共培养体系中研究了等离子体活化培养液的选择性抗癌作用,发现等离子体活化处理10 min的培养液诱导癌细胞凋亡比例最大,且对正常细胞的损伤相对较小(见图4b)[13]。上述研究成果很好地证明了PAS对多种癌细胞的选择性灭活作用。
2.2 PAS对耐药癌细胞的灭活效应研究
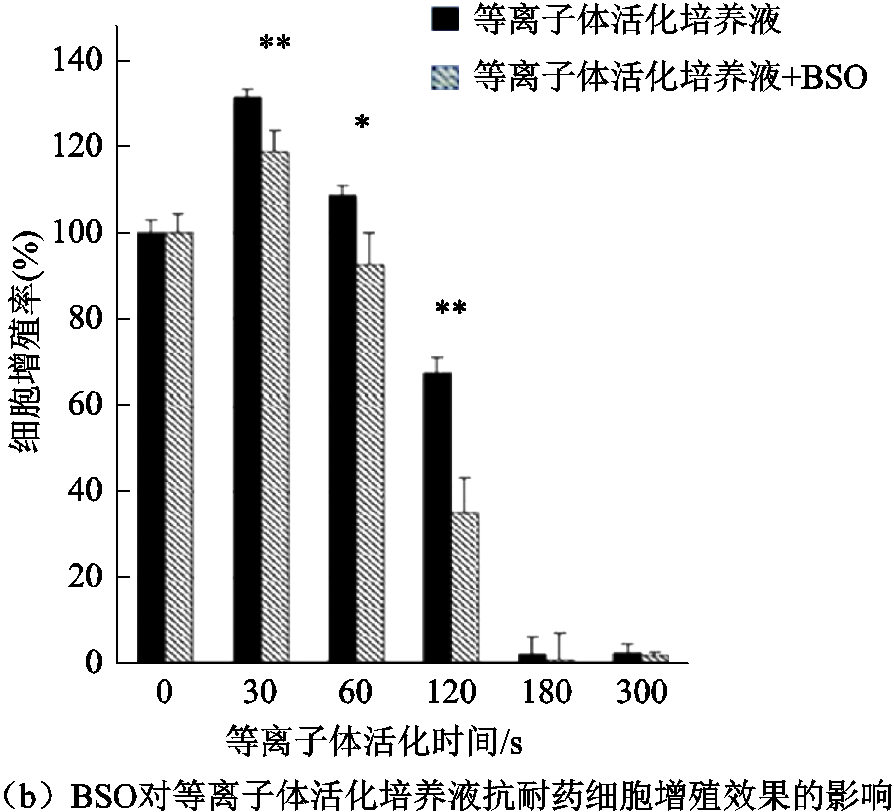
癌细胞对化疗药物产生的耐药性是导致临床治疗失败的重要原因之一。众所周知,化疗可以杀死对药物敏感的大多数癌细胞,但是留下的少量耐药细胞仍可以导致肿瘤复发甚至转移[64]。近期研究表明,PAS对耐药癌细胞也具有良好的杀灭效应。例如,F. Utsumi等发现等离子体活化培养液可以有效抑制紫杉醇/顺铂耐药性卵巢癌NOS2和NOS3细胞增殖,且在使用ROS清除剂(N-Acetyl Cysteine, NAC)对耐药癌细胞进行预孵育后会明显降低等离子体活化培养液的抗癌效应;而使用谷胱甘肽(细胞抗ROS氧化作用的功能分子)合成抑制剂(L-Buthionine-[S, R]-Sulfoximine, BSO)则会增强等离子体活化培养液的抗癌效应NAC及BSO对等离子体活化培养液抗癌效应的影响[23]如图5所示[23]。上述结果表明PAS诱导的胞内ROS压力是其灭活耐药癌细胞的关键所在,同时也为克服癌细胞耐药性这一临床难题提供了一条新途径。

2.3 PAS对3D肿瘤组织模型的抗癌效应研究
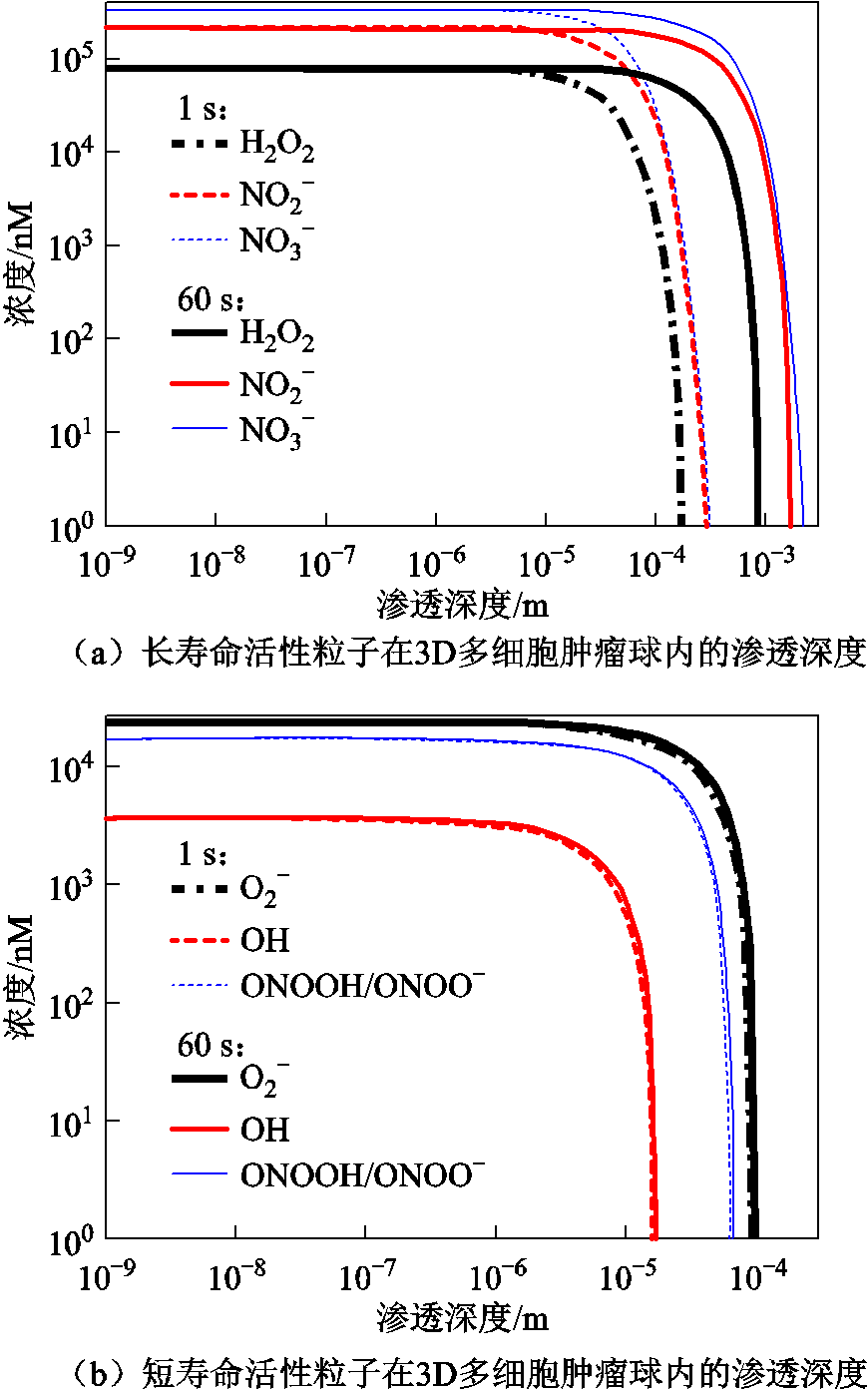
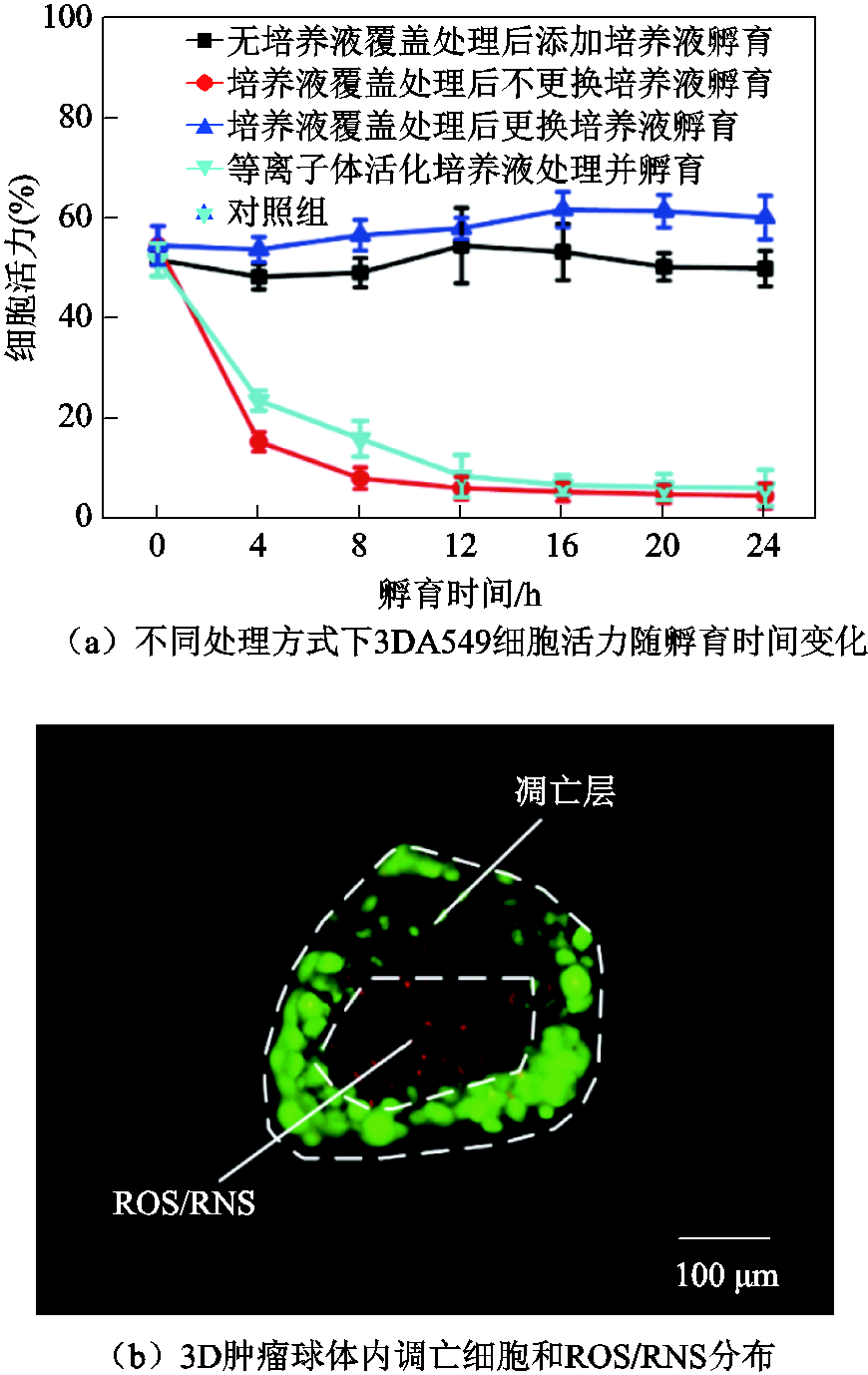
人体内的癌细胞通常以3D形态被邻近的细胞和胞外基质包围[65],其形态、功能和表型受到肿瘤微环境的调控[66]。而由于体外培养的2D癌细胞缺乏3D肿瘤中的细胞-基质和细胞-细胞相互作用[67],从而导致2D癌细胞无法精确地反映等离子体或PAS对肿瘤组织的实际抗癌效应[68-69];此外,由于2D癌细胞通常为单层结构,这也使得它无法用于活性粒子的渗透过程研究,而等离子体或PAS中活性粒子对肿瘤组织的渗透性及抗癌深度决定了其治疗范围,同时也是评估其抗癌效果的重要指标。相较于单层的2D癌细胞,体外构建的3D肿瘤组织模型则能够更好地复现体内肿瘤组织微环境和癌细胞的生物学特性[70-71],同时还可以用于等离子体活性粒子的渗透深度研究。基于此,体外3D肿瘤组织模型近期被尝试用于等离子体或PAS抗癌研究。其中,F. Judée等于2016年率先研究了等离子体活化培养液对HCT116结肠腺癌多细胞肿瘤球的遗传毒性和细胞毒性,以及活化培养液对3D多细胞肿瘤球最外层细胞和内部区域的穿透作用[72];E. Griseti等发现脉冲电场处理可以显著增强等离子体活化磷酸盐缓冲溶液在3D结直肠癌多细胞肿瘤球中的细胞毒性[73];J. Chauvin等对比了相同剂量等离子体活化培养液在2D细胞培养模型和3D肿瘤球中诱导的细胞毒性,发现其对3D癌细胞的毒性作用明显低于2D癌细胞[74]。笔者课题组通过对比等离子体直接处理与等离子体活化培养液处理的3D癌细胞活力变化,发现两种方式的抗癌效果基本相同。等离子体和PAS对3D肺癌肿瘤球的抗癌效应[75,78]如图6a所示,图6a表明等离子体对3D多细胞肿瘤球的抗癌效应主要通过培养液中的活性粒子来实现[75]。目前多数研究认为等离子体产生的活性粒子最多在生物组织中渗透几十微米[76-77]。笔者课题组通过研究等离子体射流处理的3D多细胞肿瘤球凋亡深度和ROS渗透深度,发现等离子体产生的液相ROS可以渗透进整个3D肿瘤球(直径约350 μm),但仅在肿瘤球最外层观察到局部凋亡,凋亡的平均深度约为130 μm(见图6b)[78]。
为了进一步探究液相活性粒子对3D肿瘤组织的渗透机制,笔者课题组通过仿真模型分析了几种主要活性粒子(H2O2、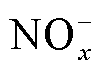 、
、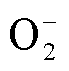 、OH·等)在肿瘤组织模型中的渗透规律[78]。仿真结果表明,H2O2、
、OH·等)在肿瘤组织模型中的渗透规律[78]。仿真结果表明,H2O2、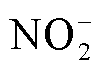 和
和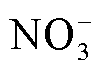 等长寿命活性粒子对肿瘤球的渗透深度在1 s内可超过100 μm,60 s后可达1 mm;而ONOOH/ONOO-、
等长寿命活性粒子对肿瘤球的渗透深度在1 s内可超过100 μm,60 s后可达1 mm;而ONOOH/ONOO-、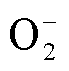 、OH等短寿命活性粒子在60 s内的渗透深度却不足100 μm。仿真分析液相活性粒子对3D肿瘤球的渗透规律[78]如图7所示。通过将癌细胞凋亡深度和仿真得到的活性粒子渗透深度进行对比,可以得出等离子体产生的长寿命液相活性粒子在深层抗癌过程中起到主要作用。此外,等离子体活化培养液中活性粒子对3D肿瘤组织的渗透效率可通过联合热疗进行提升。笔者课题组的最新研究结果表明43℃同步热疗可以有效促进等离子体活化培养液中的ROS/RNS向3D多细胞肿瘤球中渗透,从而增强等离子体活化培养液的抗癌效果[79]。
、OH等短寿命活性粒子在60 s内的渗透深度却不足100 μm。仿真分析液相活性粒子对3D肿瘤球的渗透规律[78]如图7所示。通过将癌细胞凋亡深度和仿真得到的活性粒子渗透深度进行对比,可以得出等离子体产生的长寿命液相活性粒子在深层抗癌过程中起到主要作用。此外,等离子体活化培养液中活性粒子对3D肿瘤组织的渗透效率可通过联合热疗进行提升。笔者课题组的最新研究结果表明43℃同步热疗可以有效促进等离子体活化培养液中的ROS/RNS向3D多细胞肿瘤球中渗透,从而增强等离子体活化培养液的抗癌效果[79]。
2.4 PAS的抗癌机制研究
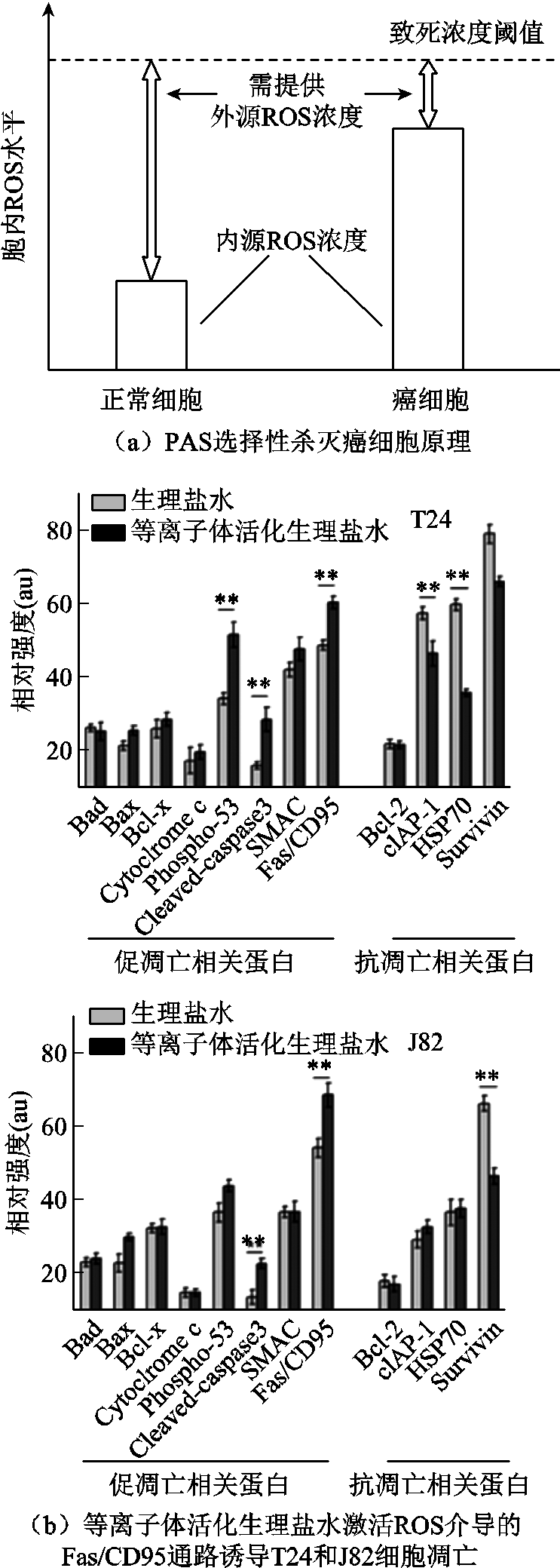
众所周知,癌细胞在实现快速增殖的过程中,由于新陈代谢异常活跃,会产生大量的ROS等副产物,导致癌细胞内源ROS浓度远高于正常细胞[80-82],而过量的ROS会引起细胞氧化损伤,并进一步诱导程序性细胞死亡[83]。PAS能够实现对癌细胞的选择性灭活,正是基于癌细胞与正常细胞的内源ROS浓度差异[84]。这就使得只需要注入少剂量PAS提供的外源活性粒子就可以让癌细胞率先达到致死阈值,而正常细胞仍处于耐受水平[85-86],如图8a所示。研究表明PAS中的活性粒子主要通过以下两种方式诱导癌细胞程序性死亡:
1)氧化损伤细胞内的DNA、RNA、蛋白酶、生物膜等功能大分子,削弱其生理功能甚至使其失活,引发癌细胞代谢紊乱并死亡。大量研究发现,PAS中的活性粒子可渗透进入细胞,破坏细胞内氧化还原平衡,引起DNA[87]、蛋白酶[88]、细胞膜及内膜系统上的功能分子发生氧化损伤[89],这些功能分子的生物活性大幅下降,进而引发细胞内基因表达、信号传导、新陈代谢等发生紊乱,甚至在癌细胞内引发正反馈,产生更多的胞内ROS,使细胞无法完成最基本的生命活动而死亡。例如:华中科技大学卢新培教授课题组发现,等离子体产生的液相活性粒子作用癌细胞后,会导致GSH/GSSG比值、NADPH/ NADP+比值和超氧化物歧化酶(SOD)含量下降,胞内ROS含量显著上升,细胞内部硝化蛋白含量增加、蛋白质羰基水平上升,进而引起细胞内抗氧化系统受损[88]。
2)激活细胞程序性死亡通路,诱导癌细胞凋亡、自噬、坏死和焦亡等。大量研究证实PAS中的活性粒子可直接或间接激活多条凋亡通路,例如:基于肿瘤坏死因子受体(TNFR)的凋亡通路[90]、细胞色素c介导的线粒体凋亡通路[84]、ROS介导的Fas/CD95通路等[87],通过一系列凋亡相关基因的激活、表达与调控,诱导细胞主动、不可逆地发生程序性死亡。例如:笔者课题组使用30%体积比的等离子体活化生理盐水处理T24和J82膀胱癌细胞,发现能有效提高两种癌细胞内的ROS水平并造成氧化损伤,最终通过激活ROS介导的Fas/CD95通路诱导癌细胞凋亡,PAS抗癌的生物学机制[87]等离子体活化生理盐水激活ROS介导的Fas/CD95通路诱导T24和J82细胞凋亡如图8b所示。
3 等离子体活化水溶液用于活体抗癌研究
相较于等离子体仅能处理病灶组织表面,PAS可以作用一种液体药剂,通过局部注射、腔内灌注、创面冲洗等方式来进行深层肿瘤治疗。目前PAS活体抗癌应用主要包括癌旁注射和腔内灌注两种方式,肿瘤创面冲洗相关研究较少。其中癌旁注射主要用于组织深层的实体瘤治疗研究,而腔内灌注则用于腹腔、膀胱等腔内肿瘤的治疗。此外,PAS的生物安全性也是活体抗癌研究的关键科学问题之一。
3.1 PAS用于癌旁注射的抗癌效应研究
研究表明人体皮肤组织对PAS中活性粒子的渗透都有很强的阻碍作用,仅表皮最外层的角质层就可以阻挡OH、1O2、O3等活性粒子渗透进皮肤组织[91-92]。因此,需要借助一定的外科手段将PAS直接输送到组织深层中的病灶部位。而PAS作为一种液体药剂,可通过局部注射实现深层给药。笔者课题组前期研究结果表明癌旁注射表面放电等离子体活化的生理盐水可有效抑制裸鼠皮下肌肉浸润型T24和J82膀胱肿瘤的生长,癌旁注射等离子体活化生理盐水对小鼠体内膀胱肿瘤的治疗效果如图9a所示[87];F. Utsumi等在获得等离子体活化培养液对体外耐药癌细胞增殖抑制效果的基础上,进一步探究了局部注射等离子体活化培养液对小鼠皮下耐药性肿瘤的抗癌效应,发现这种癌旁注射的给药方式可以显著抑制耐药肿瘤的生长,而且并没有观察到小鼠产生过敏反应和皮肤坏死等并发症,癌旁注射等离子体活化培养液对小鼠体内耐药性肿瘤的治疗效果如图9b所示[23];西安交通大学张冠军教授课题组同样采用癌旁注射方式,将不同强度的等离子体活化生理盐水注射到小鼠皮下黑色素瘤组织中,发现活化时间超过4 min的等离子体活化生理盐水会导致肿瘤结节溃烂,然后在大约一周后结痂脱落[93]。上述研究结果表明癌旁注射PAS有望克服等离子体渗透和作用深度有限这一关键科学难题,实现对深层肿瘤病灶的精准治疗。此外,PAS癌旁注射也可以与传统的化疗手段结合起来,以实现协同抗癌效果;例如,F. Saadati等发现等离子体活化培养液联合化疗药物对小鼠体内肿瘤的治疗效果要远好于使用单一方法的治疗效果[94]。这种联合治疗手段不仅降低了药物的副作用和剂量,而且没有观察到等离子体活化培养液和化疗药物之间的互相干扰。
3.2 PAS用于腔内灌注的抗癌效应研究
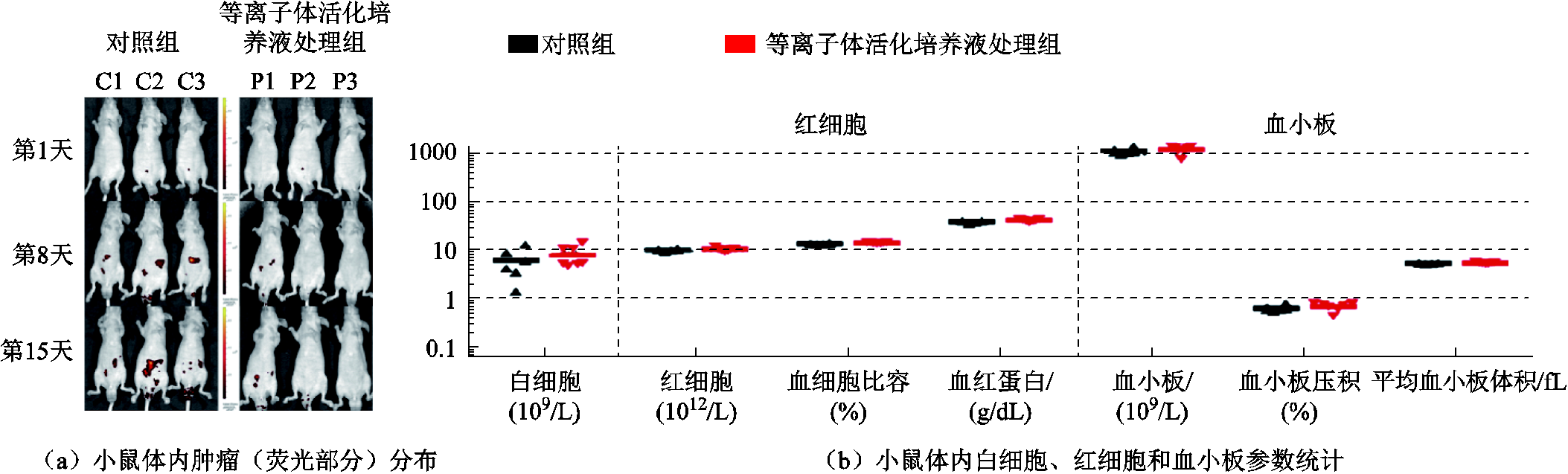
对于膀胱癌、胃癌、结直肠癌等腔内肿瘤,临床上常采用含有大量抗癌药物的液体药剂进行灌注治疗。而作为一种具有优异选择性抗癌效应的液体药剂,PAS在腔内肿瘤的治疗中也具有广阔的应用前景。例如,S. Takeda等在2017年率先采用腹腔注射等离子体活化培养液的方式治疗小鼠胃癌,发现这种治疗方法可使小鼠腹腔内肿瘤转移结节形成减少60%,腹腔灌注PAS后小鼠体内肿瘤分布及血液参数变化[24,95]如图10a所示,且在小鼠身上没有观察到明显的不良反应[24];接着K. R. Liedtke等发现腹腔注射等离子体活化培养液能够抑制小鼠体内胰腺癌肿瘤的生长速度,提高小鼠的中位生存期,并且灌注处理后小鼠内皮细胞或血浆中不同细胞因子的浓度以及各种血液学参数的分布保持不变(见图10b)[95]。上述研究结果初步证实了PAS用于腔内肿瘤灌注治疗的巨大潜力,且相对于癌旁注射治疗来讲,腔内灌注治疗对周围组织的影响更小,安全性也更高。
3.3 PAS活体应用的生物安全性
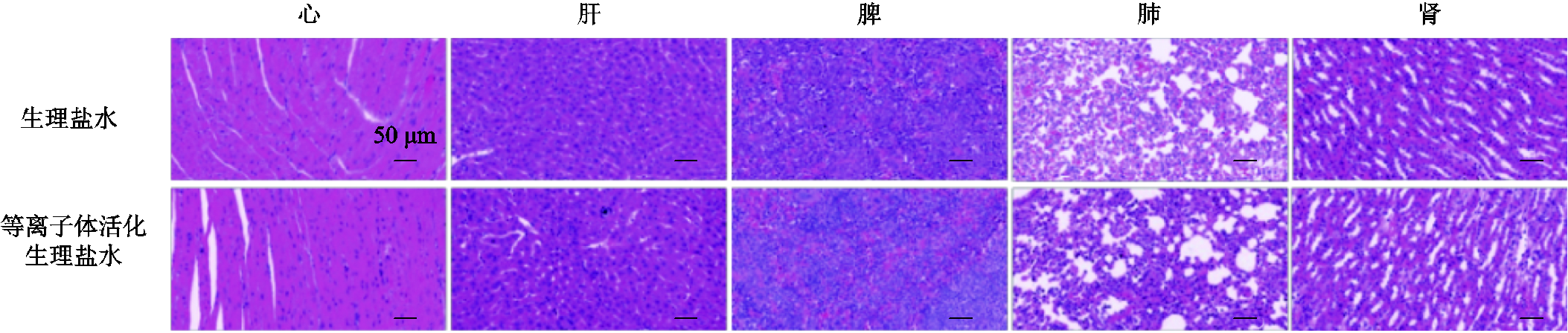
生物安全性评价是指治疗药物在进入临床应用前需要对其潜在毒性和安全剂量做出详细的评估,以确保有效治疗相关疾病的同时保证对人体的安全性。临床和实验研究中常通过监测患者/实验动物的血常规水平、组织病理切片等指标来开展药物的安全性分析。笔者课题组近期使用BLAB/c裸鼠作为动物模型,对免疫缺陷条件下黑色素瘤内注射等离子体活化生理盐水的生物安全性进行了详细研究[96]。经过连续17天的皮下局部注射(注射2~3次/天,注射100 µL/次),对裸鼠主要脏器器官和血液生化指标等进行了分析研究。结果表明连续的等离子体生理盐水皮下局部注射并不会引起裸鼠的心、肝、脾、肺、肾等主要器官病理损伤(见图11),同时对小鼠血液生化指标同样也没有显著影响。这些结果有效地证实了等离子体活化生理盐水活体应用的生物安全性。另外,笔者课题组还通过连续2周将PAS注入小鼠口腔进行口腔灌洗以评估活化水的安全性。结果表明,长期PAS口腔灌洗对小鼠体重和存活状态无明显影响,主要器官的脏器系数和组织结构均无明显变化,生化指标中的肝功能、肾功能、电解质、葡萄糖代谢和脂质代谢也都处于正常水平[97]。此外,V. Nastasa等在90天内将等离子体活化水或自来水作为小鼠的唯一饮用水源,进一步评估了等离子体活化水的长期毒性[98];他们在整个实验期间未观察到小鼠身上产生任何不良反应,其器官和组织的组织病理学检查也没有发现任何结构变化和癌变,这一研究结果进一步表明长期接触等离子体活化水不会产生毒性作用。然而目前尚无关于PAS临床应用的生物安全性研究报道,虽然合适剂量的PAS应用于小鼠是安全的,但由于种属差异的存在,其用于人体的生物安全性仍需要通过未来的临床实验进一步研究后才可得知。
4 结论
近10年来,PAS展现出良好的抗癌应用潜力,受到了广泛关注。研究表明,PAS主要通过液相活性粒子实现选择性的抗癌效应,而等离子体类型、水溶液种类以及活化处理方式则直接决定着液相活性粒子的成分和含量。体外抗癌实验发现,PAS可以高效地杀灭多种癌细胞,甚至耐药癌细胞和3D肿瘤球;PAS中的液相活性粒子通过破坏癌细胞内的氧化还原稳态,进而引起功能分子氧化损伤以及程序性细胞死亡。在活体抗癌研究方面,PAS常作为一种液体药剂被用于癌旁注射、腔内灌注和创面冲洗治疗等,初步的动物实验结果表明PAS具有良好的活体抗癌效应和生物安全性。
目前,PAS用于癌症治疗的研究方兴未艾,应用前景广阔,但仍有大量工作有待进一步深化,包括:
1)科学层面的抗癌机制探索。例如,近几年的研究表明有多种活性粒子共同参与了PAS的选择性抗癌作用,但由于目前实验技术水平有限,仅能对少数几种液相活性粒子进行检测,因此PAS选择性抗癌作用的关键活性粒子及其生物学机制尚未确定。
2)技术层面的抗癌效应提升。例如,未来可对PAS的温度、pH、氧化还原电位、关键活性粒子含量等重要参数进行精确调控,同时对注射、灌注、冲洗等PAS应用方式进行优化升级,以保证抗癌效应提升的同时减少对人体正常细胞或组织的不利影响。
3)应用层面的治疗范围拓展。例如,临床治疗中面对的癌症种类及其进展程度复杂多变,尽管PAS的选择性抗癌作用已在多种细胞上得以证实,但最大限度地拓展PAS抗癌范围使之满足不同癌症患者的治疗需求,对进一步释放其癌症治疗潜力具有重要意义。
4)交叉层面的联合应用优化。例如,PAS对耐药癌细胞也具有良好的灭活作用,基于这一优势,未来可开展PAS与传统抗癌药物的联合治疗研究,利用PAS对长期用药后产生的耐药癌细胞进行选择性杀灭,进而实现更好的治疗效果。
本文虽然只针对PAS的癌症治疗进行综述,但理论和方法可为感染性疾病治疗等其他医学应用提供重要参考。
参考文献
[1] Sung H, Ferlay J, Siegel R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: A Cancer Journal for Clinicians, 2021, 71(3): 209-249.
[2] Chen Wanqing, Zheng Rongshou, Baade P D, et al. Cancer statistics in China, 2015[J]. CA: A Cancer Journal for Clinicians, 2016, 66(2): 115-132.
[3] Bruheim K, Guren M G, Skovlund E, et al. Late side effects and quality of life after radiotherapy for rectal cancer[J]. International Journal of Radiation Oncology Biology Physics, 2010, 76(4): 1005-1011.
[4] Monsuez J J, Charniot J C, Vignat N, et al. Cardiac side-effects of cancer chemotherapy[J]. International Journal of Cardiology, 2010, 144(1): 3-15.
[5] Lu X, Naidis G V, Laroussi M, et al. Guided ionization waves: theory and experiments[J]. Physics Reports, 2014, 540(3): 123-166.
[6] Kong M G, Kroesen G, Morfill G, et al. Plasma medicine: an introductory review[J]. New Journal of Physics, 2009, 11(11): 115012.
[7] 王瑞雪, 李忠文, 虎攀, 等. 低温等离子体化学毒剂洗消技术研究进展[J]. 电工技术学报, 2021, 36(13): 2767-2781. Wang Ruixue, Li Zhongwen, Hu Pan, et al. Review of research progress of plasma chemical warfare agents degradation[J]. Transactions of China Electrotechnical Society, 2021, 36(13): 2767-2781.
[8] 夏文杰, 刘定新. Ar等离子体射流处理乙醇水溶液的放电特性及灭菌效应[J]. 电工技术学报, 2021, 36(4): 765-776. Xia Wenjie, Liu Dingxin. Discharge characteristics and bactericidal effect of Ar plasma jet treating ethanol aqueous solution[J]. Transactions of China Electrotechnical Society, 2021, 36(4): 765-776.
[9] Zhang Xianhui, Li Maojin, Zhou Rouli, et al. Ablation of liver cancer cells in vitro by a plasma needle[J]. Applied Physics Letters, 2008, 93(2): 021502.
[10] Majumdar A, Ummanni R, Schröder K, et al. Cancer cells (MCF-7, Colo-357, and LNCaP) viability on amorphous hydrogenated carbon nitride film deposited by dielectric barrier discharge plasma[J]. Journal of Applied Physics, 2009, 106(3): 034702.1-034702.5.
[11] Ma Yonghao, Ha C S, Hwang S W, et al. Non-thermal atmospheric pressure plasma preferentially induces apoptosis in p53-mutated cancer cells by activating ROS stress-response pathways[J]. PLoS One, 2014, 9(4): e91947.
[12] Guerrero-Preston R, Ogawa T, Uemura M, et al. Cold atmospheric plasma treatment selectively targets head and neck squamous cell carcinoma cells[J]. International Journal of Molecular Medicine, 2014, 34(4): 941-946.
[13] Duan J, Lu X, He G. The selective effect of plasma activated medium in an in vitro co-culture of liver cancer and normal cells[J]. Journal of Applied Physics, 2017, 121(1): 013302.1-013302.6.
[14] Ratovitski E A, Cheng Xiaoqian, Yan Dayun, et al. Anti-cancer therapies of 21st century: novel approach to treat human cancers using cold atmospheric plasma[J]. Plasma Processes and Polymers, 2014, 11(12): 1128-1137.
[15] Schlegel J, Köritzer J, Boxhammer V. Plasma in cancer treatment[J]. Clinical Plasma Medicine, 2013, 1(2): 2-7.
[16] 刘定新, 何桐桐, 张浩. 等离子体对人体组织的渗透作用: 研究现状与前沿问题[J]. 高电压技术, 2019, 45(7): 2329-2342. Liu Dingxin, He Tongtong, Zhang Hao. Penetration effect of gas plasmas on human tissues: state-of-the-art and current issues[J]. High Voltage Engineering, 2019, 45(7): 2329-2342.
[17] Chen C, Liu D X, Liu Z C, et al. A model of plasma-biofilm and plasma-tissue interactions at ambient pressure[J]. Plasma Chemistry and Plasma Processing, 2014, 34(3): 403-441.
[18] Norberg S A, Tian Wei, Johnsen E, et al. Atmospheric pressure plasma jets interacting with liquid covered tissue: touching and not-touching the liquid[J]. Journal of Physics D: Applied Physics, 2014, 47(47): 475203.
[19] Tanaka H, Mizuno M, Ishikawa K, et al. Plasma-activated medium selectively kills glioblastoma brain tumor cells by down-regulating a survival signaling molecule, AKT kinase[J]. Plasma Medicine, 2011, 1(3/4): 265-277.
[20] Nakamura K, Peng Yang, Utsumi F, et al. Novel intraperitoneal treatment with non-thermal plasma-activated medium inhibits metastatic potential of ovarian cancer cells[J]. Scientific Reports, 2017, 7(1): 1-14.
[21] Mohades S, Laroussi M, Sears J, et al. Evaluation of the effects of a plasma activated medium on cancer cells[J]. Physics of Plasmas, 2015, 22(12): 122001.
[22] Adachi T, Tanaka H, Nonomura S, et al. Plasma-activated medium induces A549 cell injury via a spiral apoptotic cascade involving the mitochondrial–nuclear network[J]. Free Radical Biology and Medicine, 2015, 79: 28-44.
[23] Utsumi F, Kajiyama H, Nakamura K, et al. Effect of indirect nonequilibrium atmospheric pressure plasma on anti-proliferative activity against chronic chemo-resistant ovarian cancer cells in vitro and in vivo[J]. PLoS One, 2013, 8(12): e81576.
[24] Takeda S, Yamada S, Hattori N, et al. Intraperitoneal administration of plasma-activated medium: proposal of a novel treatment option for peritoneal metastasis from gastric cancer[J]. Annals of Surgical Oncology, 2017, 24(5): 1188-1194.
[25] Kumar K N, Bhagirath G, Ying L, et al. Biological and medical application of plasma-activated media, water and solutions[J]. Biological Chemistry, 2018, 400(1): 39-62.
[26] Keidar M, Yan Dayun, Sherman J H. Indirect CAP treamtent, the application of the cold atmospheric plasma-activated solutions in cancer treatment[M]// Cold Plasma Cancer Therapy: Morgan & Claypool Publishers, 2019: 6-1-6-11.
[27] 戴栋, 宁文军, 邵涛. 大气压低温等离子体的研究现状与发展趋势[J]. 电工技术学报, 2017, 32(20): 1-9. Dai Dong, Ning Wenjun, Shao Tao. A review on the state of art and future trends of atmospheric pressure low temperature plasmas[J]. Transactions of China Electrotechnical Society, 2017, 32(20): 1-9.
[28] 章程, 邵涛, 龙凯华, 等. 大气压空气中纳秒脉冲介质阻挡放电均匀性的研究[J]. 电工技术学报, 2010, 25(1): 30-36. Zhang Cheng, Shao Tao, Long Kaihua, et al. Uniform of unipolar nanosecond pulse DBD in atmospheric air[J]. Transactions of China Electrotechnical Society, 2010, 25(1): 30-36.
[29] Ma Jie, Zhang Hao, Cheng Cheng, et al. Contribution of hydrogen peroxide to non-thermal atmospheric pressure plasma induced A549 lung cancer cell damage[J]. Plasma Processes and Polymers, 2017, 14(7): 1600162.
[30] Liu Z C, Liu D X, Chen C, et al. Physicochemical processes in the indirect interaction between surface air plasma and deionized water[J]. Journal of Physics D: Applied Physics, 2015, 48(49): 495201.
[31] Metelmann H R. Comprehensive clinical plasma medicine: cold physical plasma for medical application[M].
[32] Morfill G E, Shimizu T, Steffes B, et al. Nosocomial infections—a new approach towards preventive medicine using plasmas[J]. New Journal of Physics, 2009, 11(11): 115019.
[33] Liu D X, Liu Z C, Chen C, et al. Aqueous reactive species induced by a surface air discharge: heterogeneous mass transfer and liquid chemistry pathways[J]. Scientific Reports, 2016, 6(1): 1-11.
[34] 方志, 刘源, 蔡玲玲. 大气压氩等离子体射流的放电特性[J]. 高电压技术, 2012, 38(7):1613-1622. Fang Zhi, Liu Yuan, Cai Lingling. Discharge characteristics of atmosphere pressure plasma jet in Ar[J]. High Voltage Engineering, 2012, 38(7):1613-1622.
[35] 吴淑群, 聂兰兰, 卢新培. 大气压非平衡等离子体射流[J]. 高电压技术, 2015, 41(8): 2602-2624. Wu Shuqun, Nie Lanlan, Lu Xinpei. Atmospheric-pressure non-equilibrium plasma jets[J]. High Voltage Engineering, 2015, 41(8): 2602-2624.
[36] 许桂敏, 张冠军, 姚聪伟, 等. 大气压氩气等离子体射流在不同作用状态下的光电特性[J]. 高电压技术, 2019, 45(5): 1375-1386. Xu Guimin, Zhang Guanjun, Yao Congwei, et al. Optical and electrical characteristics of atmospheric pressure argon plasma jet under different interaction states[J]. High Voltage Engineering, 2019, 45(5): 1375-1386.
[37] 吴淑群, 董熙, 裴学凯, 等. 基于激光诱导荧光法诊断大气压低温等离子体射流中OH自由基和O原子的时空分布[J]. 电工技术学报, 2017, 32(8): 82-94. Wu Shuqun, Dong Xi, Pei Xuekai, et al. Laser induced fluorescence diagnostics of the temporal and spatial distribution of OH radicals and O atom in a low temperature plasma jet at atmospheric pressure[J]. Transactions of China Electrotechnical Society, 2017, 32(8): 82-94.
[38] Shashurin A, Shneider M N, Dogariu A, et al. Temporary-resolved measurement of electron density in small atmospheric plasmas[J]. Applied Physics Letters, 2010, 96(17): ): 171502.
[39] Xu Han, Chen Chen, Liu Dingxin, et al. Contrasting characteristics of aqueous reactive species induced by cross-field and linear-field plasma jets[J]. Journal of Physics D: Applied Physics, 2017, 50(24): 245201.
[40] Brisset J L, Moussa D, Doubla A, et al. Chemical reactivity of discharges and temporal post-discharges in plasma treatment of aqueous media: examples of gliding discharge treated solutions[J]. Industrial & Engineering Chemistry Research, 2008, 47(16): 5761-5781.
[41] 刘程, 张贵新, 王强, 等. 大气压微波等离子体处理有机废气的实验研究[J]. 高电压技术, 2017, 43(8): 2673-2679. Liu Cheng, Zhang Guixin, Wang Qiang, et al. Experimental study of organic waste gas treatment by microwave plasma generated at atmospheric pressure[J]. High Voltage Engineering, 2017, 43(8): 2673-2679.
[42] Chen Zeyu, Cui Qingjie, Chen Chen, et al. Inactivation of myeloma cancer cells by helium and argon plasma jets: the effect comparison and the key reactive species[J]. Physics of Plasmas, 2018, 25(2): 023508.
[43] Chen Zeyu, Liu Dingxin, Chen Chen, et al. Analysis of the production mechanism of H2O2 in water treated by helium DC plasma jets[J]. Journal of Physics D: Applied Physics, 2018, 51(32): 325201.
[44] Olszewski P, Li J F, Liu D X, et al. Optimizing the electrical excitation of an atmospheric pressure plasma advanced oxidation process[J]. Journal of Hazardous Materials, 2014, 279: 60-66.
[45] Chen Zhitong, Lin Li, Cheng Xiaoqian, et al. Effects of cold atmospheric plasma generated in deionized water in cell cancer therapy[J]. Plasma Processes and Polymers, 2016, 13(12): 1151-1156.
[46] Yu Xiaoying. Critical evaluation of rate constants and equilibrium constants of hydrogen peroxide photolysis in acidic aqueous solutions containing chloride ions[J]. Journal of Physical and Chemical Reference Data, 2004, 33: 747-763.
[47] Yu Xiaoying, Barker J R. Hydrogen peroxide photolysis in acidic aqueous solutions containing chloride ions. I. chemical mechanism[J]. The Journal of Physical Chemistry A, 2003, 107(9): 1313-1324.
[48] Liu Zhi chao, Guo Li, Liu Ding xin, et al. Chemical kinetics and reactive species in normal saline activated by a surface air discharge[J]. Plasma Processes and Polymers, 2017, 14(4/5): 1600113.
[49] Jirásek V, Lukeš P. Formation of reactive chlorine species in saline solution treated by non-equilibrium atmospheric pressure He/O2 plasma jet[J]. Plasma Sources Science and Technology, 2019, 28(3): 035015.
[50] Candeias L P, Patel K B, Stratford M R L, et al. Free hydroxyl radicals are formed on reaction between the neutrophil-derived species Superoxide anion and hypochlorous acid[J]. FEBS Letters, 1993, 333(1/2): 151-153.
[51] Chen Zhitong, Lin Li, Gjika E, et al. Selective treatment of pancreatic cancer cells by plasma-activated saline solutions[J]. IEEE Transactions on Radiation and Plasma Medical Sciences, 2018, 2(2): 116-120.
[52] Freund E, Liedtke K R, van der Linde J, et al. Physical plasma-treated saline promotes an immunogenic phenotype in CT26 colon cancer cells in vitro and in vivo[J]. Scientific Reports, 2019, 9: 634.
[53] Akkoc A, Celik H, Arslan N, et al. The effects of different environmental pH on healing of tympanic membrane: an experimental study[J]. European Archives of Oto-Rhino-Laryngology, 2016, 273(9): 2503-2508.
[54] Buxton G, Greenstock C, Helman W, et al. Critical Review of rate constants for reactions of hydrated electrons, hydrogen atoms and hydroxyl radicals (⋅OH/⋅O− in Aqueous Solution[J]. Journal of Physical and Chemical Reference Data, 1988, 17: 513-886.
[55] Van Boxem W, Van der Paal J, Gorbanev Y, et al. Anti-cancer capacity of plasma-treated PBS: effect of chemical composition on cancer cell cytotoxicity[J]. Scientific Reports, 2017, 7(1): 1-15.
[56] Boehm D, Heslin C, Cullen P J, et al. Cytotoxic and mutagenic potential of solutions exposed to cold atmospheric plasma[J]. Scientific Reports, 2016, 6(1): 1-14.
[57] Yan Dayun, Talbot A, Nourmohammadi N, et al. Principles of using cold atmospheric plasma stimulated media for cancer treatment[J]. Scientific Reports, 2015, 5(1): 1-17.
[58] Kurake N, Tanaka H, Ishikawa K, et al. Cell survival of glioblastoma grown in medium containing hydrogen peroxide and/or nitrite, or in plasma-activated medium[J]. Archives of Biochemistry and Biophysics, 2016, 605: 102-108.
[59] Anderson C E, Cha N R, Lindsay A D, et al. The role of interfacial reactions in determining plasma–liquid chemistry[J]. Plasma Chemistry and Plasma Processing, 2016, 36(6): 1393-1415.
[60] 孔刚玉, 刘定新. 气体等离子体与水溶液的相互作用研究: 意义、挑战与新进展[J]. 高电压技术, 2014, 40(10): 2956-2965. Kong Gangyu, Liu Dingxin. Researches on the interaction between gas plasmas and aqueous solutions: significance, challenges and new progresses[J]. High Voltage Engineering, 2014, 40(10): 2956-2965.
[61] Wang Zifeng, Xu Shengduo, Liu Dingxin, et al. An integrated device for preparation of plasma-activated media with bactericidal properties: an in vitro and in vivo study[J]. Contributions to Plasma Physics, 2022, 62(3): e202100125.
[62] Torii K, Yamada S, Nakamura K, et al. Effectiveness of plasma treatment on gastric cancer cells[J]. Gastric Cancer, 2015, 18(3): 635-643.
[63] Yan Dayun, Cui Haitao, Zhu Wei, et al. The specific vulnerabilities of cancer cells to the cold atmospheric plasma-stimulated solutions[J]. Scientific Reports, 2017, 7(1): 1-12.
[64] Steeg P S. Targeting metastasis[J]. Nature Reviews Cancer, 2016, 16(4): 201-218.
[65] Yamada K M, Cukierman E. Modeling tissue morphogenesis and cancer in 3D[J]. Cell, 2007, 130(4): 601-610.
[66] Abbott A. Biology’s new dimension[J]. Nature, 2003, 424(6951): 870-872.
[67] Lee J, Cuddihy M J, Kotov N A. Three-dimensional cell culture matrices: state of the art[J]. Tissue Engineering Part B: Reviews, 2008, 14(1): 61-86.
[68] Lee J, Lilly G D, Doty R C, et al. In vitro toxicity testing of nanoparticles in 3D cell culture[J]. Small, 2009: NA.
[69] Sowa M B, Chrisler W B, Zens K D, et al. Three-dimensional culture conditions lead to decreased radiation induced cytotoxicity in human mammary epithelial cells[J]. Fundamental and Molecular Mechanisms of Mutagenesis, 2010, 687(1/2): 78-83.
[70] Edmondson R, Broglie J J, Adcock A F, et al. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors[J]. Assay and Drug Development Technologies, 2014, 12(4): 207-218.
[71] Smalley K S M, Lioni M, Herlyn M. Life ins't flat: taking cancer biology to the next dimension[J]. In Vitro Cellular & Developmental Biology - Animal, 2006, 42(8): 242-247.
[72] Judée F, Fongia C, Ducommun B, et al. Short and long time effects of low temperature Plasma Activated Media on 3D multicellular tumor spheroids[J]. Scientific Reports, 2016, 6(1): 1-12.
[73] Griseti E, Kolosnjaj-Tabi J, Gibot L, et al. Pulsed electric field treatment enhances the cytotoxicity of plasma-activated liquids in a three-dimensional human colorectal cancer cell model[J]. Scientific Reports, 2019, 9: 7583.
[74] Chauvin J, Judée F, Merbahi N, et al. Effects of plasma activated medium on head and neck FaDu cancerous cells: comparison of 3D and 2D Response[J]. Anti-cancer Agents in Medicinal Chemistry, 2017, 18(6): 776-783.
[75] Zhang Jishen, Liu Dingxin, Zhang Hao, et al. Influence of liquid coverage on the anticancer effects of a helium plasma jet on 3D tumor spheroids[J]. Plasma Processes and Polymers, 2020, 17(7): 1900213.
[76] Szili E J, Al-Bataineh S A, Bryant P M, et al. Controlling the spatial distribution of polymer surface treatment using atmospheric-pressure microplasma jets[J]. Plasma Processes and Polymers, 2011, 8(1): 38-50.
[77] Desmet G, Michelmore A, Szili E J, et al. On the effects of atmospheric-pressure microplasma array treatment on polymer and biological materials[J]. RSC Advances, 2013, 3(32): 13437-13445.
[78] Zhang Hao, Zhang Jishen, Liu Zhijie, et al. Evaluation of the anticancer effects induced by cold atmospheric plasma in 2D and 3D cell-culture models[J]. Plasma Processes and Polymers, 2019, 16(12): 1900072.
[79] Zhang Hao, Zhang Jishen, Xu Shengduo, et al. Antitumor effects of hyperthermia with plasma-treated solutions on 3D bladder tumor spheroids[J]. Plasma Processes and Polymers, 2021, 18(10): 2100070.
[80] Trachootham D, Alexandre J, Huang Peng. Targeting cancer cells by ROS-mediated mechanisms: a radical therapeutic approach?[J]. Nature Reviews Drug Discovery, 2009, 8(7): 579-591.
[81] Wang Jie, Yi Jing. Cancer cell killing via ROS: to increase or decrease, that is the question[J]. Cancer Biology & Therapy, 2008, 7(12): 1875-1884.
[82] Cairns R A, Harris I S, Mak T W. Regulation of cancer cell metabolism[J]. Nature Reviews Cancer, 2011, 11(2): 85-95.
[83] Wu Defeng, Cederbaum A I. Alcohol, oxidative stress, and free radical damage[J]. Alcohol Research & Health: the Journal of the National Institute on Alcohol Abuse and Alcoholism, 2003, 27(4): 277-284.
[84] Graves D B. The emerging role of reactive oxygen and nitrogen species in redox biology and some implications for plasma applications to medicine and biology[J]. Journal of Physics D: Applied Physics, 2012, 45(26): 263001.
[85] Kalghatgi S, Kelly C M, Cerchar E, et al. Effects of non-thermal plasma on mammalian cells[J]. PLoS One, 2011, 6(1): e16270.
[86] 许德晖, 崔庆杰, 许宇静, 等. 等离子体医学及其在肿瘤治疗中的应用[J]. 生物化学与生物物理进展, 2017, 44(4): 279-292. Xu Dehui, Cui Qingjie, Xu Yujing, et al. Plasma medicine and the application in tumor therapy[J]. China Industrial Economics, 2017, 44(4): 279-292.
[87] Zhang Hao, Zhang Jishen, Guo Bo, et al. The antitumor effects of plasma-activated saline on muscle-invasive bladder cancer cells in vitro and in vivo demonstrate its feasibility as a potential therapeutic approach[J]. Cancers, 2021, 13(5): 1042.
[88] Zhao Shasha, Xiong Zilan, Mao Xiang, et al. Atmospheric pressure room temperature plasma jets facilitate oxidative and nitrative stress and lead to endoplasmic reticulum stress dependent apoptosis in HepG2 cells[J]. PLoS One, 2013, 8(8): e73665.
[89] Van der Paal J, Neyts E C, Verlackt C C W, et al. Effect of lipid peroxidation on membrane permeability of cancer and normal cells subjected to oxidative stress[J]. Chemical Science, 2016, 7(1): 489-498.
[90] Ishaq M, Kumar S, Varinli H, et al. Atmospheric gas plasma-induced ROS production activates TNF-ASK1 pathway for the induction of melanoma cancer cell apoptosis[J]. Molecular Biology of the Cell, 2014, 25(9): 1523-1531.
[91] Nie L, Duan J, Lu X. On the penetration depth of reactive oxygen and nitrogen species generated by a plasma jet through real biological tissue[J]. Clinical Plasma Medicine, 2018, 9: 32.
[92] Duan J, Gan L, Nie L, et al. On the penetration of reactive oxygen and nitrogen species generated by a plasma jet into and through mice skin with/without stratum corneum[J]. Physics of Plasmas, 2019, 26(4): 043504.
[93] Liu Jinren, Wu Yueming, Xu Guimin, et al. Low-temperature plasma induced melanoma apoptosis by triggering a p53/PIGs/caspase-dependent pathway in vivo and in vitro[J]. Journal of Physics D: Applied Physics, 2019, 52(31): 315204.
[94] Saadati F, Mahdikia H, Abbaszadeh H A, et al. Comparison of direct and indirect cold atmospheric-pressure plasma methods in the B16F10 melanoma cancer cells treatment[J]. Scientific Reports, 2018, 8(1): 1-15.
[95] Liedtke K R, Bekeschus S, Kaeding A, et al. Non-thermal plasma-treated solution demonstrates antitumor activity against pancreatic cancer cells in vitro and in vivo[J]. Scientific Reports, 2017, 7(1): 1-12.
[96] Qi Miao, Xu Dehui, Wang Shuai, et al. In vivo metabolic analysis of the anticancer effects of plasma-activated saline in three tumor animal models[J]. Biomedicines, 2022, 10(3): 528.
[97] Xu Dehui, Cui Qingjie, Xu Yujing, et al. Systemic study on the safety of immuno-deficient nude mice treated by atmospheric plasma-activated water[J]. Plasma Science and Technology, 2018, 20(4): 044003.
[98] Nastasa V, Pasca A S, Malancus R N, et al. Toxicity assessment of long-term exposure to non-thermal plasma activated water in mice[J]. International Journal of Molecular Sciences, 2021, 22(21): 11534.
Advances of Plasma-Activated Solutions for Cancer Therapy
Zhang Hao Zhang Jishen Xu Dehui Liu Dingxin Rong Mingzhe
(Center for Plasma Biomedicine Xi’an Jiaotong University Xi’an 710049 China)
Abstract Cold atmospheric plasma,as a new technology to efficiently generate exogenous reactive species, has great potential to become a safe and effective new method for cancer treatment. However, the direct plasma treatment of biological objects has several inherent limitations including shallow penetration depth and short effective time, which makes it difficult to completely release the application potential ofplasmas.Plasma-activated solutions (PAS), an indirect application form of cold atmospheric plasma,have the advantages of relatively long effective time, strong penetration ability, and large action range, which have been widely employed for emerging cancer therapies in recent years. In this paper,recent research advances in the plasma systems for preparing PAS, in vitro anticancer effects and biological mechanisms of PAS, and in vivo anticancer application and biosafety of PAS have been reviewed in detail.
Firstly, the preparation and regulation processes of PAS are summarized in terms of plasma discharge types, solutions types and activation methods. For the preparation of PAS in biomedical applications, the types of plasma include dielectric barrier discharge plasma, plasma jet, gliding arc discharge plasma and high-frequency (microwave, radiofrequency) discharge plasma; the types of solutions include deionized water, normal saline, phosphate buffer saline and cell culture medium; the activation methods include direct plasma activation and indirect plasma activation depending on whether plasma is in contact with solutions.The type of plasma discharge devices, the initial environment provided by different solutions and the choice of activation methods all determine the activation efficiency of plasma and affect the composition of reactive species in PAS.
Secondly, the in vitro anticancer research status of PAS is reviewed. In the PAS-enabled cancer treatment, cancer cells are generally treated by the plasma-activated cell culture medium or cell culture medium mixed with a volume of PAS. The in vitro anticancer cell models, including cancer cells, drug-resistant cancer cells and 3D tumor spheroids, are compared to fully evaluate the inactivation effect of PAS on cancer cells in different states. Further attempts to understand the PAS anticancer mechanisms are initialized: Cancer cells usually show higher levels of endogenous reactive oxygen species compared with normal cells, and the selective anticancer effects of PAS are achieved by supplying low-dose exogenous reactive species to cancer cells, which makes cancer cells to achieve the lethal threshold faster than normal cells.
Finally, the in vivo anticancer research status of PAS is reviewed. At present, the in vivo anticancer ways using PAS mainly include the pericarcinomatous tissue injection and intraluminal perfusion. The former is mainly selected for the treatment of solid tumors located in deep tissues, and intraluminal perfusion is mainly used for the treatment of tumor tissues located in the cavity (such as the peritoneal cavity, bladder, etc.). In addition, the long-term biosafety of PAS in mice has been confirmed, but there are no reports about the biosafety of PAS in clinical applications.
The researches of PAS cancer treatment are in the ascendant, and much work remains to be accomplished, including the exploration of insightful anticancer mechanisms, further improvements of anticancer effects, the expansion oftherapeutic scope and the optimization of combined therapies. This paper summarizes recent progresses in the PAS-enabled cancer therapy, and the corresponding theory and methods can provide an important reference for other medical application studies (such as infectious disease treatment).
Keywords:Cold atmospheric plasma, plasma-activated solutions, reactive species, cancer treatment
DOI: 10.19595/j.cnki.1000-6753.tces.L10091
中图分类号:TM8
国家自然科学基金资助项目(52277231)。
收稿日期 2023-01-08
改稿日期 2023-02-10
作者简介
张 浩 男,1990年生,副教授,博士生导师,研究方向为等离子体癌症和皮肤病治疗技术、等离子体与生物材料相互作用。E-mail:zhang216@mail.xjtu.edu.cn
刘定新 男,1982年生,教授,博士生导师,研究方向为放电等离子体理论与技术、等离子体生物医学技术、电器设备故障诊断技术。E-mail:liudingxin@mail.xjtu.edu.cn(通信作者)
(编辑 郭丽军)
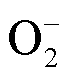 、H2O2、ONOOH、O2NOOH、
、H2O2、ONOOH、O2NOOH、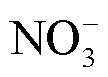 等[17-18]。这种等离子体辐照处理后的水溶液又被称为等离子体活化水溶液(Plasma-Activated Solutions, PAS)。从活性粒子层面来讲,由于PAS也能提供丰富的外源ROS和RNS,那么PAS是否像等离子体一样也具有良好的抗癌效应?为了验证这一猜想,H. Tanaka等早在2011年利用等离子体活化的培养液处理细胞,发现等离子体活化培养液可以选择性杀灭体外培养的恶性胶质瘤细胞[19];随后的大量研究也证实了PAS对卵巢癌细胞、膀胱癌细胞、肺癌细胞等多种癌细胞都具有高效灭活效应[20-22]。此外,F. Utsumi等在2013年率先开展了PAS活体抗癌研究,并发现癌旁注射等离子体活化培养液能够有效抑制裸鼠皮下卵巢瘤的生长[23];而S. Takeda等发现通过腹腔注射等离子体活化培养液后,可使小鼠腹膜肿瘤转移结节减少60%[24]。上述相关研究很好地回答了PAS抗癌“有效性”的问题,同时也为进一步开发等离子体癌症治疗技术提供了一条新思路。作为等离子体的一种间接应用形式,PAS可以采用局部注射、腔内灌注、创面冲洗等方式直接作用到组织深处的肿瘤病灶(见图1),这极大拓展了等离子体的抗癌作用深度和范围。另外,研究表明PAS中的部分长寿命活性粒子可存在数小时乃至几天[25],且低温保存一周的PAS仍具有一定的抗癌性能[22]。而且PAS制备与抗癌应用实现了完全分离,其治疗过程可以避免肿瘤组织形貌和电特性对等离子体放电的影响,在一定程度上保证了抗癌效果的稳定性。因此,PAS有望突破直接使用等离子体治疗癌症的诸多局限,进一步释放等离子体抗癌潜力,对PAS的研究已成为等离子体医学的热点方向之一。
等[17-18]。这种等离子体辐照处理后的水溶液又被称为等离子体活化水溶液(Plasma-Activated Solutions, PAS)。从活性粒子层面来讲,由于PAS也能提供丰富的外源ROS和RNS,那么PAS是否像等离子体一样也具有良好的抗癌效应?为了验证这一猜想,H. Tanaka等早在2011年利用等离子体活化的培养液处理细胞,发现等离子体活化培养液可以选择性杀灭体外培养的恶性胶质瘤细胞[19];随后的大量研究也证实了PAS对卵巢癌细胞、膀胱癌细胞、肺癌细胞等多种癌细胞都具有高效灭活效应[20-22]。此外,F. Utsumi等在2013年率先开展了PAS活体抗癌研究,并发现癌旁注射等离子体活化培养液能够有效抑制裸鼠皮下卵巢瘤的生长[23];而S. Takeda等发现通过腹腔注射等离子体活化培养液后,可使小鼠腹膜肿瘤转移结节减少60%[24]。上述相关研究很好地回答了PAS抗癌“有效性”的问题,同时也为进一步开发等离子体癌症治疗技术提供了一条新思路。作为等离子体的一种间接应用形式,PAS可以采用局部注射、腔内灌注、创面冲洗等方式直接作用到组织深处的肿瘤病灶(见图1),这极大拓展了等离子体的抗癌作用深度和范围。另外,研究表明PAS中的部分长寿命活性粒子可存在数小时乃至几天[25],且低温保存一周的PAS仍具有一定的抗癌性能[22]。而且PAS制备与抗癌应用实现了完全分离,其治疗过程可以避免肿瘤组织形貌和电特性对等离子体放电的影响,在一定程度上保证了抗癌效果的稳定性。因此,PAS有望突破直接使用等离子体治疗癌症的诸多局限,进一步释放等离子体抗癌潜力,对PAS的研究已成为等离子体医学的热点方向之一。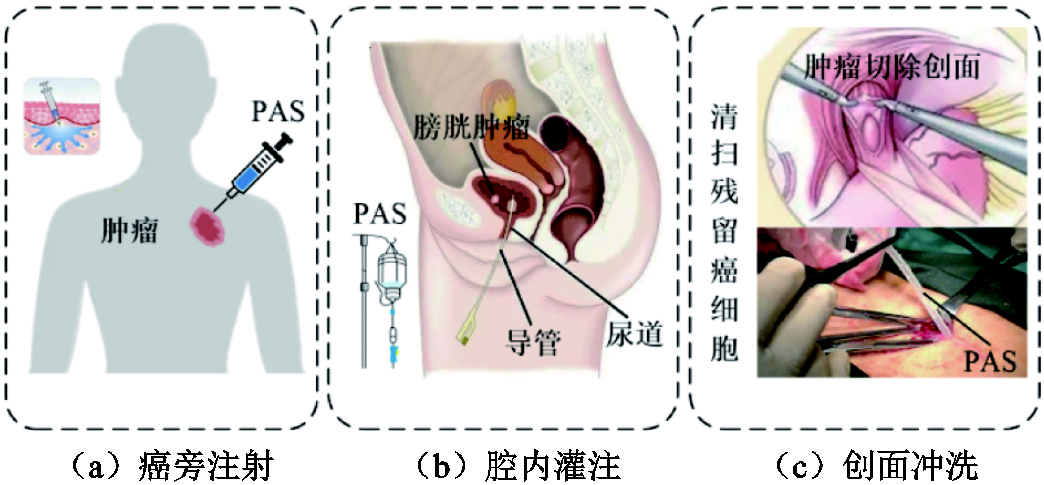

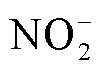 与
与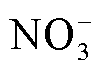 为主的ROS与RNS,且液相短寿命活性粒子可在溶液中原位产生
为主的ROS与RNS,且液相短寿命活性粒子可在溶液中原位产生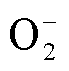 发生反应,产生OH自由基这一具有强氧化性的关键抗癌粒子,其反应速率高达7.5×10
发生反应,产生OH自由基这一具有强氧化性的关键抗癌粒子,其反应速率高达7.5×10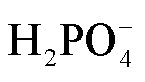 反应生成H
反应生成H


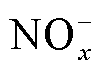 、
、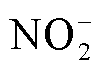 和
和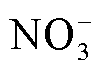 等长寿命活性粒子对肿瘤球的渗透深度在1 s内可超过100 μm,60 s后可达1 mm;而ONOOH/ONOO
等长寿命活性粒子对肿瘤球的渗透深度在1 s内可超过100 μm,60 s后可达1 mm;而ONOOH/ONOO