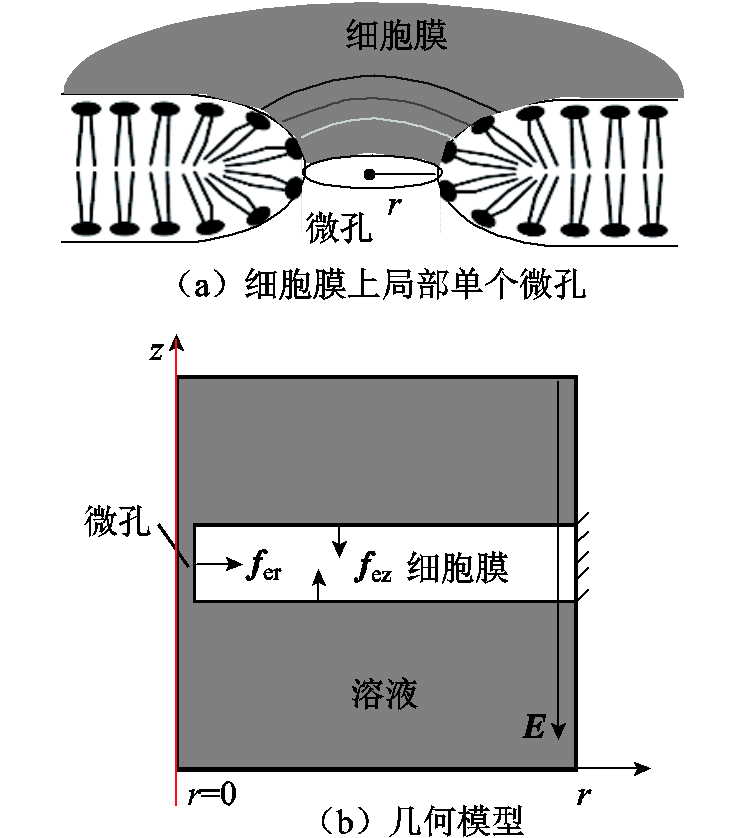
图1 仿真示意图
Fig.1 Simulation schematic diagram
摘要 为探究细胞膜的力学性能对电穿孔的影响,该文将细胞膜视为一种超弹性材料,在COMSOL中建立细胞膜上局部单个微孔的机电耦合模型,分析细胞膜弹性应变能对微孔形成的影响,并比较了细胞膜弹性模量不同时微孔形成过程的差异。结果表明,细胞膜的应变能一方面增大了从疏水孔向亲水孔转变时的越过能垒,并且膜弹性模量越大,越过能垒越大,且二者线性相关;另一方面,应变能的增加使微孔稳定,阻止微孔无限扩大,稳定尺寸与细胞膜力学性能和跨膜电位有关。该文通过仿真揭示了细胞膜的力学性能在电穿孔中的重要作用,并为研究细胞结构对电穿孔的影响机制提供了理论参考。
关键词:力学性能 电穿孔 机电耦合 应变能 微孔能量
细胞膜是由脂类和蛋白质构成的半透性膜,这种结构赋予了细胞膜非常特殊的机械性能。以人的红细胞为例,细胞膜是由磷脂双分子层、血影蛋白网络和膜蛋白组成[1]。膜中的脂质具有流动性,膜骨架蛋白对脂质双层起着支撑的作用。
最近几十年来,电场与生物膜的相互作用得到了广泛研究,如电穿孔。当外部电场作用于膜上,细胞膜会发生极化,当感应的跨膜电势达到临界值(0.5~1.0V)时[2-3],细胞膜会发生电击穿,即电穿孔。目前,已有许多理论及模型对电穿孔现象进行了阐述,普遍认可的是脂质双分子层的亲水孔模型。即完整的磷脂双层在热运动下先形成疏水孔间隙,当微孔超过某一临界尺寸时,由于疏水孔的脂质的重新定向转变为亲水孔,并基于成核理论,通过微孔形成引起的膜的自由能的变化描述微孔的发展[4]。
影响细胞膜电穿孔的因素有很多,如施加的电场、细胞所处溶液、细胞膜自身的材料特性[5-8]等。其中,细胞膜的力学性能在电穿孔过程中起着重要作用,已有学者对其进行了研究。I. van Uitert 等[9]研究了细胞膜组成的分子对微孔的形成和膜电稳定性的影响,包括磷脂、胆固醇及通道蛋白。G. L. Thompson等[10]假设肌动蛋白细胞骨架作为细胞弹性的主要贡献参数,其改变将会显著影响纳秒脉冲电场处理后细胞的存活率。A. Muralidharan等[11]将中国仓鼠卵巢细胞暴露于脉冲电场下,发现了肌动蛋白网络破坏的细胞增加了细胞膜的通透性。H. B. Kim等[12]通过实验证明了肌动蛋白细胞骨架通过微孔形态、膜硬度等细胞物理因素在电穿孔中发挥作用。
部分学者在仿真分析电穿孔时也考虑了细胞的力学性能。S. Sun等[13]通过分子动力学仿真分析了脂质膜的变形性对电穿孔的影响,结果表明,在其他条件不变的情况下,刚度较大的膜可以抑制电穿孔。但他们只是从原子水平上进行观察,而未能从细胞层面探究细胞膜的力学性能在电穿孔中的作用。W. Hoiles等[14-15]将细胞膜看作线性弹性连续体,从微孔能量角度说明其力学性能对微孔的影响,得出弹性应变能抑制水孔的扩大。这种最简单的线性弹性体并不能很好地描述细胞膜的弹性特性。Deng Peigang等[16-17]将细胞膜看作非线性弹性材料,通过Ansys建立了一个新的同时具有相变能和应变能的电穿孔模型,并得到细胞膜的应变能会阻止孔的无限增大。但是在建模过程中,只考虑了电场力,而忽略了微孔在形成过程中会受到其他力的作用。
为此,本文在前人研究的基础上,从仿真角度研究了电场下细胞膜的力学性能对微孔形成的影响。在COMSOL中将细胞膜视为超弹性材料,在电场下建立膜上单个微孔的机电耦合模型,并分析在微孔形成过程中由于细胞膜变形而产生的应变能对微孔能量的影响。此外,设置不同弹性模量的细胞膜,以比较细胞膜不同的力学性能对微孔形成的差异。
由于细胞膜是一种半透性膜,正常的细胞膜可以通过一些分子,如水分子,其直径约为0.4nm。因此假设细胞膜上预先存在小孔,其半径为0.2nm。以细胞膜上局部单个微孔为例,如图1a所示,圆柱形细胞膜中心有一个预先存在的微孔。为了简化建模,本文沿着半径方向建立二维轴对称几何模型,考虑圆柱形孔,如图1b所示:所研究的空间区域为50nm×50nm的正方形区域,其中,正方形灰色区域代表细胞膜附近的溶液,白色矩形代表细胞膜,细胞膜与旋转轴之间的狭窄区域代表预先存在的圆柱形微孔。fer和fez分别为孔边界和膜边界的应力密度,细胞膜是由许多磷脂和蛋白组成,两个相邻蛋白之间的距离约为100nm,所以膜边缘距中心的距离为50nm[16]。细胞膜厚度为10nm[18]。

图1 仿真示意图
Fig.1 Simulation schematic diagram
1.2.1 微孔在电场下的受力
对于上述的几何模型,外面的正方形灰色区域是细胞膜和孔附近的溶液,其相对介电常数εl=80[19],中间的白色矩形区域为细胞膜,其相对介电常数为εm=2[19]。
在正方形上下方向施加电场,区域剩余边界无电流通过。在电场下,细胞膜可看作是一种介电体,由于Maxwell-Wagner界面极化作用,会在细胞膜上感应出电场力[20]。可利用麦克斯韦应力张量法计算电场力,只考虑电场E时的麦克斯韦应力张量T可表示为
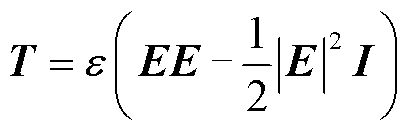 (1)
(1)
式中,I为单位向量。作用在表面的电场力密度f为
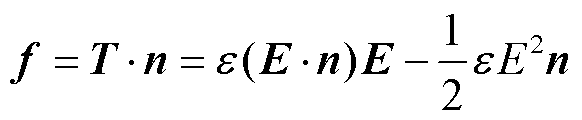 (2)
(2)
式中,n为法向分量。
在本模型中,由于细胞外溶液和细胞膜在电场下均会发生相互极化,在分界面两侧均会产生电场力,其方向如图1b中的箭头所示。须将这两侧的电场力矢量相加,才是边界上的净电场力。以孔边界上的净电场力密度fer为例说明计算过程,在边界上选取一狭小的矩形,如图2所示(下标l代表溶液,m代表细胞膜)。根据式(2),分界面两侧的电场力密度分别为
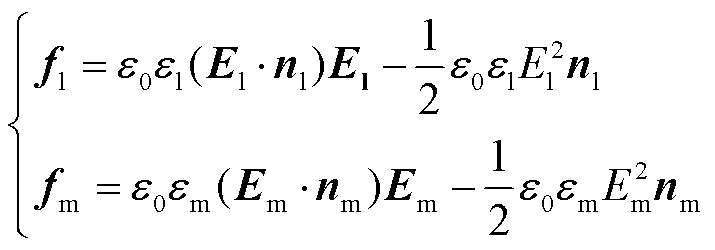 (3)
(3)
式中,ε0为真空介电常数,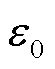 =8.85×10-12F/m;nm和nl为两侧的法向分量,净电场力的法向分量为n,其方向如图2所示,三者之间的关系为nm=-nl=n;分界面两侧的电场强度用法向和切向分量表示为El=Elnn+Eltt,Em=Emnn+Emtt,将分界面两侧的电场力矢量相加,孔边界上的净电场力密度fer为
=8.85×10-12F/m;nm和nl为两侧的法向分量,净电场力的法向分量为n,其方向如图2所示,三者之间的关系为nm=-nl=n;分界面两侧的电场强度用法向和切向分量表示为El=Elnn+Eltt,Em=Emnn+Emtt,将分界面两侧的电场力矢量相加,孔边界上的净电场力密度fer为
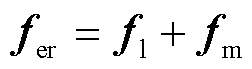 (4)
(4)
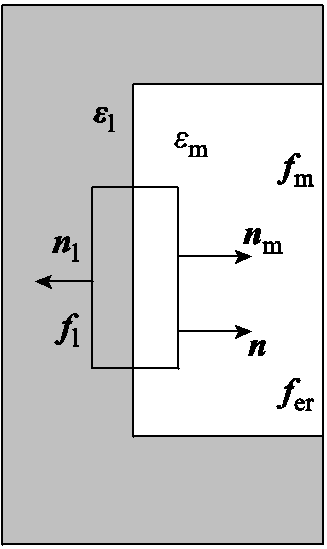
图2 孔边界电场力方向
Fig.2 Direction of electric field force at pore boundary
由于细胞膜和溶液介电常数的差异较大(80和2),在孔边界上,考虑边界条件Eln=Emn=0和Elt=Emt,即El=Em=Emtt,其电场力密度为
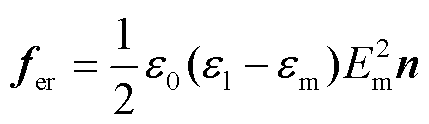 (5)
(5)
同样地,对于膜的上下边界,边界条件为εlEln=εmEmn,Elt=Emt=0,即El=Elnn,Em=Emnn,则其电应力密度为
 (6)
(6)
在没有外加电场时,微孔一般会受到线张力γ(使孔愈合的力)和表面张力σ(使膜扩张的力),对于半径为r的微孔,其受到的驱动力fne大小为[21] σ-γ/r。
当细胞处在电场中时,在考虑上述两个力的基础上考虑电场力,综合这三个力的共同作用,微孔边界上的受力示意图如图3所示。
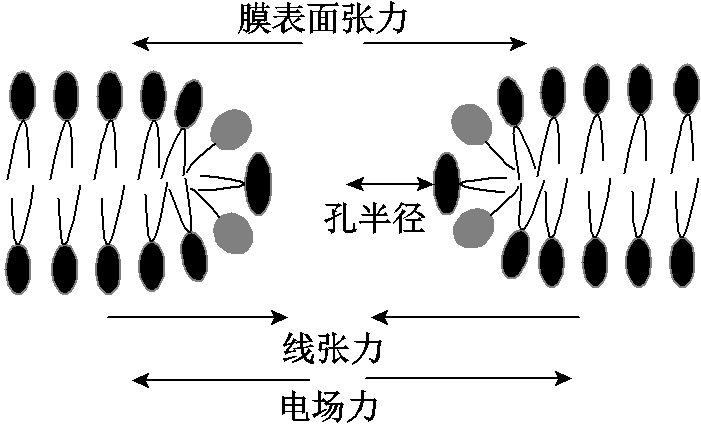
图3 微孔受力示意图分析[22]
Fig.3 Stress diagram of pore[22]
1.2.2 细胞膜受力变形
细胞膜通常会被视为弹性材料,但其具有随机取向的分子链网络结构,能够经历很大的非线性弹性变形,部分学者基于连续介质力学[23],采用连续的超弹性材料来模拟。本文同样将细胞膜视为超弹性材料,假设细胞膜是均质、各向同性和不可压缩的[24-25]。
用于描述细胞膜的超弹性模型形式很多,如Mooney-Rivlin模型、Neo-Hookean模型、Yeoh模型等,其中Mooney-Rivlin模型被广泛使用,其适用范围较大,精确度较高。对于Mooney-Rivlin模型,根据阶数高低,又可分为双参数、五参数、九参数,阶次越高,可以模拟更复杂的情况,但也需要更多的计算量,最终本文选取Mooney-Rivlin双参数模型,用应变能函数表示为[26]
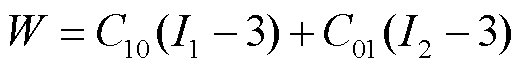 (7)
(7)
式中,W为应变能函数;I1、I2分别为左柯西格林变形张量的第一、第二应变不变量;C10和C01为材料参数(MPa),一般存在如下关系[24]:C10/C01≈0.1~0.2,EY=6(C10+C01),EY为弹性模量。
在本模型中,由于εl εm,则Em
εm,则Em El,结合式(5)和式(6)可知,fer
El,结合式(5)和式(6)可知,fer fez,即细胞膜上、下两边界的电场力相对于孔边界上的电场力很小,所以忽略细胞膜上、下边界沿着厚度方向的受力,只考虑孔边界上的受力,并将膜右侧边界固定。
fez,即细胞膜上、下两边界的电场力相对于孔边界上的电场力很小,所以忽略细胞膜上、下边界沿着厚度方向的受力,只考虑孔边界上的受力,并将膜右侧边界固定。
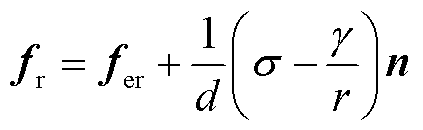 (8)
(8)
式中,n为法向分量;fr为孔边界上单位面积上的力;fer为电场力密度,其数值见式(5);d为细胞膜厚度,d=10nm;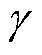 为线张力,
为线张力,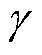 =1×10-12N;σ为表面张力,
=1×10-12N;σ为表面张力,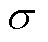 =5×10-3N/m [19]。
=5×10-3N/m [19]。
根据图1b在COMSOL Multiphysics建立二维轴对称几何模型,选用AC-DC模块和固体力学模块,电应力密度通过麦克斯韦应力张量法进行计算,并和线张力、表面张力添加到固体力学中的边界载荷中。采用自由三角形网格进行划分,剖分后的模型包含6 939个域单元和380个边界元。
改变外加直流激励,变化范围为[0.1V, 3.0V],可得到细胞膜及周围溶液上的电势、电场的分布、细胞膜在电场下随着边界载荷而变形的情况,以及微孔边界位移和细胞膜弹性应变能分别随外加电压变化的数据。导出微孔发生的位移及细胞膜弹性应变能的数据,并在Origin软件中绘图,可得到微孔发展过程中细胞膜应变能与微孔半径之间的关系。
为分析细胞膜材料参数对电穿孔的影响,设置不同的材料参数C10和C01。以C10a=0.437 5MPa,C01a=0.062 5MPa为基准,对应的细胞膜弹性模量数量级约为107dyn/cm2[24](1 dyn=10-5N)。细胞膜刚度较小时,对应的弹性模量较小,取C10b=C10a/3=0.145 8MPa,C01b=C01a/3=0.020 8MPa。细胞膜刚度较大时,对应的弹性模量较大,取C10c=3C10a=1.312 5MPa,C01c= 3C01a=0.187 5MPa。比较在这三种情况下对微孔形成的影响。
以细胞膜材料参数C10a=0.4375MPa,C01a= 0.062 5MPa为例分析其对微孔形成的影响。
当外加电压增大时,细胞膜会发生变形,微孔会扩大,在这一过程中,微孔不会无限制地扩大,直到与变形膜中产生的应力平衡时为止。假设电穿孔的阈值为0.8V,区域内的电势及电场分布如图4所示。从电势分布图可以看出,外加激励相当于细胞膜两侧电压,即跨膜电压。从电场分布图可以看出,细胞膜内部和孔区域附近电场强度(≈7.3×107V/m)比细胞膜周围溶液(≈1.8×106V/m)大。

图4 电势和电场强度分布
Fig.4 Distribution of electric potential and electric field
电场与细胞膜的机械响应互相耦合,电场的分布和细胞膜变形互相影响。在孔边界上的电场分布不同导致沿着孔边界上的电应力不同,其结果是电场力密度在孔边界上下两端的值较小,在边界中间区域值较大,如图5a所示。再考虑表面张力和线张力,孔边界上受到的合力大小如图5b所示,可以看出应力的大小在边界上是分布不均匀的。
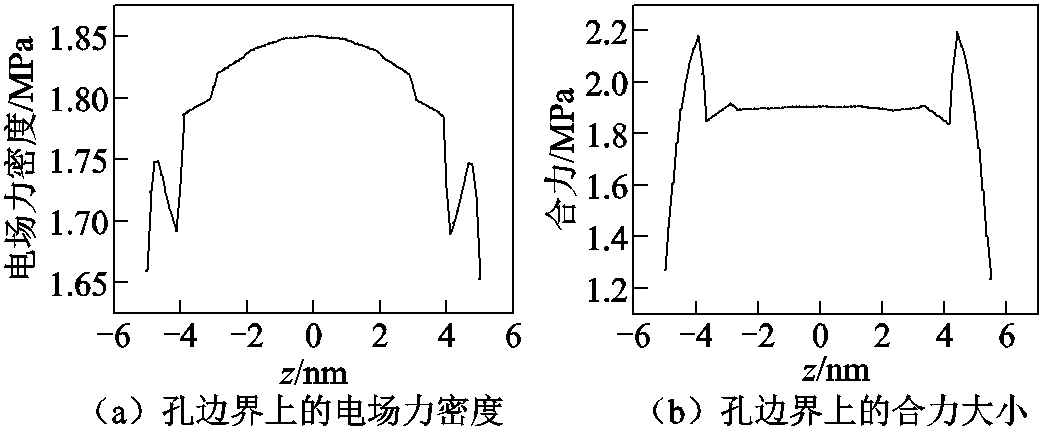
图5 孔边界上的电应力和合力分布
Fig.5 Distribution of the electrical stress and total force on the pore boundary
细胞膜是一种柔软的弹性材料,在力的作用下会发生变形,其二维、三维变形情况如图6所示,微孔边界上的受力方向如图6a中的箭头所示,箭头的长短能够相对表示不同位置处的受力大小。图6b和图6c表示微孔边界上的电场力和应力,从颜色的深浅也可看出微孔不同位置处的受力大小,在中间区域受力较大,上下区域受力较小。而且,从图6b和图6c中的放大图可以看出,合力的作用效果是使膜沿着径向方向压缩、微孔会扩大,并且膜在孔周围的局部挤压过程使微孔的形态像火山口。

图6 细胞膜变形情况
Fig.6 Cell membrane deformation
在孔扩大过程中,细胞膜弹性应变能与孔半径之间的关系如图7a中的数据点所示,通过数值拟合可以得到二者之间的定量关系为(相关指数R2=0.999 54,R2接近1,说明拟合效果好)
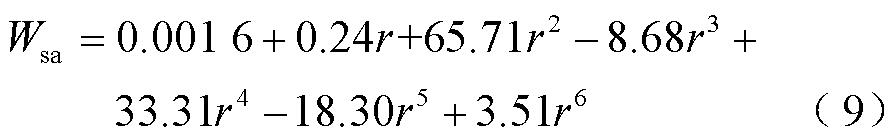
式中,Wsa为中等硬度的细胞膜弹性应变能(10-21J);r为孔半径(nm)。
目前,广泛使用孔能量方程来描述微孔的形成发展过程。在跨膜电压为U时,半径为r的自由能的变化为[27]
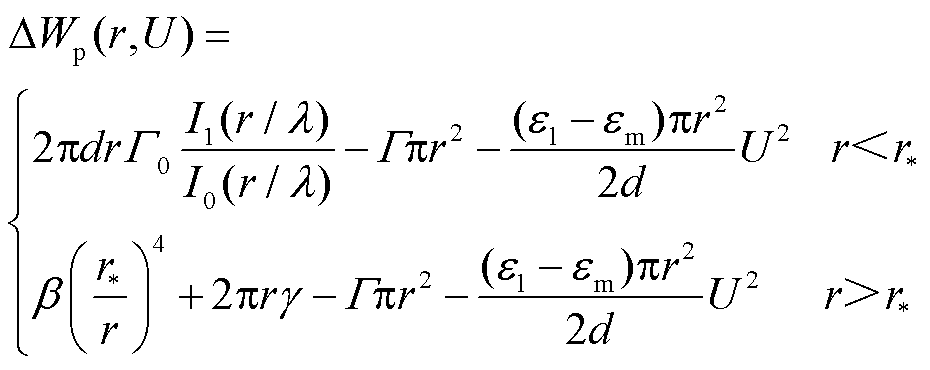 (10)
(10)
式中,这两个方程式分别描述疏水孔和亲水孔的能量变化。Ik是k(k=0,1)阶修改后的Bessel函数,其余参数的物理意义及数值见表1。
表1 孔能量方程相关参数
Tab.1 Parameters of pore energy equation

参数数值 疏水表面张力Γ0/(N/m) 0.05[27] 疏水相互作用特征长度λ/nm1[27] 亲水表面张力Γ/(N/m) 10-3[27] 溶液介电常数εl80[18] 细胞膜介电常数εm2[18] 亲水孔最小半径0.5[18] 空间排斥能β/J1.4×10-19[18] 线张力1.8×10-11[18]
当考虑细胞膜的力学性能及其变形产生的应变能时,孔能量方程为
 (11)
(11)
根据式(11),在Matlab中画出不同跨膜电压U(U=0V、0.3V、0.5V、0.8V、1.0V)下孔能量曲线,如图7b所示。从图7b中可以看出,当跨膜电压U不同时,其孔能量曲线也会不同,但从趋势上可分为跨膜电压较小(U≤0.5V)和较大(U≥0.8V)两种情况。为了说明细胞膜力学性能对电穿孔的影响,以U=0.5V和U=0.8V时为例,比较考虑和不考虑细胞膜应变能时的孔能量曲线。
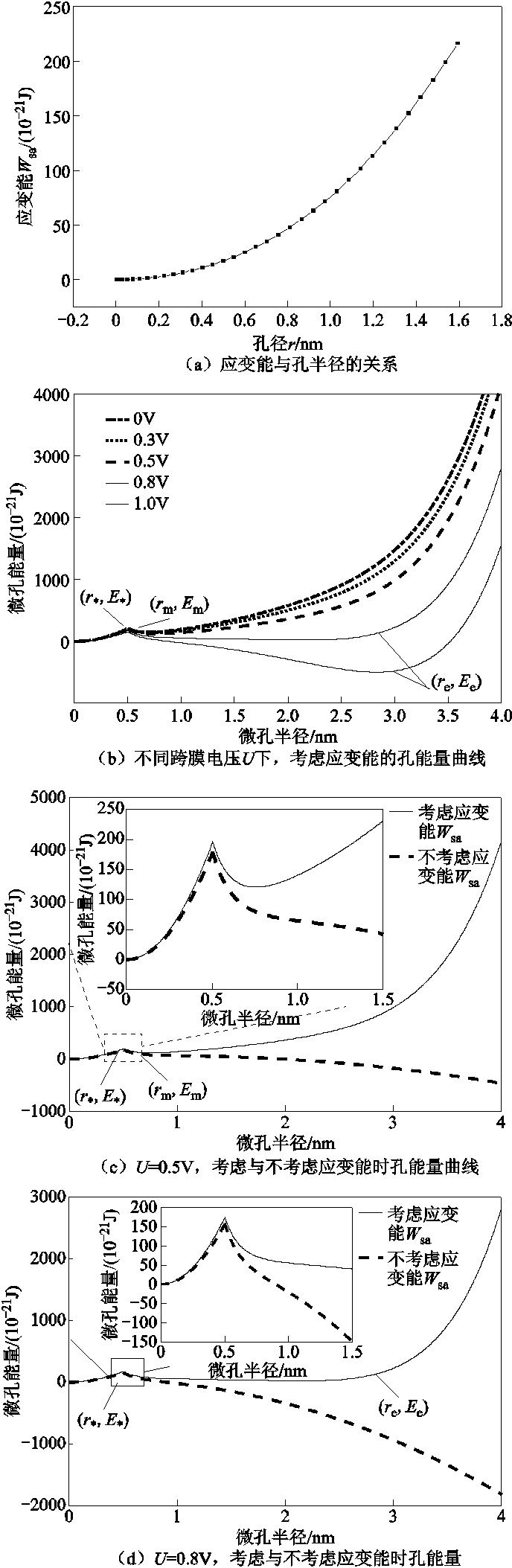
图7 应变能对孔能量曲线的影响
Fig.7 Effect of strain energy on pore energy curves
当U=0.5V时(见图7c),当r=0时,微孔闭合;当外加的热波动超过第一个极大值点(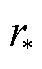 ,
,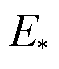 )(
)(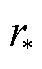 ≈0.5nm)时,孔由疏水孔转变为亲水孔,此时的微孔能量
≈0.5nm)时,孔由疏水孔转变为亲水孔,此时的微孔能量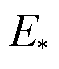 为微孔从疏水孔转变为亲水孔所克服的越过能垒。不考虑应变能时,微孔在到达越过能垒点(
为微孔从疏水孔转变为亲水孔所克服的越过能垒。不考虑应变能时,微孔在到达越过能垒点(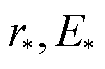 )后,微孔能量一直降低,微孔一直扩大;当考虑应变能之后,孔能量曲线上移,微孔能量会先有一个短暂快速地下降后一直上升,此时,短暂的下降到达暂稳态点(rm, Em),对应的孔径约为1nm,由能量最低原理可知,微孔能够稳定在极小值点,即能量最低点(rm, Em)处。
)后,微孔能量一直降低,微孔一直扩大;当考虑应变能之后,孔能量曲线上移,微孔能量会先有一个短暂快速地下降后一直上升,此时,短暂的下降到达暂稳态点(rm, Em),对应的孔径约为1nm,由能量最低原理可知,微孔能够稳定在极小值点,即能量最低点(rm, Em)处。
当U=0.8V时(见图7d),若不考虑应变能,微孔在到达越过能垒点(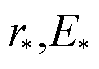 )后,微孔能量一直降低,微孔会一直扩大;考虑应变能后,孔能量曲线会有抬升,孔能量曲线先有一个缓慢的下降后上升,此时稳态点(re, Ee)为孔能量的最低点,对应的孔径有几纳米。
)后,微孔能量一直降低,微孔会一直扩大;考虑应变能后,孔能量曲线会有抬升,孔能量曲线先有一个缓慢的下降后上升,此时稳态点(re, Ee)为孔能量的最低点,对应的孔径有几纳米。
综上所述,细胞膜的力学性能在微孔形成过程中有重要影响。一方面,应变能的增加一方面增大了微孔能量,例如微孔从疏水孔转变为亲水孔时的越过能垒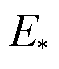 ,如当U=0.8V时,考虑应变能时为174.9×10-21J,不考虑应变能时为157.7×10-21J,二者相差17.2×10-21J,提高了11%,说明应变能的增加导致由疏水孔转变为亲水孔需克服的能量更大,微孔形成更加困难,微孔的形成会受到阻碍。另一方面,在微孔发展过程中,应变能的增加阻碍了孔径无限制增大的趋势,使微孔能够稳定在某一半径。当跨膜电压较小时,能够稳定的微孔半径约为1nm;跨膜电压较大时,微孔能够稳定在几纳米。
,如当U=0.8V时,考虑应变能时为174.9×10-21J,不考虑应变能时为157.7×10-21J,二者相差17.2×10-21J,提高了11%,说明应变能的增加导致由疏水孔转变为亲水孔需克服的能量更大,微孔形成更加困难,微孔的形成会受到阻碍。另一方面,在微孔发展过程中,应变能的增加阻碍了孔径无限制增大的趋势,使微孔能够稳定在某一半径。当跨膜电压较小时,能够稳定的微孔半径约为1nm;跨膜电压较大时,微孔能够稳定在几纳米。
当改变细胞膜材料参数时,细胞膜弹性模量不同,刚度不同,其电势、电场强度及变形情况与2.1节、2.2节中的细胞膜是类似的,在数值上会有区别。三种参数下,细胞膜弹性应变能与孔半径之间的关系如图8a所示。明显看到,对于某一种材料参数的细胞膜,随着微孔扩大,孔径增大,细胞膜由于变形而储存的应变能越多,并且当孔径越大时,应变能增加越快。不同材料参数时,当细胞膜弹性模量越大,其弹性应变能越大。经数值拟合,弹性应变能与微孔半径的关系如下。
当细胞膜弹性模量较小时有
C10b=C10a/3=0.145 8MPa C01b=C01a/3=0.020 8MPa
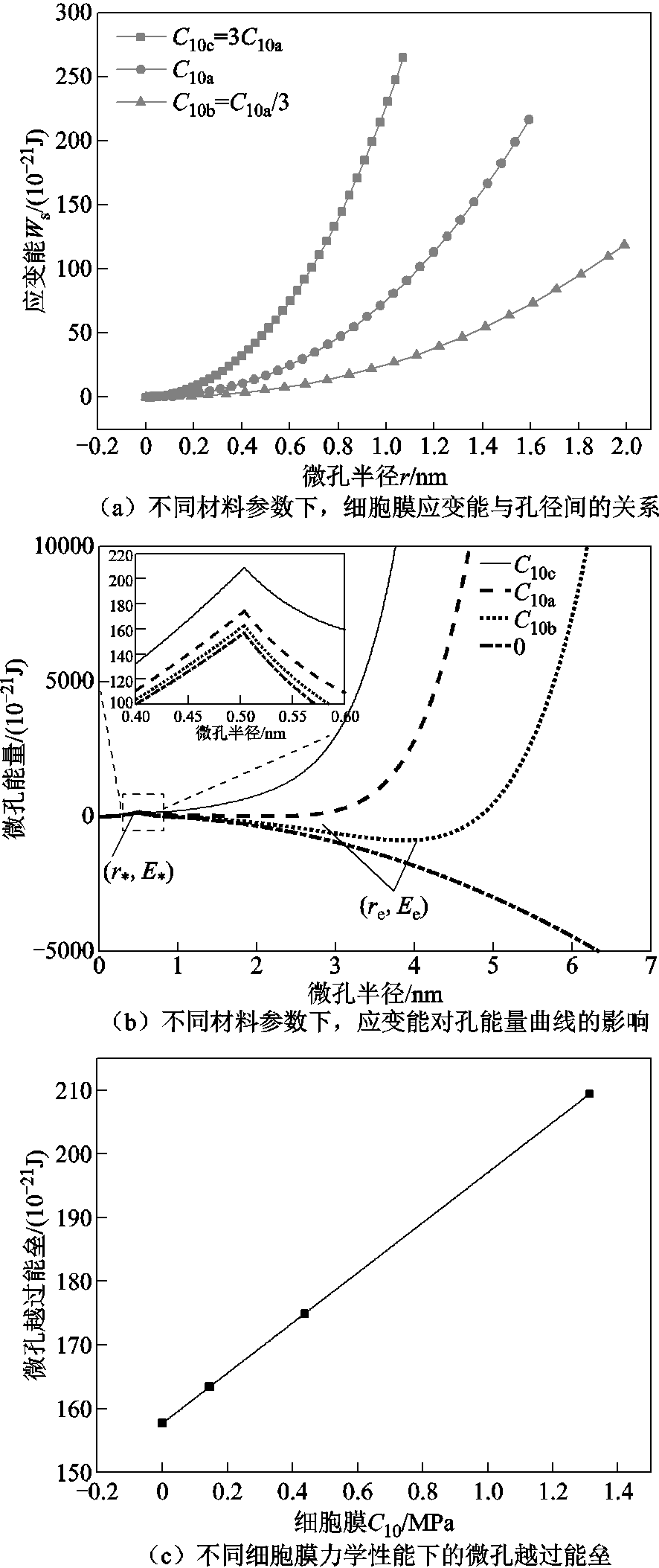
图8 细胞膜力学性能不同对微孔的影响
Fig.8 Effect of different mechanical properties of cell membrane on pore
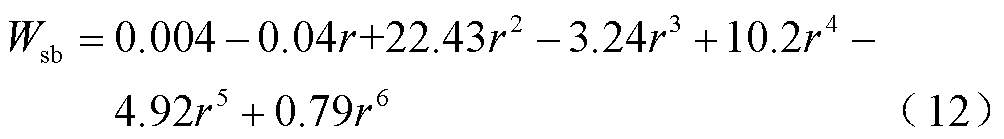
当细胞膜弹性模量较大时,有
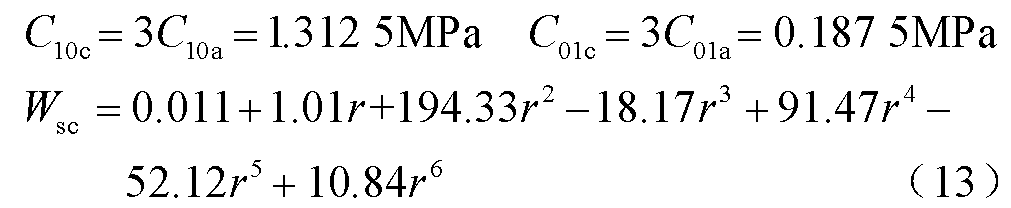
细胞膜材料参数为C10a、C01a时,应变能与孔半径之间的关系如式(9)所示。
将三种材料参数下的细胞膜应变能添加到孔能量关系式(10)中,并以跨膜电压U=0.8V为例比较其微孔发展过程,如图8b所示。可以看出,细胞膜弹性模量越大,微孔能量越大,孔能量曲线上移。一方面,当细胞膜弹性模量越大时,微孔从疏水孔转变为亲水孔所需要克服的越过能垒越大,微孔形成更加困难。不同材料参数下的微孔越过能垒大小如图8c所示,当细胞膜材料参数C10线性增大时,微孔的越过能垒也呈线性增大变化,即微孔的越过能垒与细胞膜的弹性模量呈线性相关。此外,当微孔跨过疏水阶段后,随着细胞膜弹性模量增大,孔能量曲线上的稳态点(re, Ee)左移,对应的微孔半径越小,细胞膜弹性模量较小时,可稳定在4nm左右;当弹性模量较大时,稳定在很小的半径,只有1nm左右。
本文在电场中考虑了细胞膜的弹性性能,在电场力、线张力和表面张力的共同作用下微孔会发展扩大,并且由于细胞膜变形产生了弹性应变能。然后分析应变能对微孔能量的改变,以此说明细胞膜的力学性能对微孔形成的影响。虽然已有部分学者[13-15]也研究了细胞膜应变能对电穿孔的影响,但本文将细胞膜看作超弹性材料,相较于简单的线性弹性材料,能够更好地描述细胞膜的特性;而且本文分析了不同力学性能的细胞膜下微孔形成的区别。
细胞膜的力学性能及产生的弹性应变能对电穿孔有重要影响,一方面,应变能增大了微孔能量,例如从疏水孔向亲水孔转变时的越过能垒,如当跨膜电压为0.8V时,增加了17.2×10-21J。而且,细胞膜弹性模量越大,其微孔越过能垒越大,并且二者呈线性相关,导致微孔形成更加困难,这一结论十分重要。首先,这为不同的细胞对脉冲参数具有选择性提供了一种可能的解释,在同一脉冲参数下,不同的细胞,不仅它们的几何参数和电学参数不同,其种类、组成和结构不同而使力学性能也不同,在电场下所发生的电穿孔效应也会有差异。例如有很多研究表明[19-20],当细胞膜上的肌动蛋白细胞骨架破坏,其弹性降低,电穿孔效应越强,如比细胞骨架未被破坏的细胞显示出更多的磷脂酰丝氨酸外翻和碘化丙碇分子的摄取。其次,这对实验具有指导意义,例如,为了使弹性模量较大的细胞发生电穿孔,就要对其他影响因素进行加强,如外加电场的参数、细胞溶液的参数。
另一方面,考虑到细胞膜的力学性能,应变能的增加会使微孔的尺寸稳定,而不是无限制地扩大,这与研究[28-29]中的一些结论是一致的,他们认为电穿孔不能产生比细胞骨架网络锚点更大的孔,换句话说,由于细胞膜上附着有细胞骨架蛋白网络,微孔最初可以迅速扩张,直到达到与细胞骨架网络中的孔相当的稳定尺寸。通过本文的仿真,从微孔能量曲线上可预测微孔的稳定尺寸,从结果可发现跨膜电压和细胞膜的力学性能均会影响微孔的稳定尺寸。当细胞膜的弹性模量较小且跨膜电压较大时,预测可稳定的微孔半径可达几纳米;当细胞膜弹性模量较大或跨膜电压较小时,稳定的微孔半径约为1nm。
当考虑到细胞膜力学性能,微孔的形成发展会更加困难,从能量守恒角度对这一现象也能够很好地解释。假如把细胞膜看作电容,在电场下充电储存的能量为0.5CLWU2(CLW为穿孔前后细胞膜的单位面积电容,U为跨膜电压),不考虑细胞膜结构或力学性能时,这些能量都会转换为微孔形成并扩大的能量。而考虑细胞膜机械结构后,细胞膜上微孔的扩大过程中,细胞膜结构也发生变化而变形,变形过程中需要消耗能量,这部分能量需要从电容能中转化一部分,所以导致完全用于扩大微孔的能量减少,表现为微孔的形成会受到细胞膜的阻碍作用。
在本文中,从细胞膜变形情况可以看出(见图6),细胞膜在电场力、线张力和表面张力的共同作用下沿着孔径扩大的方向压缩。由于本文把细胞膜看作不可压缩弹性材料,细胞膜在径向上压缩使其在厚度方向上凸出,细胞膜的局部变形导致微孔的边缘比周围平整的细胞膜高出一部分,这就使微孔在整体上呈现火山口形态。这与D. C. Chang等[28]通过冷冻电镜,首次在红细胞膜上观察到电场作用后形成的开口形态为火山形状的微孔的现象是一致的。
当考虑细胞膜的力学性能后,从孔能量曲线上也能预测微孔的重新密封过程,如图9所示。假设微孔已从疏水孔过渡到亲水孔状态,当细胞膜上的电压为0.8V时,微孔能量沿着路径①,微孔稳定时的半径约为2.5nm。当外加电场撤去后,微孔能量会跳跃到U=0V时的曲线上(路径②),之后微孔会沿着U=0V时的能量曲线变化(路径③),由能量最低原理可知,微孔半径会缩小直至恢复到微孔半径约为0.5nm左右的状态。但从中也能发现,由于细胞膜弹性应变能的增加,导致孔能量曲线之后会一直上升,而没有发生不可逆电穿孔的极值点。所以,本文从细胞膜的力学性能角度对电穿孔模型进行了改进,能够比较好地描述可逆电穿孔现象,但还不能对不可逆电穿孔[17, 30]现象进行很好的解释。
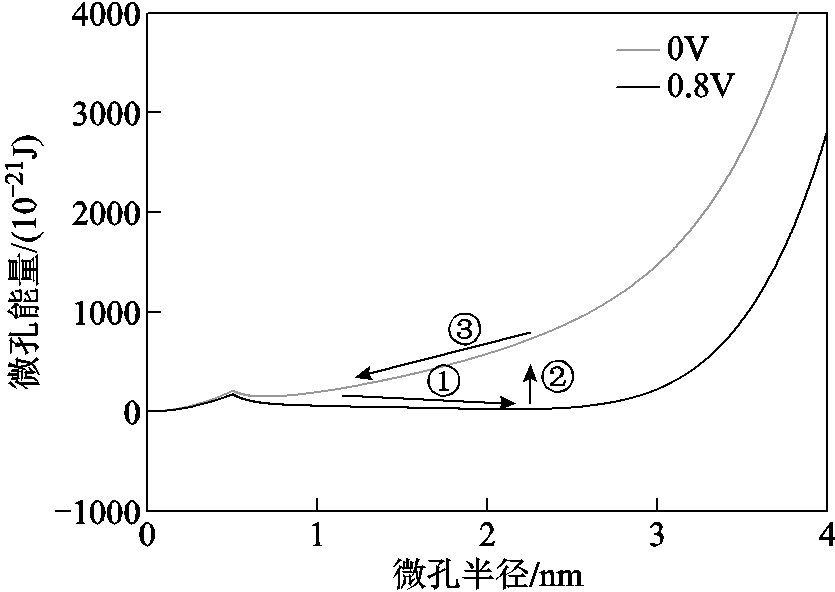
图9 微孔重新密封过程
Fig.9 Resealing process of pores
本文从仿真角度分析了细胞膜的力学性能及其弹性应变能在电穿孔中的重要作用,得出以下结论:
1)在微孔扩大过程中,由于细胞膜的局部变形会使微孔边缘整体呈现火山口形态。
2)在微孔形成过程中,细胞膜的应变能会增大微孔越过能垒,导致微孔形成更加困难;并且细胞膜弹性模量越大,微孔所需的越过能垒越大,且二者线性相关。
3)在微孔发展过程中,细胞膜应变能的增加会使微孔稳定,而不是无限扩大。微孔稳定的半径与跨膜电压和细胞膜的力学性能有关,当细胞膜弹性模量较小且跨膜电压较大时,微孔可稳定在几个纳米;反之,可稳定在1nm左右。本研究为探讨细胞结构对电穿孔的影响机制提供了理论参考。
参考文献
[1] 吴建光. 利用光镊研究生物细胞的力学行为[D]. 合肥: 中国科学技术大学, 2009.
[2] Weaver J C. Electroporation of cells and tissues[J]. IEEE Transactions on Plasma Science, 2000, 28(1): 24-33.
[3] 程显, 陈硕, 吕彦鹏, 等. 纳秒脉冲作用下核孔复合体影响细胞核膜电穿孔变化的仿真研究[J]. 电工技术学报, 2021, 36(18): 3821-3828.
Cheng Xian, Chen Shuo, Lü Yanpeng, et al. Simulation study on the effect of nuclear pore complexes on cell electroporation under nanosecond pulse[J]. Transactions of China Electrotechnical Society, 2021, 36(18): 3821-3828.
[4] Freeman S A, Wang M A, Weaver J C. Theory of electroporation of planar bilayer membranes: predictions of the aqueous area, change in capacitance, and pore-pore separation[J]. Biophysical Journal, 1994, 67(1): 42-56.
[5] 唐潇, 姚陈果, 郑爽, 等. 不可逆电穿孔多因素动态电导率模型的研究与分析[J]. 电工技术学报, 2021, 36(14): 2912-2921.
Tang Xiao, Yao Chenguo, Zheng Shuang, et al. Establishment and analysis of multi-factor dynamic conductivity model for irreversible electroporation[J]. Transactions of China Electrotechnical Society, 2021, 36(14): 2912-2921.
[6] 米彦, 代璐健, 刘权, 等. 靶向金纳米棒联合纳秒脉冲电场对体外A375黑色素瘤2D模拟组织的消融效果研究[J]. 电工技术学报, 2021, 36(18): 3766-3775.
Mi Yan, Dai Lujian, Liu Quan, et al. Ablation effects of A375 melanoma cells treated by targeted gold nanorods combined with nanosecond pulsed electric fields[J]. Transactions of China Electrotechnical Society, 2021, 36(18): 3766-3775.
[7] 米彦, 刘权, 李盼, 等. 低强度纳秒脉冲电场联合靶向金纳米棒对A375黑色素瘤细胞的杀伤效果研究[J]. 电工技术学报, 2020, 35(12): 2534-2544.
Mi Yan, Liu Quan, Li Pan, et al. Study of killing effects of A375 melanoma cells treated by low intensity nanosecond pulsed electric fields combined with targeted gold nanorods[J]. Transactions of China Electrotechnical Society, 2020, 35(12): 2534-2544.
[8] 姚陈果, 宁郡怡, 刘红梅, 等. 微/纳秒脉冲电场靶向不同尺寸肿瘤细胞内外膜电穿孔效应研究[J]. 电工技术学报, 2020, 35(1): 115-124.
Yao Chenguo, Ning Junyi, Liu Hongmei, et al. Study of electroporation effect of different size tumor cells targeted by micro-nanosecond pulsed electric field[J]. Transactions of China Electrotechnical Society, 2020, 35(1): 115-124.
[9] van Uitert I, Le Gac S, van den Berg A. The influence of different membrane components on the electrical stability of bilayer lipid membranes[J]. Biochimica et Biophysica Acta, 2010, 1798(1): 21-31.
[10] Thompson G L, Roth C, Tolstykh G, et al. Disruption of the actin cortex contributes to susceptibility of mammalian cells to nanosecond pulsed electric fields[J]. Bioelectromagnetics, 2014, 35(4): 262-272.
[11] Muralidharan A, Rems L, Kreutzer M T, et al. Actin networks regulate the cell membrane permeability during electroporation[J]. Biochimica et Biophysica Acta (BBA) - Biomembranes, 2021, 1863(1): 183468.
[12] Kim H B, Lee S, Chung J H, et al. Effects of actin cytoskeleton disruption on electroporation invitro[J]. Applied Biochemistry and Biotechnology, 2020, 191(4): 1545-1561.
[13] Sun Sheng, Yin Guangyao, Lee Y K, et al. Effects of deformability and thermal motion of lipid membrane onelectroporation: by molecular dynamics simulations[J].Biochemical and Biophysical Research Communications, 2011, 404(2): 684-688.
[14] Hoiles W, Krishnamurthy V, Cranfield C G, et al. An engineered membrane to measure electroporation: effect of tethers and bioelectronic interface[J]. Biophysical Journal, 2014, 107(6): 1339-1351.
[15] Hoiles W, Krishnamurthy V, Cornell B. Modelling the bioelectronic interface in engineered tethered membranes: from biosensing to electroporation[J]. IEEE Transactions on Biomedical Circuits and Systems, 2015, 9(3): 321-333.
[16] Deng Peigang, Lee Y K, Zhang Tongyi. A nonlinear electromechanical coupling model for electropore expansion in cell electroporation[J]. Journal of Physics D: Applied Physics, 2014, 47(44): 445401.
[17] Deng Peigang, Lee Y K, Lin Ran, et al. Nonlinear electro-mechanobiological behavior of cell membrane during electroporation[J]. Applied Physics Letters, 2012, 101(5): 053702.
[18] Heyden S, Ortiz M. Investigation of the influence of viscoelasticity on oncotripsy[J]. Computer Methods in Applied Mechanics and Engineering, 2017, 314: 314-322.
[19] Neu W K, Neu J C. Mechanism of irreversible electroporation in cells: insight from the models[M]. Berlin, Heidelberg: Springer, 2010.
[20] Dastani K, Moghimi Zand M, Hadi Amin, et al. Revealing electrical stresses acting on the surface of protoplast cells under electric field[J]. European Journal of Mechanics - B/Fluids, 2019, 76: 292-302.
[21] Karatekin E, Sandre O, Guitouni H, et al. Cascades of transient pores in giant vesicles: line tension and transport[J]. Biophysical Journal, 2003, 84(3): 1734-1749.
[22] 董守龙. 高频双极性微秒脉冲电场不可逆电穿孔消融肿瘤的实验与机理研究[D]. 重庆: 重庆大学, 2017.
[23] Boyce M C, Arruda E M. Constitutive models of rubber elasticity: a review[J]. Rubber Chemistry and Technology, 2000, 73(3): 504-523.
[24] Tan Youhua, Sun Dong, Huang Wenhao. A mechanical model of biological cells in microinjection[C]//2008 IEEE International Conference on Robotics and Biomimetics, Bangkok, Thailand, 2009: 61-66.
[25] Skalak R, Tozeren A, Zarda R P, et al. Strain energy function of red blood cell membranes[J]. Biophysical Journal, 1973, 13(3): 245-264.
[26] Xu Dong, Kaliviotis E, Munjiza A, et al. Large scale simulation of red blood cell aggregation in shear flows[J]. Journal of Biomechanics, 2013, 46(11): 1810-1817.
[27] Kotnik T, Rems L, Tarek M, et al. Membrane electroporation and electropermeabilization: mechanisms and models[J]. Annual Review of Biophysics, 2019, 48: 63-91.
[28] Chang D C, Reese T S. Changes in membrane structure induced by electroporation as revealed by rapid-freezing electron microscopy[J]. Biophysical Journal, 1990, 58(1): 1-12.
[29] Graybill P M, Davalos R V. Cytoskeletal disruption after electroporation and its significance to pulsed electric field therapies[J]. Cancers, 2020, 12(5): 1132.
[30] Latouche E L, Arena C B, Ivey J W, et al. High-frequency irreversible electroporation for intracranial meningioma: a feasibility study in a spontaneous canine tumor model[J]. Technology in Cancer Research & Treatment, 2018, 17: 1533033818785285.
Simulation Study on the Effect of Cell Membrane Mechanical Properties on Electroporation
Abstract To explore the influence of the mechanical properties of cell membrane on electroporation, cell membrane was regarded as a hyperelastic material, and an electromechanical coupling model of local single pore on the cell membrane was established in COMSOL. The influence of the elastic strain energy of the cell membrane on the pore formation was analyzed and the difference of pore formation with different elastic modulus of the cell membrane was compared. The results show that the strain energy of the cell membrane increases the energy barrier for transition from hydrophobic pore to hydrophilic pore. The greater the elastic modulus of the cell membrane, the greater the energy barrier is, and the two are linearly related. On the other hand, the increased strain energy stabilizes the pores and prevents them from expanding indefinitely, and the stable size is related to the mechanical properties of the cell membrane and the transmembrane potential. This paper reveals the importance role of the mechanical properties of the cell membrane in electroporation through simulation, which provides a theoretical reference for studying the influence mechanism of cell structure on electroporation.
keywords:Mechanical properties, electroporation, electromechanical coupling, strain energy, pore energy
DOI:10.19595/j.cnki.1000-6753.tces.211105
中图分类号:TM836;Q64
国家自然科学基金(52077022,51477022)和“111”引智项目(BP0820005)资助。
收稿日期 2021-07-15
改稿日期 2021-09-20
米 彦 男,1978年生,教授,博士生导师,研究方向为高电压新技术。E-mail:miyan@cqu.edu.cn(通信作者)
吴 晓 女,1996年生,硕士研究生,研究方向为高电压新技术。E-mail:20191102061t@cqu.edu.cn
(编辑 郭丽军)