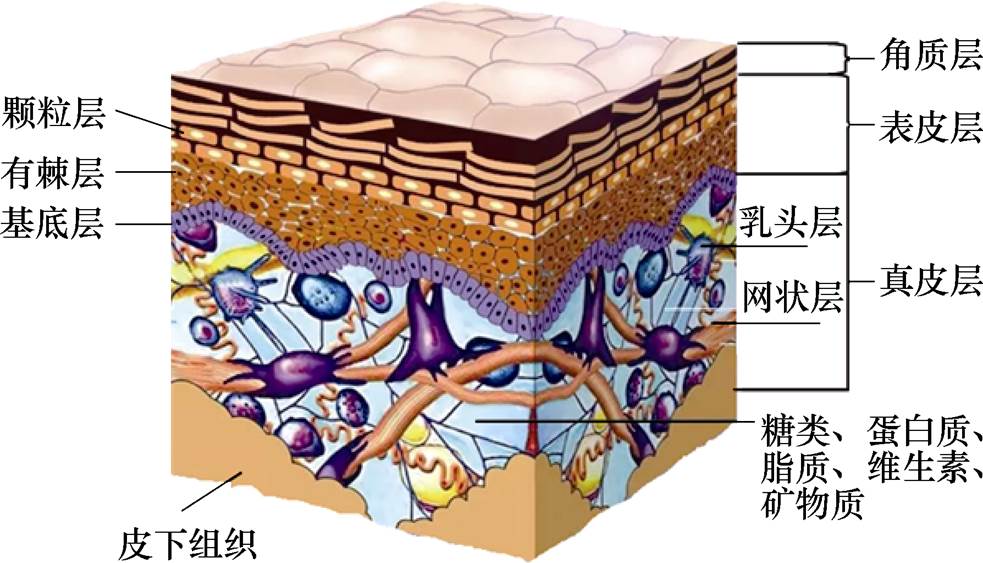
图1 人体皮肤组织的结构
Fig.1 The structure of human skin tissues
摘要 太赫兹波以其独特的水分敏感性在生物组织的水分检测中展现出广阔的应用前景,太赫兹时域光谱(THz-TDs)技术与有效介质理论结合可以对皮肤组织的水分含量进行评估,但是对皮肤水分含量的变化进行准确定量感知仍然是尚未解决的问题,需要稳定的评估方法并分析其评估的准确性和影响因素。该文首先根据人体皮肤组织的结构和水分分布规律,定义三种皮肤水分含量梯度分布曲线,提出以反射率为优化目标的皮肤水分定量评估方法。然后采用遗传算法和列文伯格-马夸尔特(LM)相结合的混合算法对目标函数进行优化求解,使用反射式太赫兹测量系统对小手臂皮肤进行阻塞测量实验,得到时域信号和反射率的变化规律。最后讨论不同水分含量初始规律和不同有效介质模型对皮肤水分含量评估准确性的影响。结果表明,角质层水分分布规律和有效介质模型的选取对水分含量的绝对评估结果影响均很大,有效介质模型对水分含量的变化量影响较小,选择确定的水分分布规律和有效介质模型可以准确地评估皮肤水分含量的变化。该文研究可为太赫兹皮肤烧伤和皮肤疾病检测提供理论支撑。
关键词:太赫兹时域光谱 皮肤水分含量 有效介质模型 反射率 混合算法
皮肤是人体与环境直接接触的器官,具有保护、调节体温和维护新陈代谢的功能。正常的皮肤含有合理的水分含量,当皮肤出现疾病、干燥和使用化妆品时会造成水分的改变,皮肤水分含量成为了皮肤疾病和健康状况的重要指标。因此实现对皮肤水分的定量测量和动态监测,对皮肤烧伤诊断、皮肤癌变组织鉴别和皮肤疤痕愈合监测等有着重要意义。
目前有多种方法和仪器来分析皮肤的结构和水分含量的变化,现有的研究认为皮肤变得干燥主要是角质层中的水分含量降低,因此早期的诊断方法是直接测量角质层的水分含量[1]。皮肤表面电容测量法[2-3]、皮肤水分流失法[4]和表面弹性测量法[5-6]等较为传统的方法被率先提出用于角质层的水分测量,这些方法将角质层总体水分含量作为指标,但是不能对皮肤内部结构和成分进行精确分析,如皮肤内部油脂和蛋白质分子的影响。近年来,一些光谱及成像技术被用于皮肤检测,例如,全反射红外光谱法[7]、核磁共振法[8-9]、光学相干断层法[10]、拉曼光谱法[11]和共聚焦拉曼光谱法[12]等,这些技术可以成像出皮肤厚度、皮肤内部部分成分和表皮层水分的梯度分布参数。这些光谱技术虽然可以直接测量皮肤,但是由于皮肤组织的复杂内部结构和成分,测量的准确度受到限制。高精度核磁共振测量法需要巨大的磁体设备[13]。同时,复杂的测量系统和昂贵的成本限制了一些方法的实际应用。
太赫兹时域光谱及其成像技术已用于人体组织的活体无损检测[14],在皮肤癌诊断、肿瘤辨识和眼角膜水分监测等领域展示出极大的应用潜力。太赫兹是频率为0.1~10THz的电磁波,分辨率较高、光子能量低,对人体没有伤害,且对水分极其敏感,可以提供优于其他手段的测量精度。虽然太赫兹对皮肤组织水分变化敏感,但是其应用于皮肤水分含量定量评估仍然是一个尚未解决的问题。加州洛杉矶分校的Z. D. Taylor等建立了皮肤的多层电磁模型,假设皮肤水分为线性梯度变化,然后采用皮肤表面的反射率来评估水分含量[15-17]。同时采用小鼠烧伤实验评估了烧伤皮肤表面太赫兹反射率的变化,结果表明,太赫兹可以监测烧伤皮肤水分含量的变化,但是没有进行定量评估研究。香港中文大学的Sun Qiushuo等研究了石英玻璃窗对皮肤角质层的阻塞效应,得出了测量信号峰峰值随阻塞时间的变化关系[18-20]。同时基于假设的皮肤线性水分初始分布和多层媒质模型,采用拟合的方法研究了皮肤角质层中水分的扩散率。然而根据共聚焦拉曼光谱的测量结果,皮肤角质层的水分分布不一定是线性的,因此不同的水分分布假设规律将影响皮肤水分含量的评估结果,目前尚未有研究分析水分分布规律的影响;另一方面,在进行水分含量评估时,皮肤被视作混合介质,通常采用有效介质模型计算其相对介电常数,Sun Qiushuo等采用了Bruggeman模型[20],G. Hernandez Cardoso等采用了LLL(Landau-Lifshitz- Looyemga)模型来计算糖尿病患者脚掌在太赫兹频段的相对介电常数[21]。上述研究表明,不同的有效介质模型也会影响皮肤水分的定量评估,因此在采用太赫兹定量评估皮肤水分时,还需要进一步讨论有效介质模型和水分初始分布对评估结果的影响。
本文将从人体皮肤组织结构和水分不同分布规律出发,建立多层皮肤组织的电磁模型,采用反射式太赫兹时域光谱系统对阻塞状态下的皮肤进行连续测量,通过混合优化算法稳定地评估手臂皮肤的水分含量,然后分析和讨论不同初始水分分布规律和不同有效介质模型对量化评估结果的影响,为太赫兹皮肤检测的实用化提供参考。
人体皮肤组织可以分为角质层、表皮层、真皮层和皮下组织四层结构,人体皮肤组织的结构如图1所示。角质层为皮肤最外层的部分,由无核角质细胞构成,厚度介于10~200mm,含水量较低[22];表皮层厚度为0.01~1.2mm,可以分为多层结构;真皮组织厚度位于表皮层下方,内部包括了丰富的蛋白质、汗腺、血管和神经等结构;正常皮肤角质层通常含有10%~35%的水分,真皮层含水量占全部皮肤组织的70%左右。太赫兹波对水分含量极其敏感,因此必须考虑皮肤水分含量随皮肤深度的变化。Z. D. Taylor等[15]将正常皮肤三层结构的水分含量分布规律均采用线性分段函数来表示,但是现有的研究表明,皮肤的水分含量成梯度分布,从角质层到真皮层逐渐增加。皮肤不同层的水分分布规律不同,角质层中的水分梯度最大、变化剧烈,水分含量随深度呈不同的非线性增加。表皮层和真皮层水分不容易变化,基本呈线性分布。

图1 人体皮肤组织的结构
Fig.1 The structure of human skin tissues
本文将皮肤水分含量分布分为三种形式,采用数学描述为
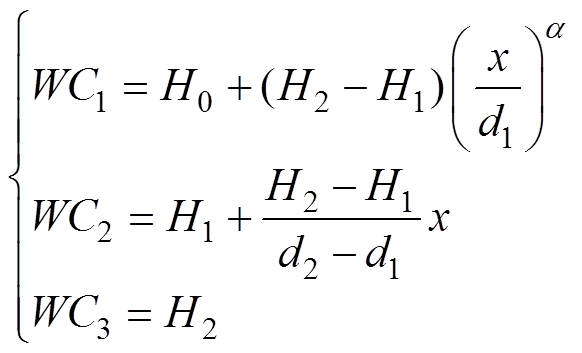 (1)
(1)式中,x为皮肤的深度;WC1、WC2、WC3分别为皮肤角质层、表皮层和真皮层的水分含量;H0、H1、H2分别为皮肤表面、角质层与真皮层分界面和真皮层的水分含量;d1、d2分别为角质层、表皮层。图2所示为指数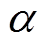 分别取0.5、1、2时皮肤含水量分布曲线,不同的
分别取0.5、1、2时皮肤含水量分布曲线,不同的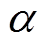 值表示角质层的水分含量增长的不同梯度。图2中,d3为真皮层的深度。
值表示角质层的水分含量增长的不同梯度。图2中,d3为真皮层的深度。
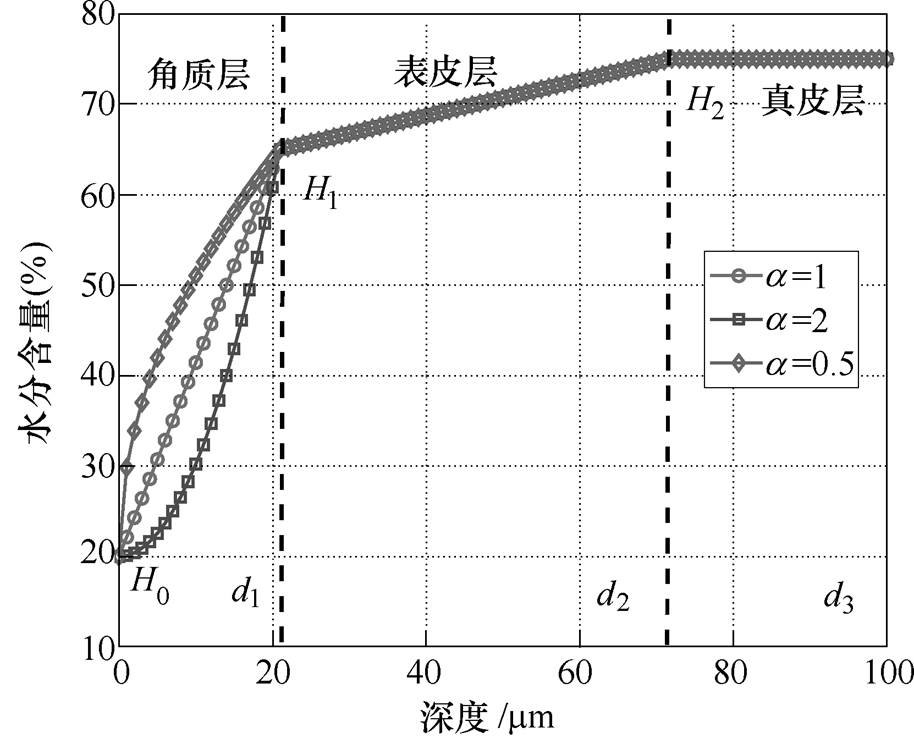
图2 三层皮肤含水量分布曲线
Fig.2 Distribution curves of water content in three-layered skin tissue
皮肤组织可以视为无水细胞等基础组织和水的混合物,其相对介电常数等参数不再是独立的,而是构成了新的复合物质的相对介电常数[24]。有效介质理论(Effective Medium Theory, EMT)是研究复合介质整体相对介电常数的主要理论,其主要思想是把整个复合介质当作是一种介质,具有等效的相对介电常数,从而通过等效的相对介电常数来研究复合介质的介电性质。常用的有效介质模型有:MG(Maxwell-Garnet)模型,BG(Bruggeman)模型、LLL模型。在太赫兹生物检测领域中使用最广泛的是BG模型和LLL模型,已经应用于聚合物含量辨别[25]、生物组织太赫兹光谱参数的确定[26]和植物叶片水分监测[27]等领域。因此本文重点讨论BG模型和LLL模型。
人体皮肤组织比一般混合物更为复杂,主要成分为水分和细胞组织,因此将其简化为水和干燥皮肤组织的混合物。根据Z. D. Taylor等的研究,干燥皮肤组织的相对介电常数设置为常数[15]。常温下液体水在太赫兹频段(0.1~3THz)的相对介电常数可以用双德拜模型来描述,即
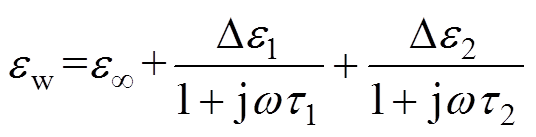 (2)
(2)式中,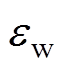 为水的相对介电常数;
为水的相对介电常数;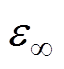 为直流相对介电常数;
为直流相对介电常数;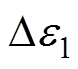 和
和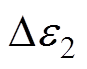 分别为慢弛豫过程和快弛豫过程的常数;
分别为慢弛豫过程和快弛豫过程的常数;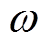 为角频率;
为角频率;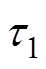 和
和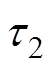 分别为慢弛豫过程和快弛豫过程的时间常数。
分别为慢弛豫过程和快弛豫过程的时间常数。
由于水分的梯度分布,皮肤的相对介电常数由内向外呈不均匀分布,其局部有效相对介电常数需要用EMT模型来计算。BG模型可以更加平衡地考虑各混合物的相对介电常数,且容易扩展至三种及以上混合物,数学表达式为
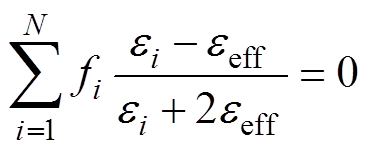 (3)
(3)其中
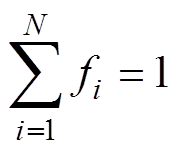
式中,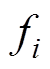 为第i种介质的体积分数;N为混合物质的种类数量;
为第i种介质的体积分数;N为混合物质的种类数量;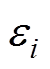 为第i种介质的相对介电常数;
为第i种介质的相对介电常数;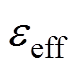 为混合媒质的有效相对介电常数。
为混合媒质的有效相对介电常数。
LLL模型的数学描述为
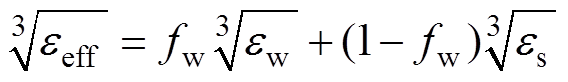 (4)
(4)式中,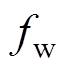 为水分的体积分数;
为水分的体积分数;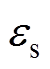 为干燥皮肤的相对介电常数。
为干燥皮肤的相对介电常数。
将皮肤分成多个薄层,每个薄层的厚度设置为d=2mm,并假设薄层内水分为恒定值,因此薄层的相对介电常数也为恒定值。太赫兹波以一定的入射角度由空气入射到皮肤组织,会在表面发生反射和透射,同时由于皮肤内部的折射率不均匀,透射进入皮肤内部的电磁波会继续发生多重反射和透射。在进行太赫兹测量时,皮肤放置于石英玻璃窗上,太赫兹波从空气出入射,太赫兹波在皮肤组织内部传播示意图如图3所示。
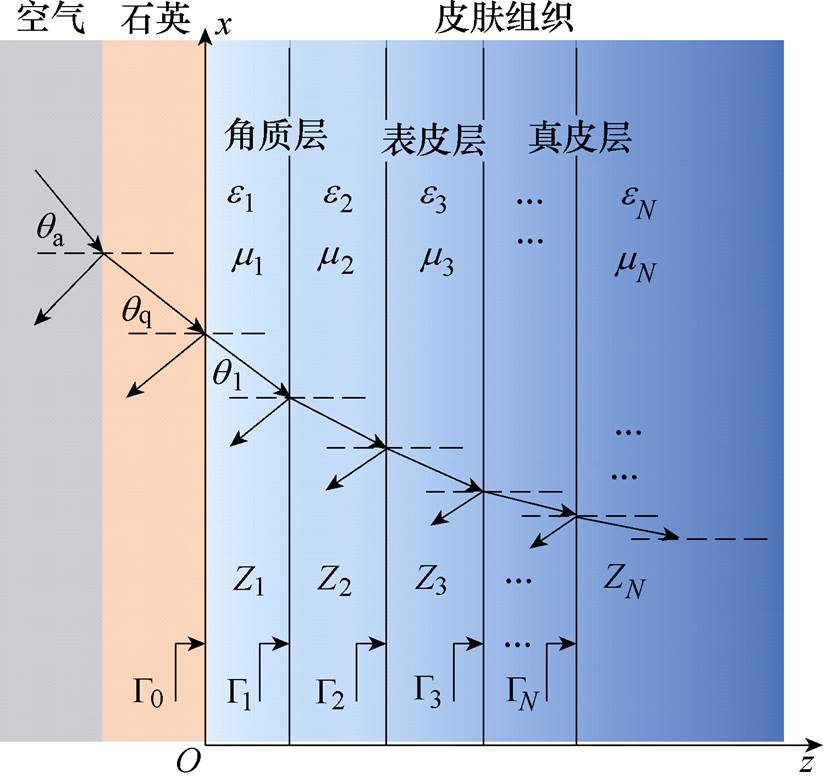
图3 太赫兹波在皮肤组织内部传播示意图
Fig.3 Propagation of terahertz wave in the skin tissues
沿z方向传播的均匀平面电磁波从皮肤第1层向第N层斜入射,媒质1, 2, 3,…, N存在各自的入射波和反射波,媒质最后一层只存在透射波。根据电磁理论的多层媒质等效波阻抗方法,可以迭代计算得到太赫兹波通过石英玻璃窗后在皮肤表面的反射系数[18]为
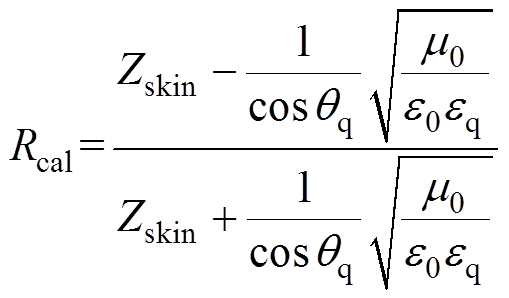 (5)
(5)式中,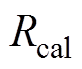 为计算得到的反射系数;
为计算得到的反射系数;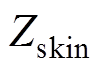 为计算得到的多层皮肤模型等效波阻抗;
为计算得到的多层皮肤模型等效波阻抗;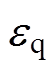 为石英玻璃窗的相对介电常数,取为4.664;
为石英玻璃窗的相对介电常数,取为4.664;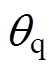 为太赫兹波从石英玻璃窗入射到皮肤表面的角度;
为太赫兹波从石英玻璃窗入射到皮肤表面的角度;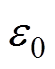 和
和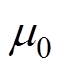 分别为真空中的相对介电常数和相对磁导率。
分别为真空中的相对介电常数和相对磁导率。
实验平台采用TeraPulse 4000太赫兹时域光谱系统的光纤耦合反射式探测模块,系统带宽为0~4THz,信噪比最高可达70dB,可以自动对单点进行多次测量。实验时,以小手臂皮肤为测量对象,将手臂平放于石英玻璃样品窗上,保持皮肤与石英窗的良好接触,太赫兹信号的入射角度为30°。实验装置及测量示意图如图4所示。

图4 太赫兹测量皮肤示意图
Fig.4 Photo of skin measurement by terahertz wave
入射的太赫兹信号首先在石英玻璃窗的下表面产生第一次反射,然后石英玻璃窗和皮肤交界面产生第二次反射。因此在测量时,需要首先测量出第一次反射信号(即基准线)和参考信号,然后测量皮肤信号,具体的测量步骤如下:
(1)将与石英窗材质完全相同的玻片放置于样品窗上,使其与样品窗尽可能完美贴合,然后采集此时的信号,作为基准信号,记为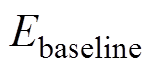 。
。
(2)拿掉玻片,采集此时的反射信号,作为参考信号,记为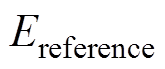 。
。
(3)将手臂水平放置于石英样品窗表面,使得皮肤与样品窗尽可能完美接触,同时施加一定力量使其接触更好,采集此时的反射信号,作为样品信号,记为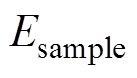 。
。
具体处理计算方法为
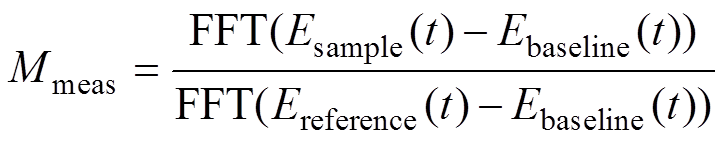 (6)
(6)式中,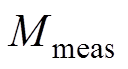 为测量得到的样品信号和参考信号的频域变换系数因子;FFT为傅里叶变换。
为测量得到的样品信号和参考信号的频域变换系数因子;FFT为傅里叶变换。
测量得到的反射系数为
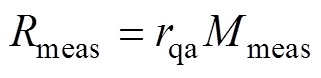 (7)
(7)根据Fresnel定律,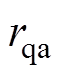 为石英玻璃窗到空气交界面的反射系数,满足
为石英玻璃窗到空气交界面的反射系数,满足
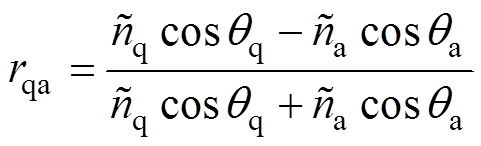 (8)
(8)
式中,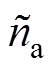 、
、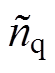 分别为空气和石英的复折射系数;
分别为空气和石英的复折射系数;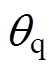 、
、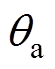 分别为太赫兹信号在石英和空气中的入射角度。
分别为太赫兹信号在石英和空气中的入射角度。
根据Snell定律,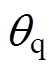 和
和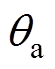 满足
满足
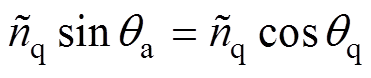 (9)
(9)本系统在0.3~0.9THz范围内的信噪比最高,因此根据测量得到的反射系数和计算得到的反射系数在频率0.3~0.9THz范围相等,从而确定最优的每一层皮肤组织的水分含量和厚度,使得目标函数取得最小值,即
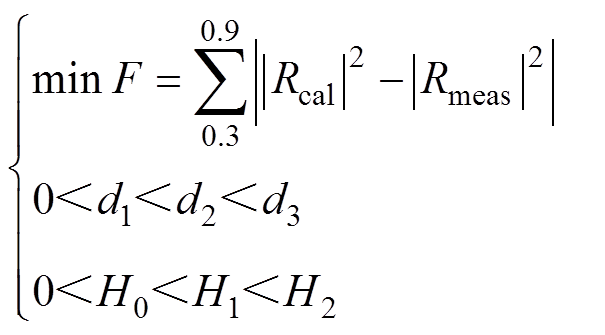 (10)
(10)需要寻优的变量为d1、d2、d3、H0、H1、H2。皮肤每层的厚度和水分含量处于一定的限值范围内,因此在进行优化计算时,需要设定变量的边界条件。对于正常小手臂皮肤而言,设定的初始值和约束条件见表1。
皮肤水分的变化引起的太赫兹信号的改变是一组敏感而微小的变量,而且理论计算的反射率是通过函数的嵌套和迭代计算得到,因此必须选择合理的优化算法,防止误差的放大和陷入不同局部最优值;另一方面,对皮肤水分进行太赫兹实时监测时需要每一次的评估都得出稳定值。遗传算法是一种优秀的优化算法[28],已经广泛应用于参数辨识和信号分析[29]等领域,但是单独使用遗传算法对皮肤水分进行评估,每一次的优化结果均不相同,必须对其改进。
表1 变量的边界条件
Tab.1 Boundaries of optimized variables

变量d1/mmd2/mmd3/mmH0(%)H1(%)H2(%) 上限102080144040 下限3090150658590
列文伯格-马夸尔特(Levenberg-Marquardt, LM)算法是使用最广泛的非线性最小二乘算法,能够快速地收敛于相同的结果,但是对初始值的选取要求较高。本文将遗传算法和LM算法结合起来,构成GA-LM的混合优化算法。对于厚度和结构未知的皮肤,首先给定一个较宽的边界约束,使用遗传算法的优化结果作为初始值,将更新的初始值加入到LM算法中,然后得到确定的优化结果,最终得到皮肤的水分含量分布。这种算法可以克服陷入局部最优值,又能避免初始值选取不当而造成的误差,使得优化算法可以适应处理不同含水量和不同厚度的情况,特别是适用于皮肤水分的连续监测。
整个皮肤水分含量评估算法流程如图5所示。首先根据假设的皮肤参数初始值、水分规律曲线、水的双德拜模型和有效介质模型计算皮肤相对介电常数;然后根据皮肤的多层媒质模型计算表面等效波阻抗,进而得到计算的反射率;最后对计算反射率和测量反射率使用GA-LM混合算法优化求解,得到最优的水分含量和厚度的最优值。
采用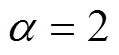 水分分布模型和BG有效介质模型对小手臂皮肤测量结果进行优化拟合,得到的反射率和皮肤水分含量分布如图6所示,每一次的拟合结果均相同,且总误差为0.001 8,误差最大点为2.5×104,说明拟合结果十分精确。拟合得到的皮肤水分含量分布曲线与测量值十分接近,得到的三层厚度分别为19.6mm、60.13mm和102.58mm,含水量分别为53.85%、65.75%和75.9%,接近于其他文献中测量得到的实际情况[10-12, 23],并且每一次拟合结果均保持不变,说明可以得到稳定的优化结果,证明了GA-LM算法的有效性和稳定性。
水分分布模型和BG有效介质模型对小手臂皮肤测量结果进行优化拟合,得到的反射率和皮肤水分含量分布如图6所示,每一次的拟合结果均相同,且总误差为0.001 8,误差最大点为2.5×104,说明拟合结果十分精确。拟合得到的皮肤水分含量分布曲线与测量值十分接近,得到的三层厚度分别为19.6mm、60.13mm和102.58mm,含水量分别为53.85%、65.75%和75.9%,接近于其他文献中测量得到的实际情况[10-12, 23],并且每一次拟合结果均保持不变,说明可以得到稳定的优化结果,证明了GA-LM算法的有效性和稳定性。
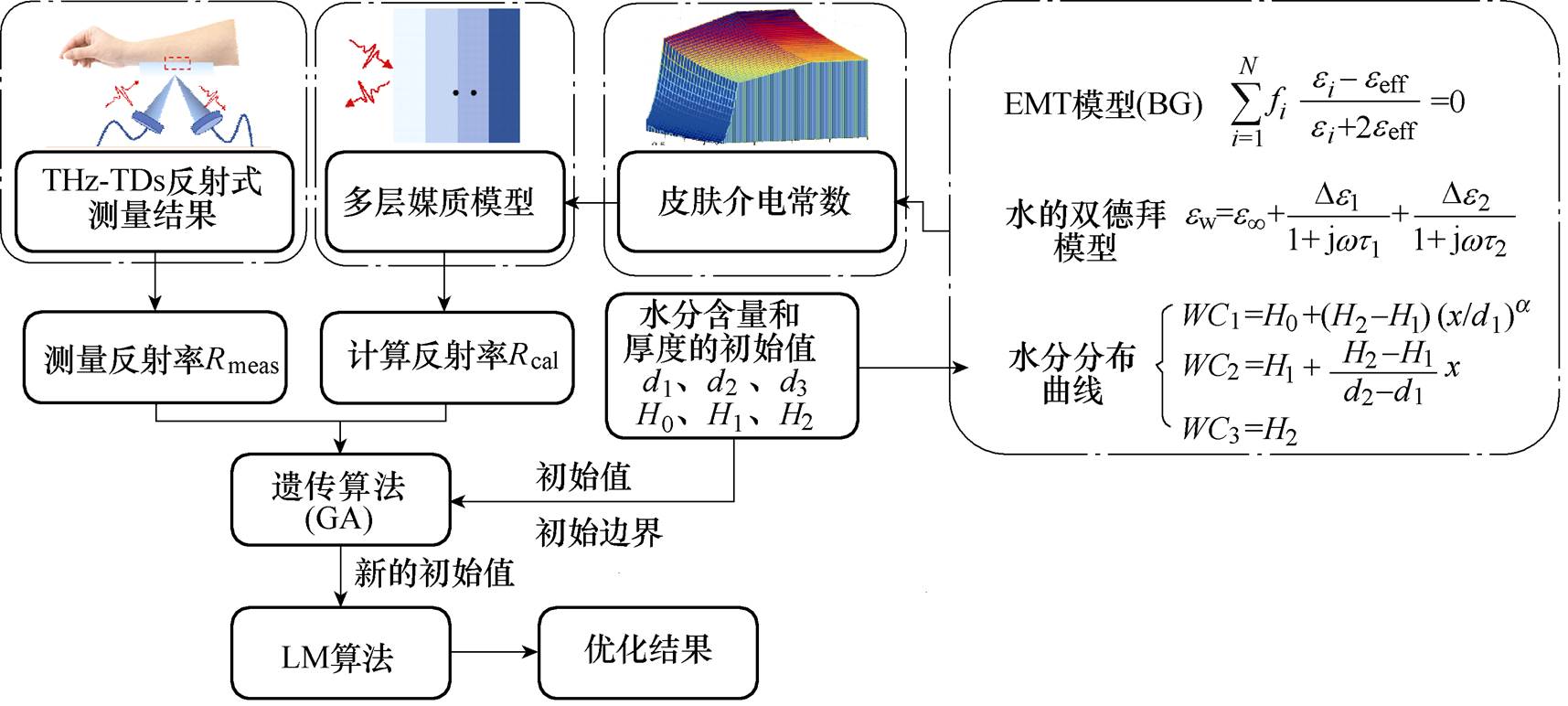
图5 水分含量评估算法流程
Fig.5 Flow chart of water concentration evaluational
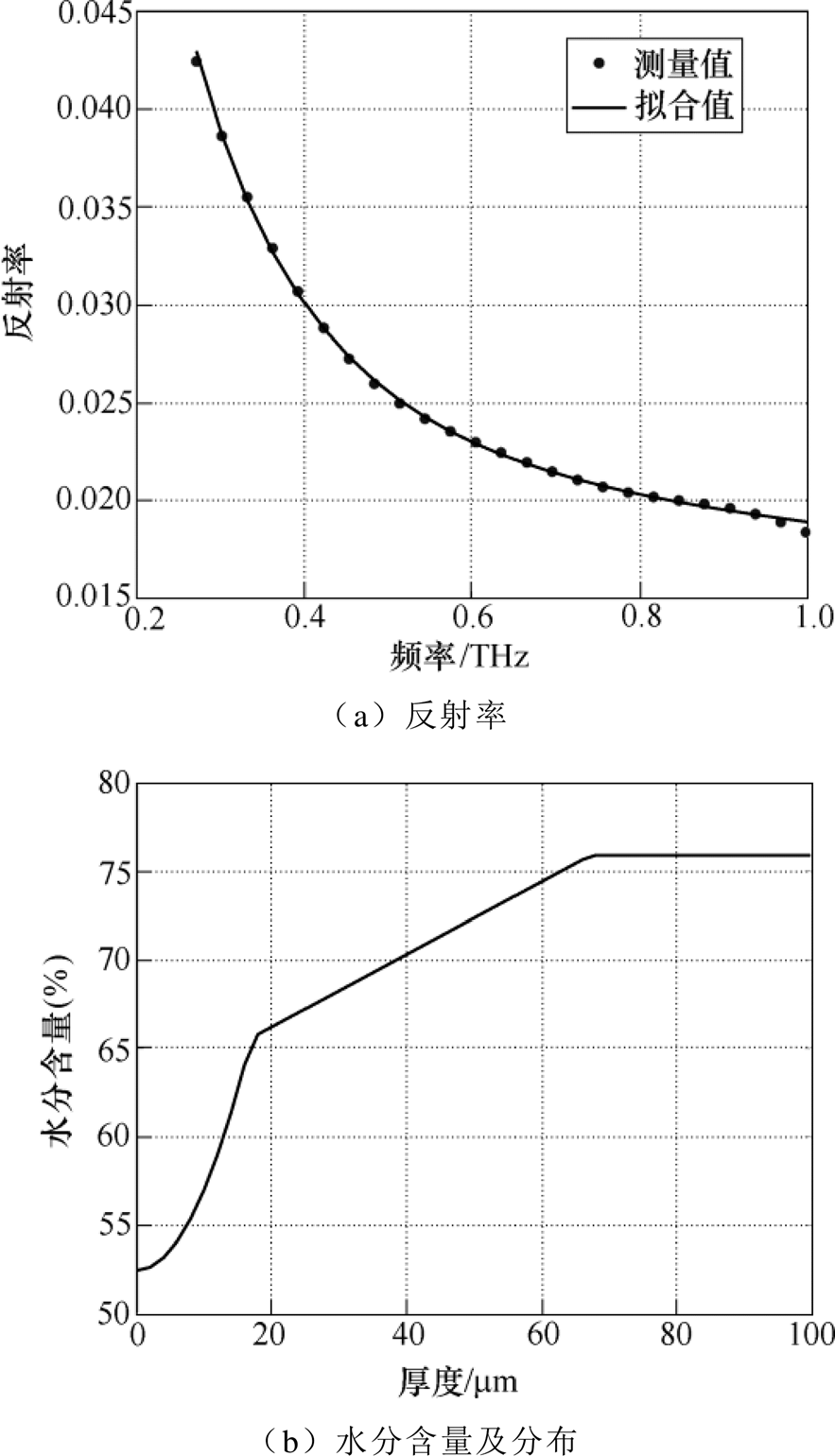
图6 拟合得到的反射率和水分分布
Fig.6 Fitted reflectivity and water distribution of skin tissue
将小手臂放置于石英样品窗,波形率设置为15,即每秒采集15个太赫兹波形取平均值后得到测量信号,重复次数设置为15次,因此每秒即可得到样品的一次测量信号。测量次数设置为600次,即总计测量时间为10min。由于皮肤表层被阻塞,与外界的水分交换极度减弱[19],皮肤尤其是角质层中水分开始快速增加。图7a、图7b分别展示了测量得到的不同时刻时域反射信号和时域信号峰峰值的变化趋势。
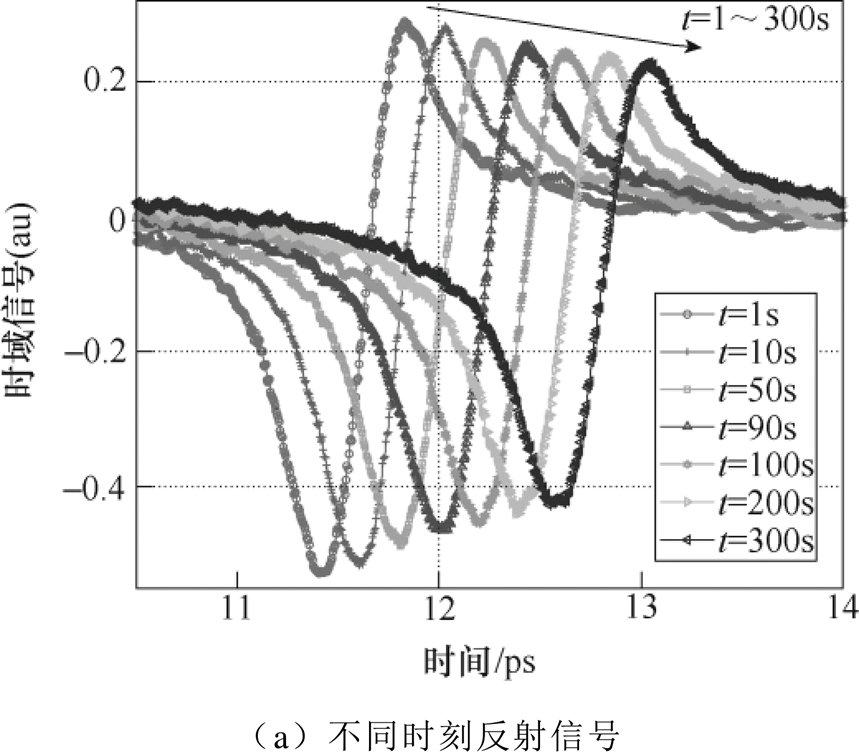
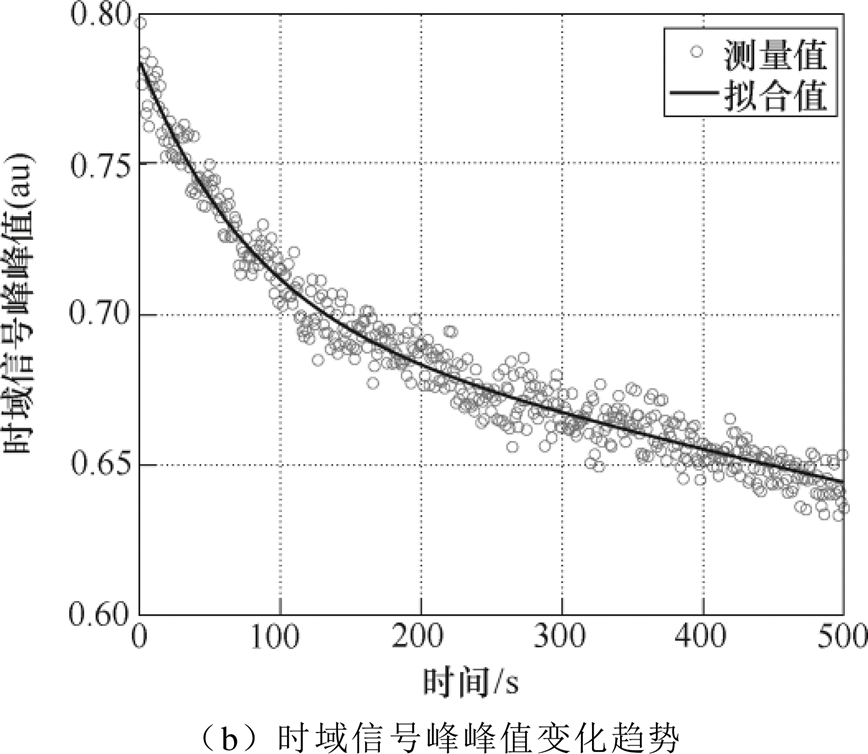
图7 不同时刻测量得到的时域反射信号和峰峰值
Fig.7 Measured reflection signals at different time and peak to peak value
时域波形的峰值逐渐下降,下降趋势也逐渐减弱。这是由于角质层中的水分增加,对太赫兹信号的吸收增强,但是随着水分含量的增加,水分累积的速度逐渐变慢。时域信号的峰峰值随阻塞时间的增长呈双指数函数下降趋势,其拟合函数为
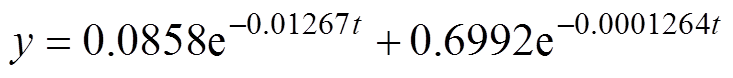 (11)
(11)式中,t为阻塞时间。测量得到不同时刻0.3~0.9THz频段的反射率如图8所示。图8a给出了不同频率下反射率随阻塞时间变化趋势,所有频率下的反射率均随着阻塞时间的增加而下降,并且下降趋势逐渐变缓。图8b中的圆圈和实线分别表示测量值和拟合值。随着阻塞时间的增加,反射率逐渐下降,第1s和第80s的反射率曲线差距巨大,这是因为皮肤表层初始含水量低,刚开始阻塞时,水分含量变化速度最快。但是其下降速度随着阻塞时间的增加而逐渐减小,即水分变化速度逐渐放缓,反射率曲线在0.5~0.9THz频段内有更清晰的分辨度。

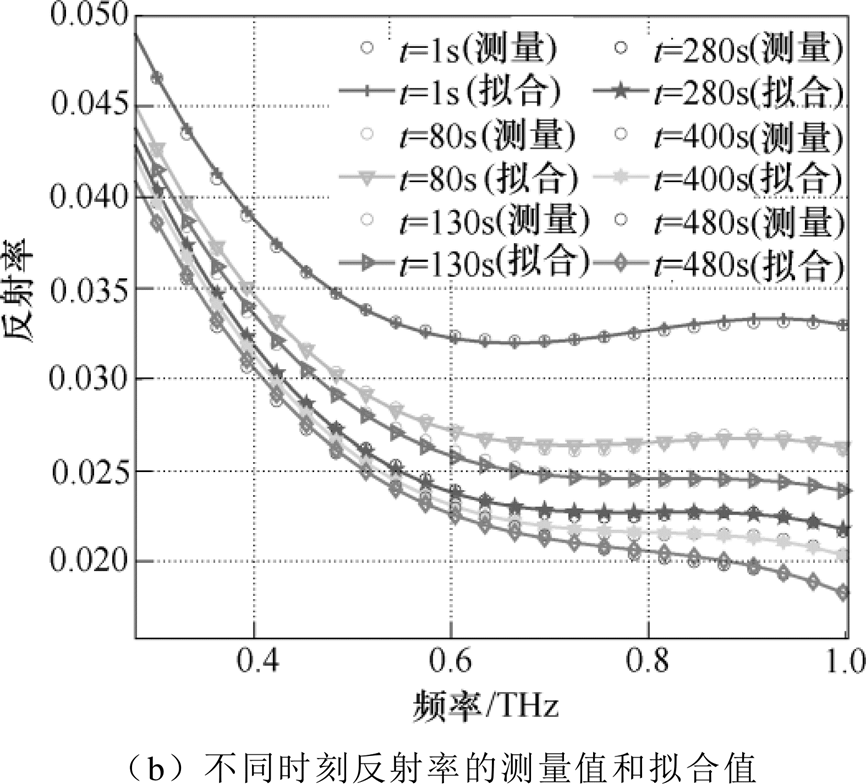
图8 不同频段和不同时刻的反射率
Fig.8 Reflectivity of different frequency and different time
采用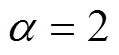 的水分初始假设分布曲线,对整个测量时间段内的皮肤水分含量进行评估,拟合得到的角质层表面水分含量变化如图9所示。角质层的水分含量随着阻塞时间成指数函数增加,最外层表面的皮肤水分从33.9%增加到了58.6%。拟合得到的增长曲线为双指数函数表达式为
的水分初始假设分布曲线,对整个测量时间段内的皮肤水分含量进行评估,拟合得到的角质层表面水分含量变化如图9所示。角质层的水分含量随着阻塞时间成指数函数增加,最外层表面的皮肤水分从33.9%增加到了58.6%。拟合得到的增长曲线为双指数函数表达式为
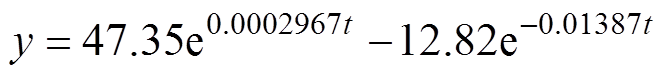 (12)
(12)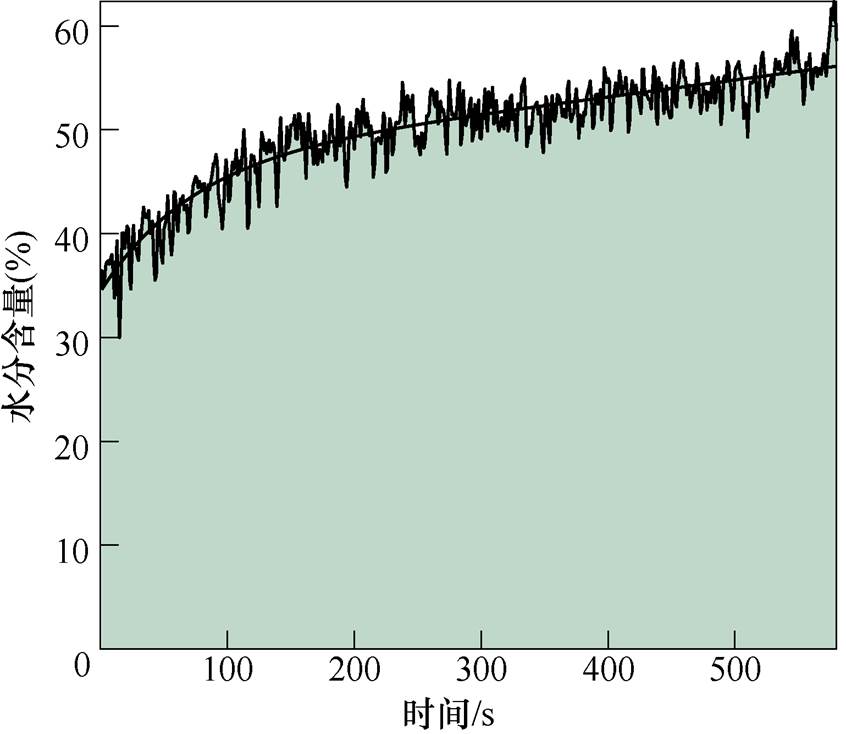
图9 角质层表面水分含量变化
Fig.9 Water concentration change of stratum corneum
表皮层和真皮层的水分变化很小,表皮层的水分含量在76%附近波动,厚度约为(68±8)mm。
定义每次拟合结果的相对误差为RE,计算表达式为
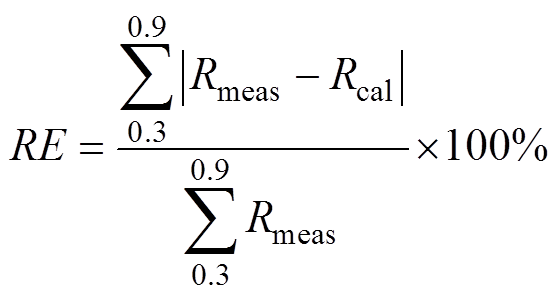 (13)
(13)不同时刻的拟合误差如图10所示,总体误差位于1%以内,说明拟合算法非常准确且稳定,可用于水分的动态持续监测。
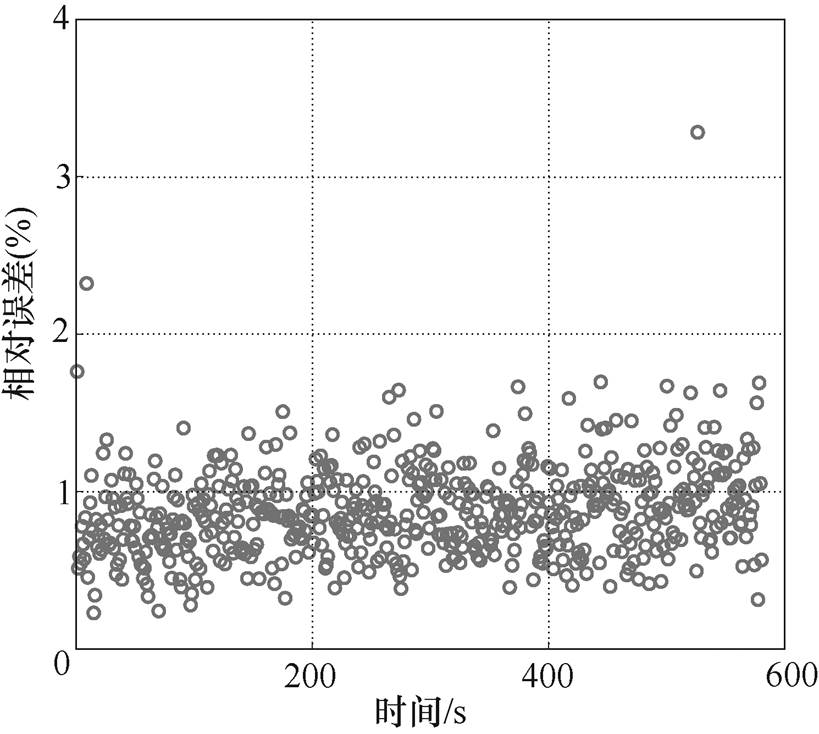
图10 不同时刻的拟合误差
Fig.10 Fitting error at different time
根据不同的初始水分含量分布规律,对不同时刻测量值进行拟合,有效介质模型均采用BG模型,不同水分分布规律下的拟合结果如图11所示。由图11a可知,当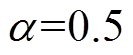 时,拟合得到的角质层表面水分含量为14.5%,明显低于其他两种模型,且
时,拟合得到的角质层表面水分含量为14.5%,明显低于其他两种模型,且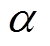 越大,拟合得到的初始值越高,但是真皮层水分含量比较接近。三种水分分布规律下的角质层表面水分增长曲线如图11b所示,拟合得到的角质层表面水分含量增长趋势均符合双指数增长,拟合得到的增长曲线为
越大,拟合得到的初始值越高,但是真皮层水分含量比较接近。三种水分分布规律下的角质层表面水分增长曲线如图11b所示,拟合得到的角质层表面水分含量增长趋势均符合双指数增长,拟合得到的增长曲线为
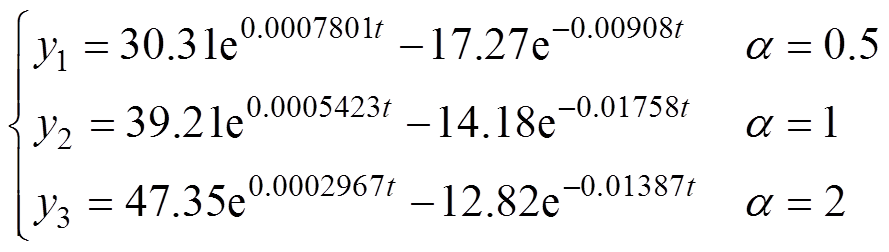 (14)
(14)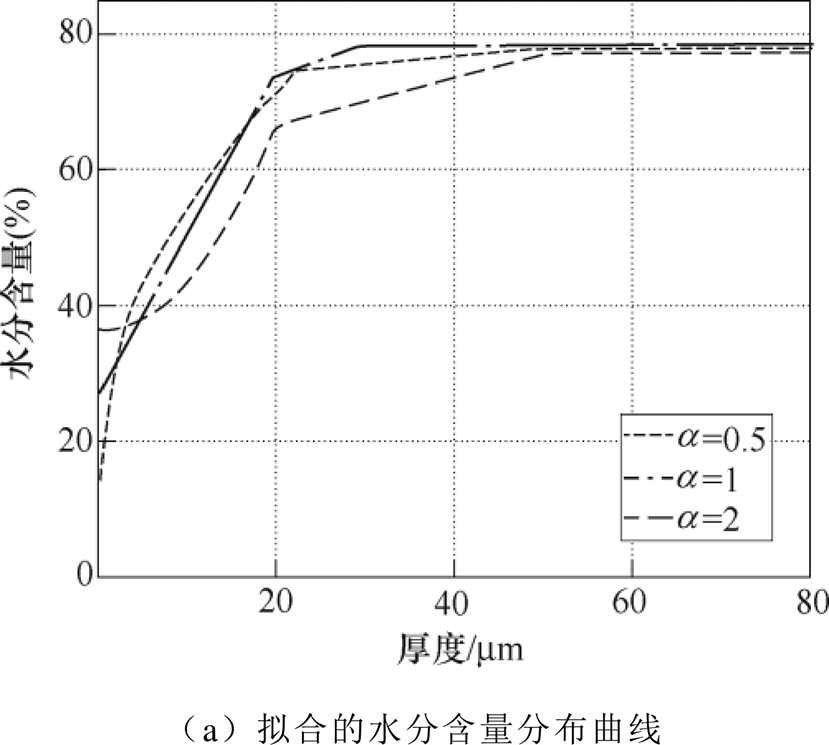
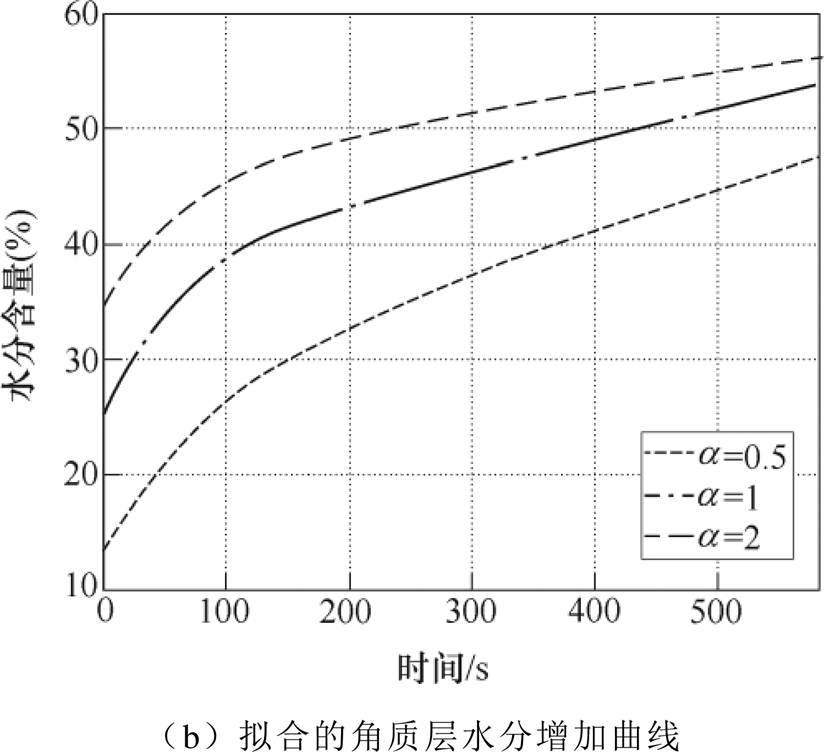
图11 不同水分分布规律下的拟合结果
Fig.11 Fitting results at different water distribution curve
当 =0.5, 1, 2时,整个测量时间段对应的角质层表面水分含量增幅分别为34.36%、28.40%和21.5%。由此可见,皮肤的初始水分分布规律对拟合结果影响很大,水分的增幅差距最大为12.86%。
=0.5, 1, 2时,整个测量时间段对应的角质层表面水分含量增幅分别为34.36%、28.40%和21.5%。由此可见,皮肤的初始水分分布规律对拟合结果影响很大,水分的增幅差距最大为12.86%。
不同有效介质模型具有各自的适用范围,皮肤中的细胞、蛋白等成分与水分的结合程度也会影响水分含量评估的结果。分别采用最常用的BG模型和LLL模型对整个测量时段内的皮肤水分含量进行评估,并分别考虑三种初始水分分布规律的情况,得到整个测量时间段内角质层表面水分含量变化曲线如图12所示。
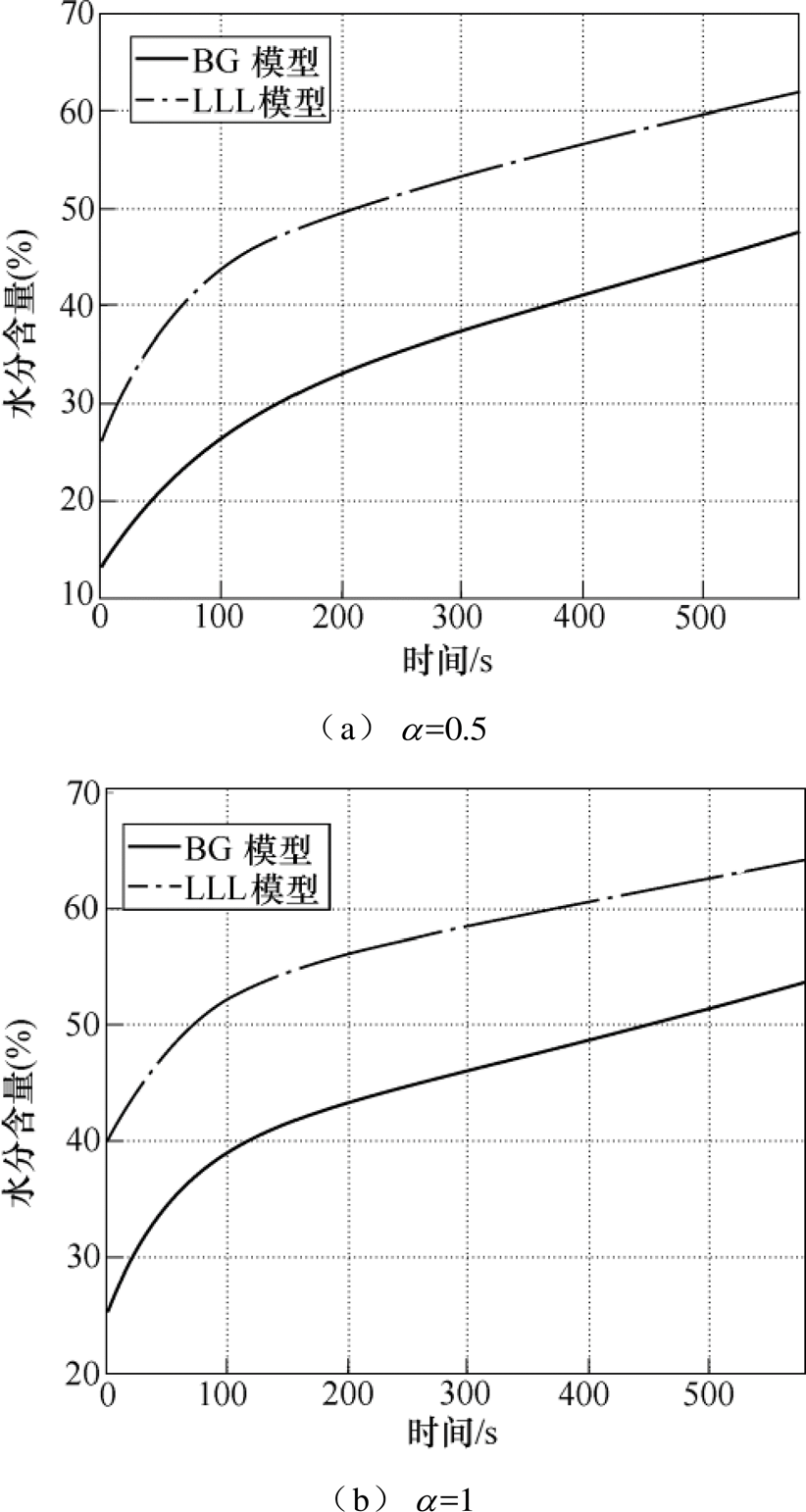
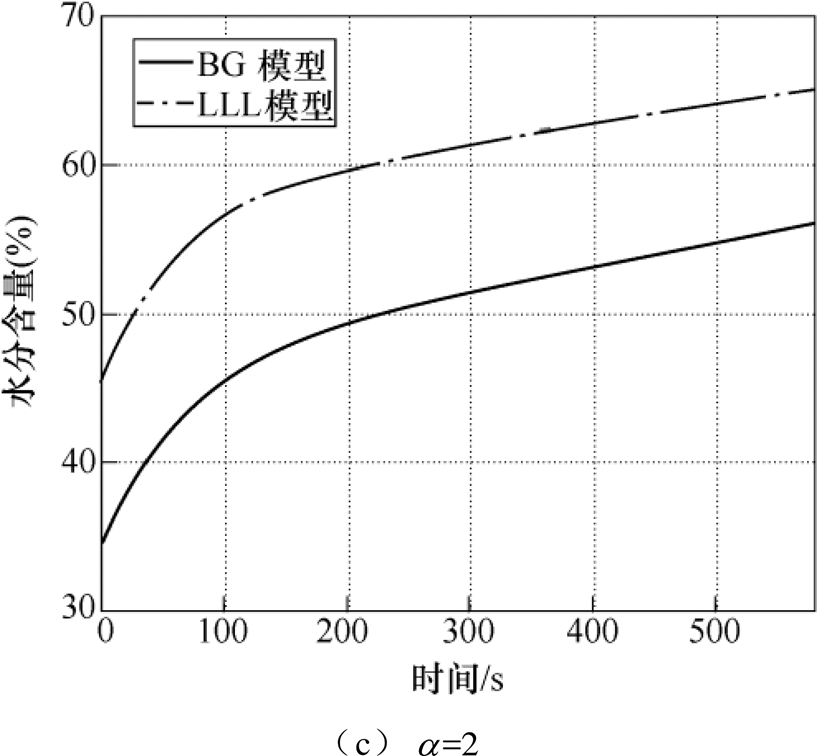
图12 BG模型和LLL模型拟合结果对比
Fig.12 Comparison of fitting results of BG model and LLL model
不论 取值多少,LLL模型拟合得到的角质层水分含量均远大于BG模型,水分含量的增长曲线仍然符合双指数函数。当
取值多少,LLL模型拟合得到的角质层水分含量均远大于BG模型,水分含量的增长曲线仍然符合双指数函数。当 =0.5、1和2时,LLL有效介质模型对应的角质层表面水分含量增幅分别为37.41%、26.71%和21.72%,与BG模型对应的增幅较为接近,绝对误差低于3.1%,说明了拟合结果的一致性。三种情况下的拟合相对误差也为1%左右,进一步证明了拟合算法具有良好的稳定性,不受水分分布规律和有效介质模型的影响,两种模型均能评估出一致的水分含量变化。
=0.5、1和2时,LLL有效介质模型对应的角质层表面水分含量增幅分别为37.41%、26.71%和21.72%,与BG模型对应的增幅较为接近,绝对误差低于3.1%,说明了拟合结果的一致性。三种情况下的拟合相对误差也为1%左右,进一步证明了拟合算法具有良好的稳定性,不受水分分布规律和有效介质模型的影响,两种模型均能评估出一致的水分含量变化。
1)本文提出了以皮肤表面反射率为优化目标的皮肤水分含量评估方法和GA-LM的混合优化算法,避免了每次拟合结果的不稳定,实现了皮肤水分含量变化的准确估计,拟合的反射率相对误差为1%。
2)皮肤角质层初始水分分布的规律假设对皮肤水分定量评估影响很大,当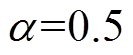 时,拟合得到的角质层水分含量最低;当
时,拟合得到的角质层水分含量最低;当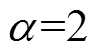 时,拟合得到的角质层水分含量最高。
时,拟合得到的角质层水分含量最高。
3)采用BG模型拟合得到的角质层表面水分绝对含量远低于LLL模型,更符合实际情况,但是二者拟合得到的水分含量的变化量较为接近,误差最大为3.1%。
研究结果表明,太赫兹时域光谱技术可以准确评估皮肤水分含量的变化,但需要选择确定的水分分布规律和有效介质模型,通过连续测量,最终可用于烧伤组织水肿演化过程的定量评估和实时 监测。
参考文献
[1] Qassem M, Kyriacou P. Review of modern techniques for the assessment of skin hydration[J]. Cosmetics, 2019, 6(19): 1-28.
[2] Batisse D, Giron F, Lévêque J L. Capacitance imaging of the skin surface[J]. Skin Research and Technology, 2006, 12(2): 99-104.
[3] Lévêque J L, Xhauflaire E, Pierard G. Skin capa- citance imaging, a new technique for investigating the skin surface[J]. European Journal of Dermatology, 2006, 16(5): 500-506.
[4] Farahmand S, Tien L, Hui X, et al. Measuring transepidermal water loss: a comparative in vivo study of condenser-chamber, unventilated-chamber and open-chamber systems[J]. Skin Research and Technology, 2009, 15(4): 392-398.
[5] Yoon H S, Baik S H, Oh C H. Quantitative measurement of desquamation and skin elasticity in diabetic patients[J]. Skin Research and Technology, 2002, 8(4): 250-254.
[6] Nam G W, Baek J H, Koh J S, et al. The seasonal variation in skin hydration, sebum, scaliness, brightness and elasticity in Korean females[J]. Skin Research and Technology, 2015, 21(1): 1-8.
[7] Klaassen M, De Vries E G, Masen M A. Interpersonal differences in the friction response of skin relate to FTIR measures for skin lipids and hydration[J]. Colloids and Surfaces B: Biointerfaces, 2020, 189: 110883.
[8] Mesrar J, Ognard J, Garetier M, et al. In vivo skin moisturizing measurement by high-resolution 3 Tesla magnetic resonance imaging[J]. Skin Research and Technology, 2017, 23(3): 289-294.
[9] 贺中华, 何为, 贺玉成, 等. 皮肤烧伤深度检测的单边核磁共振浅层成像磁体系统[J]. 电工技术学报, 2019, 34(3): 449-458.
He Zhonghua, He Wei, He Yucheng, et al. Unilateral nuclear magnetic resonance superficial imaging magnet system for skin burn depth assessment[J]. Transactions of China Electrotechnical Society, 2019, 34(3): 449-458.
[10] Mogensen M, Morsy H A, Thrane L, et al. Morphology and epidermal thickness of normal skin imaged by optical coherence tomography[J]. Derma- tology, 2008, 217(1): 14-20.
[11] Franzen L, Windbergs M. Applications of Raman spectroscopy in skin research-from skin physiology and diagnosis up to risk assessment and dermal drug delivery[J]. Advanced Drug Delivery Reviews, 2015, 89: 91-104.
[12] Sdobnov A Y, Tuchin V V, Lademann J, et al. Confocal Raman microscopy supported by optical clearing treatment of the skin influence on collagen hydration[J]. Journal of Physics D: Applied Physics, 2017, 50(28): 285401.
[13] 徐征, 吴嘉敏. 用于复合绝缘子伞裙老化状态检测的单边核磁共振传感器[J]. 电工技术学报, 2016, 31(12): 118-125.
Xu Zheng, Wu Jiamin. A portable unilateral nuclear magnetic resonance sensor used for detecting the aging status of composite insulator[J]. Transactions of China Electrotechnical Society, 2016, 31(12): 118- 125.
[14] Sun Qiushuo, He Yuezhi, Liu Kai, et al. Recent advances in terahertz technology for biomedical applications[J]. Quantitative Imaging in Medicine and Surgery, 2017, 7(3): 345-355.
[15] Bennett D B, Li W, Taylor Z D, et al. Stratified media model for terahertz reflectometry of the skin[J]. IEEE Sensors Journal, 2011, 11(5): 1253-1262.
[16] Taylor Z D, Singh R S, Bennett D B, et al. THz medical imaging: in vivo hydration sensing[J]. IEEE Transactions on Terahertz Science and Technology, 2011, 1(1): 201-219.
[17] Bajwa N, Sung S, Ennis D B, et al. Terahertz imaging of cutaneous edema: correlation with magnetic reso- nance imaging in burn wounds[J]. IEEE Transactions on Biomedical Engineering, 2017, 64(11): 2682-2694.
[18] Sun Qiushuo, Parrott E P J, He Yuezhi, et al. In vivo THz imaging of human skin: accounting for occlusion effects[J]. Journal of Biophotonics, 2017, 11(1): 1-8.
[19] Sun Qiushuo, Stantchev R I, Wang Jiarui, et al. In vivo estimation of water diffusivity in occluded human skin using terahertz reflection spectroscopy[J]. Journal of Biophotonics, 2019, 12(2): e201800145.
[20] Wang Jiarui, Stantchev R I, Sun Qiushuo, et al. THz in vivo measurements: the effects of pressure on skin reflectivity[J]. Biomedical Optics Express, 2018, 9(12): 6467-6476.
[21] Hernandez-Cardoso G, Rojaslanderos S C, Alfarogomez M, et al. Terahertz imaging for early screening of diabetic foot syndrome: a proof of concept[J]. Scientific Reports, 2017(7): 42124.
[22] 米彦, 彭文成, 芮少琴, 等. 高频纳秒脉冲串作用下皮肤肿瘤热效应的多参数有限元仿真与实验[J]. 电工技术学报, 2017, 32(22): 270-280.
Mi Yan, Peng Wencheng, Rui Shaoqin, et al. Thermal effects in skin tumor exposed to high-frequency nanosecond pulse bursts: multi-parametric finite element simulation and experiment[J]. Transactions of China Electrotechnical Society, 2017, 32(22): 270- 280.
[23] Zhai L, Adlhart C, Spano F, et al. Prediction of steam burns severity using Raman spectroscopy on ex vivo porcine skin[J]. Scientific Reports, 2018, 8(1): 6946.
[24] Smolyanskaya O A, Chernomyrdin N V, Konovko A A, et al. Terahertz biophotonics as a tool for studies of dielectric and spectral properties of biological tissues and liquids[J]. Progress in Quantum Electro- nics, 2018(62): 1-77.
[25] Scheller M, Wietzke S, Jansen C, et al. Modelling heterogeneous dielectric mixtures in the terahertz regime: a quasi-static effective medium theory[J]. Journal of Physics D: Applied Physics, 2009, 42(6): 065415.
[26] He Yuezhi, Liu Kai, Au C, et al. Determination of terahertz permittivity of dehydrated biological samples[J]. Physics in Medicine & Biology, 2017, 62(23): 8882.
[27] Zang Ziyi, Wang Jie, Cui Hongliang, et al. Terahertz spectral imaging based quantitative determination of spatial distribution of plant leaf constituents[J]. Plant Methods, 2019, 15(1): 1-11.
[28] 朱霄珣, 徐搏超, 焦宏超, 等. 遗传算法对SVR风速预测模型的多参数优化[J]. 电机与控制学报, 2017, 21(2): 70-75.
Zhu Xiaoxun, Xu Bochao, Jiao Hongchao, et al. Windspeed prediction method based on SVR and multi-parameter optimization of GA[J]. Electric Machines and Control, 2017, 21(2): 70-75.
[29] 郭宁明, 杨飞, 覃剑, 等. 基于遗传算法及信号谱分析的电网故障定位方法[J]. 电力系统自动化, 2016, 40(15): 79-85.
Guo Ningming, Yang Fei, Qin Jian, et al. Grid fault location method based on genetic algorithm and signal spectrum analysis[J]. Automation of Electric Power System, 2016, 40(15): 79-85.
Water Content Evaluation of Skin Tissue Based on Terahertz Time Domain Spectroscopy
Abstract Terahertz wave has shown a broad application prospect in the detection of moisture in biological tissues due to its unique moisture sensitivity. The combination of terahertz time domain spectroscopy (THz-TDs) and effective medium theory can be applied to evaluate the moisture content of skin, but its accurate and quantitative perception of changes in skin moisture content is still an unresolved problem. Therefore, a stable assessment method and the evaluation of its accuracy and influencing factors are needed. This paper defined three skin moisture content gradient distribution curves according to the structure of human skin tissue, and proposed a quantitative evaluation method of skin moisture content with reflectance as the optimization target, and then used a hybrid algorithm combining genetic and LM algorithm to solve the objective function. Using the reflection terahertz measurement system, an occluded forearm skin measurement experiment was carried out, and the variation law of the time-domain signal and reflectance was obtained. Finally, the influence of different initial water distribution laws and different effective medium models on the accuracy of skin moisture content assessment was discussed. The results show that the initial moisture distribution law and the selection of effective medium model both have a great influence on the evaluation results of the absolute moisture content, and the effective medium models have little difference on the moisture content change. Choosing a certain water distribution law and effective medium model can accurately evaluate the change of skin moisture content. This paper can provide theoretical support for terahertz detection of skin burns and skin diseases.
keywords:Terahertz time domain spectroscopy, water concentration of skin, effective medium model, reflectivity, hybrid algorithm
中图分类号:TM15
DOI: 10.19595/j.cnki.1000-6753.tces.191737
国家自然科学基金面上项目(51777023)和国网浙江省电力有限公司科技项目(5211DS18002W)资助。
收稿日期 2020-03-20
改稿日期 2020-07-20
杨 帆 男,1980年生,教授,博士生导师,研究方向为电磁场数值计算及其应用。E-mail: yangfancqu@cqu.edu.cn(通信作者)
余 晓 男,1993年生,博士研究生,研究方向为太赫兹光谱及其成像技术。E-mail: yuxiao@cqu.edu.cn
(编辑 陈 诚)