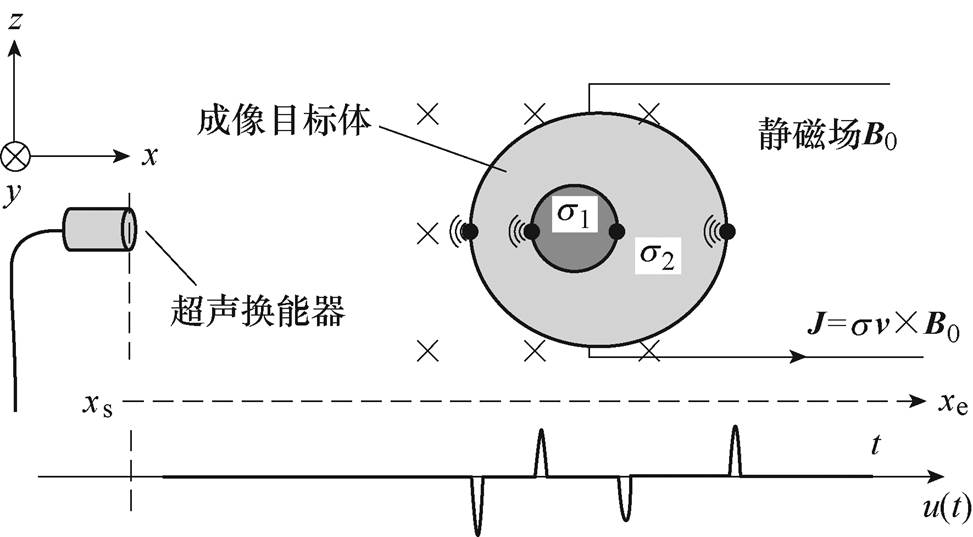
图1 磁声电成像技术示意图
Fig.1 The schematic diagram of MAET
摘要 新冠肺炎可引起肺水肿和肺实变,对肺部造成严重的损害。CT检测存在辐射,超声成像对轻症患者难以发挥作用。磁声电成像是一种典型的电磁和超声相互耦合的电特性成像技术,具有高空间分辨率和高对比度的优点,可检测肺部病变早期变化。该文介绍磁声电技术的原理,利用有限元分析软件建立肺水肿或肺实变前期模型和完全肺水肿或肺实变模型,仿真分析所建模型的磁声电信号并实现了B扫成像。仿真结果表明,肺部组织内的气体对超声波有反射作用,随着肺部组织内气体含量逐渐减少,肺部组织左边界上由反射超声波形成的脉冲信号幅值减小,肺部组织右边界上由绕射过含气组织的超声波增加产生的脉冲信号幅值增大。当肺部完全水肿或肺实变后,肺部组织内不再含有气体,由反射超声波引起的脉冲信号消失,可显示内部肿块的脉冲信号。该文通过仿真论述了磁声电成像技术在新冠肺炎临床应用中的潜力。
关键词:新冠肺炎 肺水肿 肺实变 磁声电成像 B扫图像
新冠肺炎为新型冠状病毒所致的肺炎,已在全球各地迅速蔓延,截止到2021年2月3日,全球共有104 379 504人感染,对全世界人民产生了重大影响。新冠肺炎病毒首先感染肺部,在早期使肺产生炎症性和渗出性病变,进而出现间质性改变,严重时会导致呼吸困难[1-2]。目前研究表明,肺部发生病变时,其影像学表现早于临床症状[3],且新冠肺炎病毒会导致心脏、肾脏等器官产生衰竭,利用影像学对多器官进行检测,可及时调整诊治和治疗策略,因此影像学的应用和研究具有重要的意义。
目前,应用于肺部检查的影像学手段主要包括CT成像和超声成像技术,两种成像技术在诊疗中发挥着重要的作用。CT成像技术可根据图像的不同区分新冠肺炎的早期、进展期和重症期。根据国家新型冠状病毒肺炎诊疗方案,肺部影像学显示急性渗出性病变明显改善为出院标准之一[4]。由于新冠肺炎的病灶在肺部周围增加了肺组织对超声波的穿透性,引起胸膜线以下回声异常变化,因此肺部超声成像技术通过回声改变呈现出的特殊“伪像”判断肺含水量是否增加、是否存在实变以及炎症程度等。超声成像可对不便移动的重症患者肺部病变进行实时动态的影像学检测和治疗后病情的评估,尤其是对于有基础性疾病的重症患者,可同时针对其他器官如心、肝、肾等进行检查,具有动态、实时、无创、可重复、床旁检查以及可远程会诊等优点[5-7]。
对于新冠肺炎的检测,CT成像技术存在辐射,确诊、治疗和出院检查会导致辐射量累积;超声成像可对重症患者检测,但对于感染早期或轻症患者,因声阻抗差异小,超声成像难以发挥作用。因此,对新冠病毒入侵后肺部发生变化的不同阶段,仍需要发展新的适宜的影像学方法。
研究发现,新冠病毒导致异常肺炎和呼吸系统破坏,气道出现黏液,肺泡隔血管充血、水肿[8],肝血窦充血,发生细胞浸润[9]。尽管此时声阻抗尚未发生变化或差异小,但组织的电特性已经发生了明显的变化[10]。以电特性为成像参数的功能成像方法,具备早期检测的潜力。
磁声电成像技术(Magneto-Acousto-Electrical Tomography, MAET)是一种典型的电磁和超声相互耦合的电特性成像方法,具有超声成像技术高空间分辨率和电阻抗成像技术高对比度的优点。
本文提出将磁声电成像技术用于新冠肺炎的检测,采用COMSOL软件建立肺部模型,利用磁声电技术对肺部模型进行相关仿真研究,得到其磁声电信号和磁声电B扫图像,并对仿真结果进行分析和总结。
磁声电成像技术示意图如图1所示,目标体被超声换能器产生的超声波激发,引发目标体内正负离子振动,振动离子在静磁场作用下受到洛伦兹力作用产生电荷分离,在目标体中形成随超声传播而变化的电流分布,通过电极[11-15]或线圈[16-17]检测相应的磁声电信号,利用检测到的信号实现B扫成像,反映目标体内部电特性变化。

图1 磁声电成像技术示意图
Fig.1 The schematic diagram of MAET
假定超声换能器产生的超声波沿ex方向传播,静磁场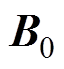 沿ez方向,大小为B0。超声波束从位置
沿ez方向,大小为B0。超声波束从位置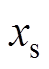 传播到位置
传播到位置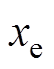 ,电极检测到的信号[18]为
,电极检测到的信号[18]为
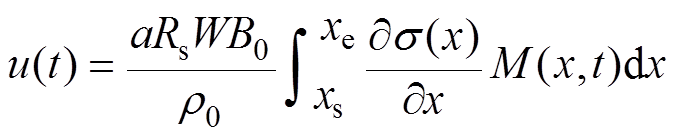 (1)
(1)式中,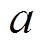 为采集系统采集到的电流比例;
为采集系统采集到的电流比例;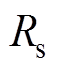 为采集系统的电阻;
为采集系统的电阻;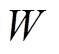 为超声波束宽度;
为超声波束宽度;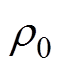 为目标体的静息质量密度;
为目标体的静息质量密度;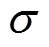 为目标体的电导率;
为目标体的电导率;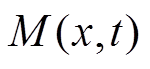 为超声波的动量。
为超声波的动量。
由式(1)可看出,在均匀介质中电极检测到的电压信号为零,而在电导率有变化的位置,电极检测到的电压信号不为零。将超声换能器放置于不同位置激励,采集多个一维电压信号,可利用采集到的信号得到磁声电的B扫图像。
肺部感染新冠肺炎后会逐渐产生水肿或肺实变。在感染新冠肺炎的早期和进展期,肺内水肿或肺实变的程度和范围比较小,肺内空气含量较多;而在感染新冠肺炎的重症期,肺内几乎完全水肿或肺实变,肺内气体消失。本文利用COMSOL软件分别建立肺组织水肿或肺实变前期模型(含气体肺部模型)和完全水肿或肺实变肺部模型,并利用磁声电技术对所建模型进行仿真研究,得到磁声电信号,进一步实现B扫成像。图2为建立的人体三维左侧肺部模型。
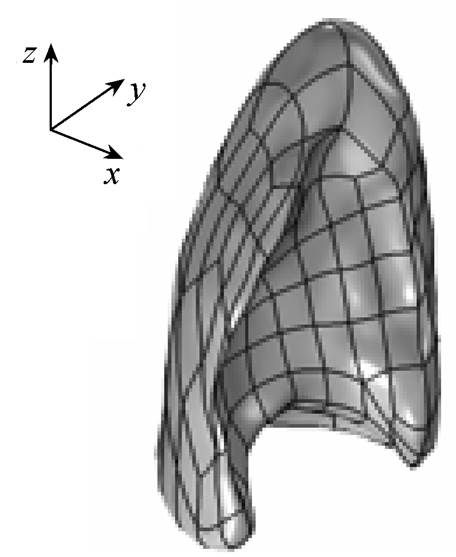
图2 三维肺部模型
Fig.2 Three dimensional lung model
肺部组织内气体含量随着肺部水肿或肺实变程度的增加而减少,下面仿真分析不同病变程度时磁声电信号的特点。选取图2三维肺部模型的一个断层面,建立图3所示的二维肺部模型。
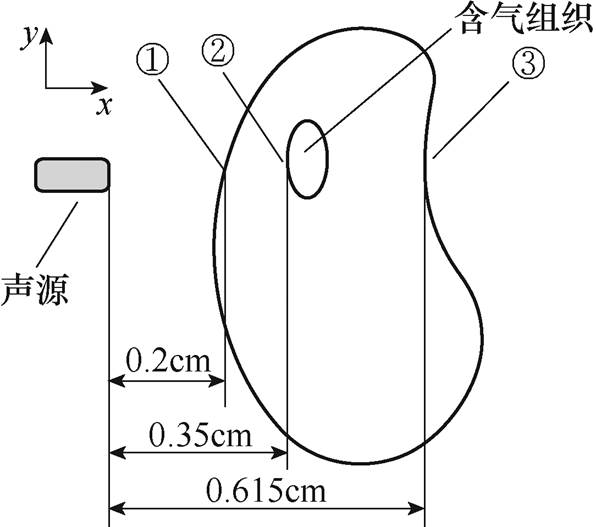
图3 肺组织水肿或肺实变前期模型
Fig.3 The early stage of pulmonary edema or consolidation model
超声换能器激励频率为2MHz,声源在y轴方向尺寸为0.1cm。肺中包含椭圆形含气组织,含气组织x轴尺寸为0.04cm。保持声源尺寸和含气组织x轴尺寸不变,通过设置含气组织y轴尺寸改变气体含量。声源置于去离子水中,其电导率为2×10-4S/m,模拟肺部组织电导率为0.2S/m。声源位置如图3所示,从声源发出的超声波沿x轴正向进入肺组织,图中边界①~③分别表示肺部组织左边界、含气组织左边界和肺部组织右边界。对如下两种情况分别进行仿真:
(1)含气组织y轴尺寸大于声源尺寸。在肺部组织水肿或肺实变前期,肺内气体含量较多。设置椭圆形含气组织y轴尺寸为0.18cm,此时含气组织y轴尺寸大于声源尺寸,仿真结果如图4所示。
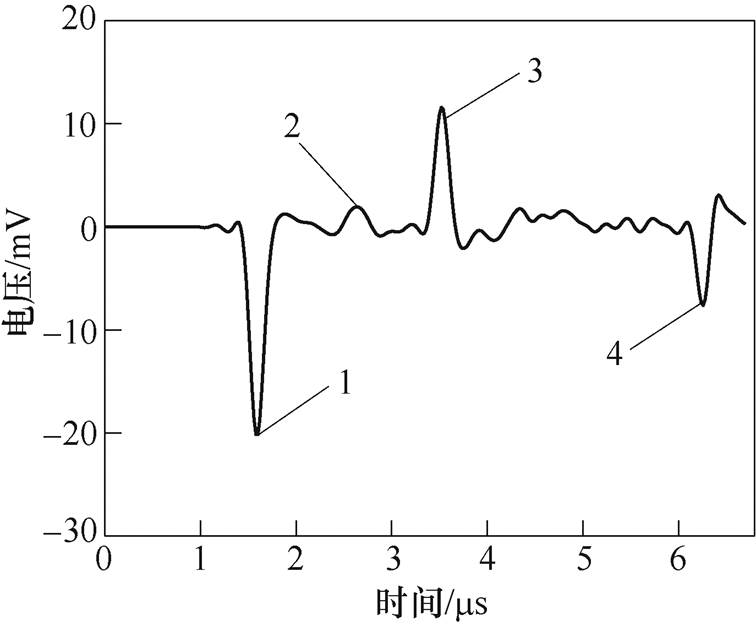
图4 含气组织y轴尺寸大于声源尺寸的磁声电信号
Fig.4 MAET signal of y axis size larger than sound source size
由式(1)可知,电极接收的脉冲信号仅在电导率变化的位置不为零,在电导率增大的分界面电极检测的信号幅值为负,在电导率减小的分界面电极检测的信号幅值为正。
图4仿真结果出现了4个正负不同的脉冲信号,图中标记为1~4。脉冲信号1对应图3边界①,从去离子水到肺部组织电导率增大,脉冲信号幅值为负;脉冲信号2对应边界②,从肺部组织到含气组织电导率减小,脉冲信号幅值为正;超声波传播到边界②时,几乎全部发生反射,脉冲信号3对应边界①,从肺部组织到去离子水电导率减小,脉冲信号幅值为正;反射后的超声波传播到超声换能器再一次反射到边界①,因此脉冲信号4对应边界①,从去离子水到肺部组织电导率增大,脉冲信号幅值为负。大部分超声波在超声换能器与含气组织边界②之间来回反射,直到反射超声波能量耗尽为止。肺内含气组织的存在对超声波具有反射作用,且含气组织y轴尺寸大于声源尺寸,声源几乎发生全反射,因此图4在肺部组织边界③处无脉冲信号。由于本文仿真时间截止到6.7ms,因此在仿真截止时间内只显示了两次由超声波反射所形成的脉冲信号。
(2)含气组织y轴尺寸小于声源尺寸。当肺部组织水肿或肺实变程度增加时,肺内气体含量减少。椭圆形含气组织y轴设置为0.04cm,此时含气组织y轴尺寸小于声源尺寸,仿真结果如图5所示。
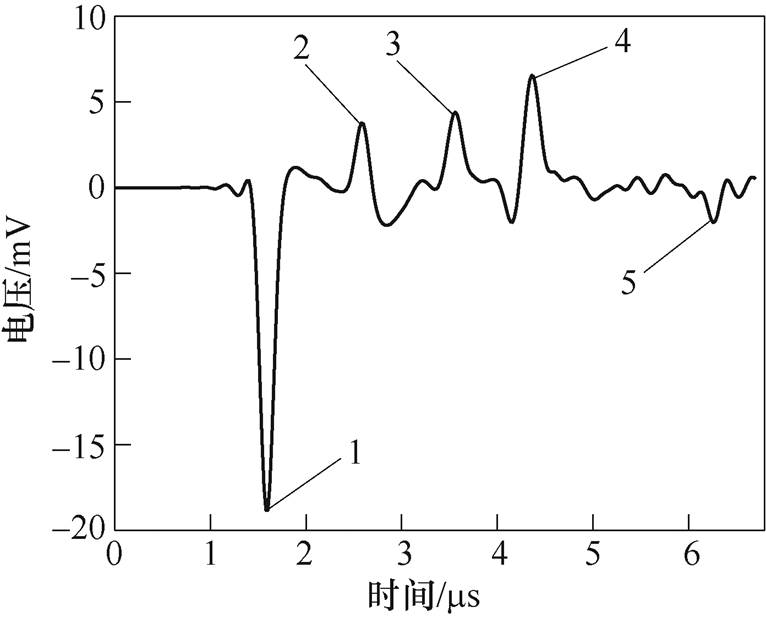
图5 含气组织y轴尺寸小于声源尺寸的磁声电信号
Fig.5 MAET signal of y axis size less than sound source size
图5中出现了5个正负不同的脉冲信号,图中标记为1~5。图5中的脉冲信号1、2、3、5与图4中的脉冲信号1、2、3、4相对应。图5中的脉冲信号4是绕射过含气组织的超声波到达边界③所产生的,此时电导率减小,脉冲信号幅值为正。肺内含气组织的存在对超声波具有反射作用,由于含气组织y轴尺寸小于声源尺寸,因此声源虽有衰减,但仍会绕射过含气组织,在边界③出现脉冲信号。与图4相似,在本文仿真截止时间内同样只显示了两次由超声波反射所产生的脉冲信号。
比较图4与图5仿真结果可知,肺内含气组织的尺寸影响磁声电信号的结果。当肺部处于水肿或肺实变前期,肺内存在较多气体,由于含气组织尺寸大于声源尺寸,超声波传播到边界②处几乎完全反射,因此图4在肺部组织边界③处无脉冲信号。随着肺部水肿或肺实变程度逐渐加重,肺内气体随之减少,肺内含气组织y轴尺寸小于声源尺寸,仿真结果如图5所示。由于含气组织y轴尺寸小于声源尺寸,因此只有一部分超声波发生了反射,使得图5中由反射超声波引起的脉冲信号3和脉冲信号5的峰值分别比图4中由反射超声波产生的脉冲信号3和脉冲信号4的峰值小。图5中绕射过含气组织的超声波在边界③出现了脉冲信号,而图4由于超声波在边界②几乎全反射,在边界③未出现脉冲信号。因此可根据磁声电信号幅值的不同来判断肺部组织内气体含量,从而判断肺部水肿或肺实变的程度。
当肺部完全水肿或肺实变时模型内不含气体,肺部组织内肿块位置电导率发生变化,建立如图6所示模型。圆形区域半径为0.08cm,电导率为0.32S/m,椭圆形区域x轴为0.12cm,y轴为0.24cm,电导率为0.4S/m。图中,边界①和④分别表示肺部组织的左、右边界,边界②和③分别代表圆形肿块的左、右边界,边界⑤和⑥分别代表椭圆形肿块的左、右边界。声源置于图6所示位置,沿x轴正向传播,仿真结果如图7所示。
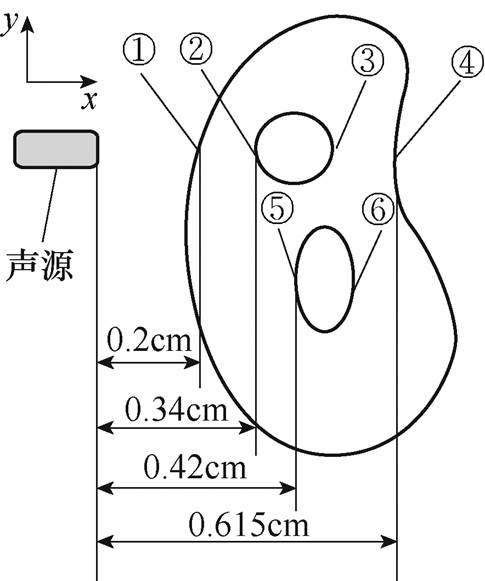
图6 肺部完全水肿或肺实变模型
Fig.6 Complete edema or consolidation of the lung model
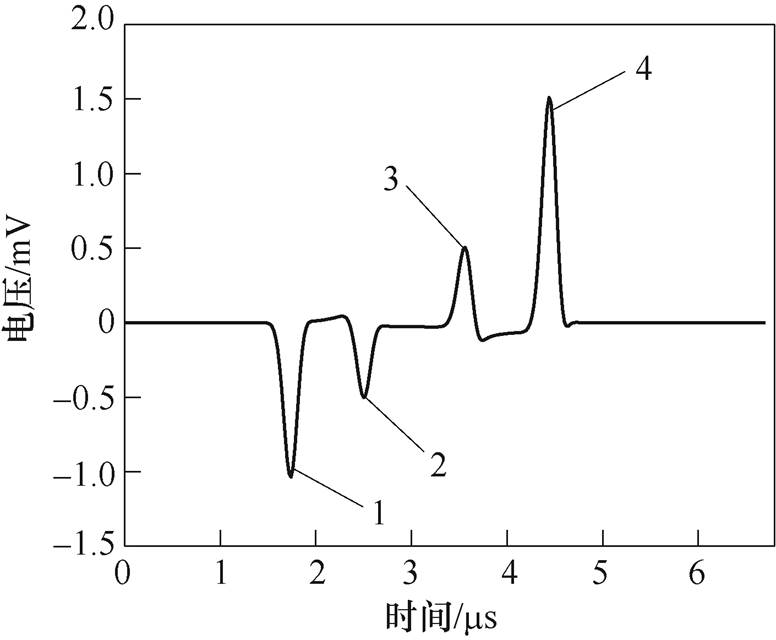
图7 肺部完全水肿或肺实变的磁声电信号
Fig.7 MAET signal of complete edema or consolidation of the lung
图7仿真结果出现了4个正负不同的脉冲信号,图中标记为1~4。4个电导率变化的边界对应4个极性不同的脉冲信号,第一个负向脉冲,对应电导率从去离子水(2×10-4S/m)增加到0.2S/m;第二个负向脉冲,对应电导率从0.2S/m变化到0.32S/m;第三个正向脉冲,对应电导率从0.32S/m变化到0.2S/m;第四个正向脉冲,对应电导率从0.2S/m变化到2×10-4S/m。电导率变化的大小会影响脉冲幅值的高低,因此可根据磁声电信号判断肺部完全水肿或肺实变以及肺部组织内肿块的位置和不同肿块的电导率大小和关系。
将声源移动至与椭圆形肿块相对的位置,由声源发出的超声波沿x轴正向进入肺组织,采用类似的方法,也可以分析在边界⑤和⑥的脉冲信号特点,本文不再赘述。
当肺部组织处于肺水肿或肺实变前期,肺部组织内气体较多,即含气组织尺寸大于超声换能器声源尺寸时进行磁声电B扫成像。模型如图3所示,椭圆形含气组织y轴尺寸为0.16cm,声源激发超声波沿x轴正向注入肺组织,并沿y轴方向以直线式扫描,移动距离为1cm,扫描步长为0.01cm,归一化的仿真结果如图8所示。
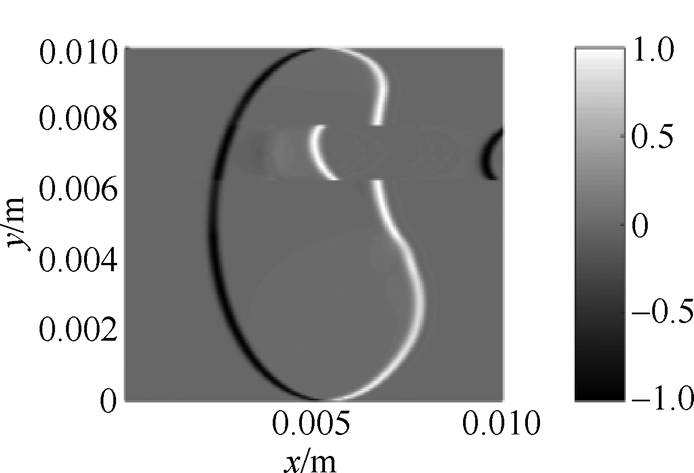
图8 肺组织水肿或肺实变前期模型的B扫图像
Fig.8 B-scan image of the early stage of pulmonary edema or consolidation
由图8可看出,超声波传播到图3中的边界①时信号幅值为负,表明边界①左侧电导率小于右侧电导率;超声波传播到图3中的边界②时遇到气体几乎全部反射,反射后的超声波传播到图3中的边界①时电导率变小,因此脉冲信号幅值为正,在图8中显示为肺中间的亮色线条。反射到图3中的边界①的超声波继续传播到超声换能器后再一次发生反射,沿x轴正向传播到图3中的边界①,此时电导率增大,脉冲信号幅值为负,在图8中显示为肺部组织右侧的暗色线条。
当肺部组织内不再含有气体,肺部完全水肿或肺实变后,肺部组织内肿块位置电导率发生变化,对图6所建模型进行磁声电B扫成像,扫描方式与含气体肺部模型一致,归一化的仿真结果如图9所示。
图9完整显示了肺部组织以及两个肿块的轮廓和位置。对应图6模型,在边界①、边界②和边界⑤处图9信号幅值为负,表明边界①、边界②和边界⑤处左侧电导率都小于右侧电导率。而在边界③、边界④和边界⑥处,图9中的脉冲信号幅值为正,表明边界③、边界④和边界⑥处左侧电导率都大于右侧电导率。

图9 完全水肿或肺实变模型的B扫图像
Fig.9 B-scan image of complete edema or consolidation of the lung
比较图8和图9磁声电B扫仿真结果可知,肺部组织内的气体对超声有反射作用,当肺部组织内存在较多气体时,含气组织y轴尺寸大于声源尺寸,由于超声波传播到图3中的边界②时几乎全反射,在椭圆气体y轴范围内肺部组织右边界即图3中的边界③脉冲信号不存在。而肺部完全水肿或肺实变后,肺部组织内不再含有气体,由超声波反射引起的脉冲信号消失,磁声电B扫图像完整显示了肺部组织以及两个肿块的轮廓和位置。
新冠肺炎可引起肺水肿或肺实变,本文主要利用磁声电技术对肺水肿或肺实变前期模型和完全肺水肿或肺实变模型进行有限元仿真分析研究。仿真结果表明:①超声波在肺水肿或肺实变前期模型传播时,肺部组织内的气体对MAET信号有反射作用;②随着肺部组织内气体含量逐渐减少,肺部组织左边界上由反射超声波形成的脉冲信号幅值减小,肺部组织右边界上由绕射过含气组织的超声波增加产生的脉冲信号幅值增大;③当肺部完全水肿或肺实变后,肺部组织内不再含有气体,由反射超声波引起的脉冲信号消失,可显示内部肿块的脉冲信号。
总之,可根据磁声电信号和图像的差异来判断肺部组织内气体含量,从而判断肺部水肿或肺实变的程度,还可检测肺内部肿块。本文对感染新冠肺炎的肺部模型的分析,可为磁声电技术检测肺部组织成像提供一定的参考指导作用。
参考文献
[1] Mauri T, Spinelli E, Scotti E, et al. Potential for lung recruitment and ventilation-perfusion mismatch in patients with the acute respiratory distress syndrome from coronavirus disease 2019[J]. Critical Care Medicine, 2020, 48(8): 1129-1134.
[2] 李芳, 吕平欣, 贺伟, 等. 胸部CT扫描显示簇状微结节样病灶对肺结核的诊断价值[J]. 中国防痨杂志, 2020, 42(3): 210-214.
Li Fang, Lü Pingxin, He Wei, et al. Diagnostic value of pulmonary tuberculosis with cluster-like micro- nodule in chest CT imaging[J]. Chinese Journal of Antituberculosis, 2020, 42(3): 210-214.
[3] Seo J K, Kim K C, Jargal A, et al. A learning-based method for solving ill-posed nonlinear inverse problems: a simulation study of lung EIT[J]. SIAM Journal on Imaging Ences, 2019, 12(3): 1275-1295.
[4] Zhang Xiangmin, Song Wei, Liu Xingli, et al. CT image of novel coronavirus pneumonia: a case report[J]. Japanese Journal of Radiology, 2020, 38(5): 407-408.
[5] Kurimoto N, Miyazawa T, Okimasa S, et al. Endo- bronchial ultrasonography using a guide sheath increases the ability to diagnose peripheral pulmo- nary lesions endoscopically[J]. Chest, 2004, 126(3): 959-965.
[6] Kuo C H, Lin Shumin, Chen H C, et al. Diagnosis of peripheral lung cancer with three echoic features via endobronchial ultrasound[J]. Chest, 2007, 132(3): 922-929.
[7] Lichtenstein D A. Ultrasound in the management of thoracic disease[J]. Critical Care Medicine, 2007, 35(5): S250-S261.
[8] Wang Chen, Horby P W, Hayden F G, et al. A novel coronavirus outbreak of global health concern[J]. Lancet, 395(10223): 470-473.
[9] Zhang Chao, Shi Lei, Wang Fusheng. Liver injury in COVID-19: management and challenges[J]. The Lancet Gastroenterology & Hepatology, 2020, 5(5): 428-430.
[10] Song Xizi, Xu Yanbin, Dong Feng, et al. An instrumental electrode configuration for 3-D ultra- sound modulated electrical impedance tomography[J]. IEEE Sensors Journal, 2017, 17(24): 8206-8214.
[11] Sun Zhishen, Liu Guoqiang, Xia Hui, et al. Lorentz force electrical- impedance tomography using linearly frequency- modulated ultrasound pulse[J]. IEEE Transactions on Ultrasonics Ferroelectrics & Frequency Control, 2018, 65(2): 168-177.
[12] Graslandmongrain P, Destrempes F, Mari J M, et al. Acousto-electrical speckle pattern in Lorentz force electrical impedance tomography[J]. Physics in Medicine and Biology, 2015, 60(9): 3747-3757.
[13] Li Yuanyuan, Liu Guoqiang, Xia Hui, et al. Numerical simulations and experimental study of magneto-acousto-electrical tomography with plane transducer[J]. IEEE Transactions on Magnetics, 2018, 54(3): 1-4.
[14] Li Yuanyuan, Song Jiaxiang. Three-dimensional model of conductivity imaging for magneto-acousto- electrical tomography[J]. Journal of Applied Physics, 2020, 127(10): 104701.
[15] 夏慧, 刘国强, 黄欣, 等. 基于互易定理的二维磁声电成像系统[J]. 电工技术学报, 2013, 28(7): 163-168.
Xia Hui, Liu Guoqiang, Huang Xin. 2D magneto- acousto-electrical tomography system based on reciprocity theorem[J]. Transactions of China Elec- trotechnical Society, 2013, 28(7): 163-168.
[16] Kaboutari K, Tetik A O, Ghalichi E, et al. Data acquisition system for MAET with magnetic field measurements[J]. Physics in Medicine and Biology, 2019, 64(11): 115016.
[17] Guo Liang, Liu Guoqiang, Xia Hui. Magneto- acousto-electrical tomography with magnetic induction for conductivity reconstruction[J]. IEEE Transactions on Biomedical Engineering, 2015, 62(9): 2114-2124.
[18] Wen Han, Shah J, S. Balaban R. Hall effect imaging[J]. IEEE Transactions on Biomedical Engineering, 1998, 45(1): 119-124.
Simulation of Lung Tissue Imaging Based on Magneto-Acousto-Electrical Technology
Abstract COVID-19 can cause pulmonary edema and pulmonary consolidation, causing serious damage to the lungs. CT is radioactive, and ultrasound imaging is difficult to play a role in patients with mild symptoms. Magneto-acousto-electrical tomography (MAET) is a typical electrical characteristic imaging technology that couples electromagnetic field and ultrasound. It has the advantages of high spatial resolution and high contrast, and can detect early-stage of lung lesions. In this paper, the principle of MAET is introduced, and the pre-pulmonary edema or pre-consolidation model and complete pulmonary edema or pulmonary consolidation model are established through finite element software. The MAET signal of the model is analyzed, and the B-scan imaging is realized. The simulation results show that the gas in the lung tissue has a reflection effect on ultrasound. As the gas content in the lung tissue decreases, the amplitude of the pulse signal formed by the reflected ultrasound on the left boundary of the lung tissue gradually decreases, while on the right boundary of lung tissue, the amplitude of pulse signal generated by the increase of ultrasonic diffraction through gassed tissue increases. When the lungs are completely edema or consolidation, the lung tissue no longer contains gas, the pulse signal caused by reflected ultrasound disappears, and pulse signal of internal mass can be displayed. The potential of MAET is discussed in the clinical application of COVID-19 through simulation.
keywords:COVID-19, pulmonary edema, pulmonary consolidation, magneto-acousto-electrical tomography, B scan image
中图分类号:TM12
DOI: 10.19595/j.cnki.1000-6753.tces.201248
国家自然科学基金资助项目(51937010)。
收稿日期2020-09-18
改稿日期 2020-09-26
李彩莲 女,1991年生,博士研究生,研究方向为磁声电成像技术。E-mail: 790062128@qq.com
刘国强 男,1971年生,研究员,博士生导师,研究方向为多物理场探测与成像。E-mail: liuguoqiang@mail.iee.ac.cn(通信作者)
(编辑 崔文静)