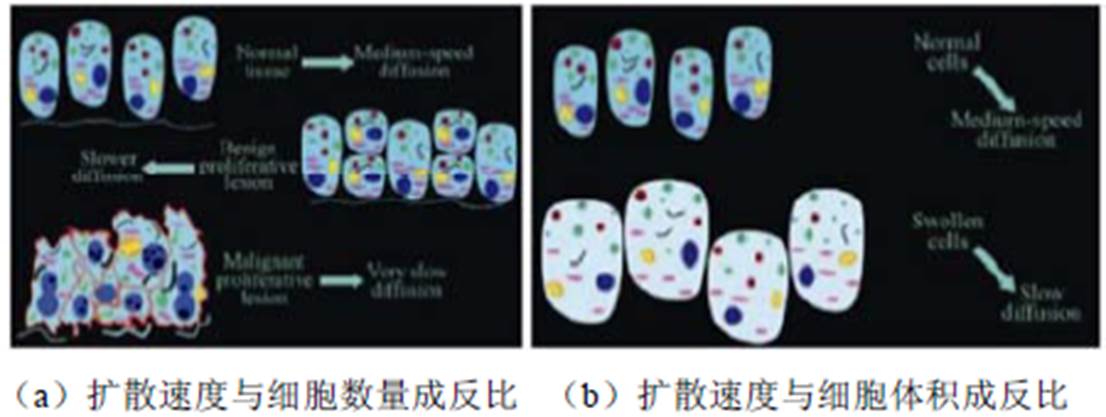
图1 扩散速度与细胞的关系
Fig.1 The relationship of speed of diffusion to the cells
摘要 功能磁共振成像(fMRI)作为一种非侵入性和非电离辐射成像,可对全身各系统疾病进行成像诊断,如心血管疾病、神经退行性疾病、肿瘤、创伤和炎症等。肿瘤是全球第二大死亡原因,各国科学家都致力于攻克肿瘤。通过fMRI对肿瘤进行成像,可实现肿瘤的分型、分级和分期,对制定治疗方案、评估疗效及预后等有重大作用。该文总结和探讨六种fMRI,包括弥散加权成像(DWI)、弥散张量成像(DTI)、灌注加权成像(PWI)、磁敏感加权成像(SWI)、磁共振波谱成像(MRS)和血氧水平依赖的功能磁共振成像(BOLD-fMRI),以及多模态正电子发射断层扫描/磁共振成像(PET/MRI)在肿瘤学领域的应用,并对其在相关治疗领域的应用前景进行 展望。
关键词:功能磁共振成像 多模态成像 肿瘤 正电子发射断层成像/磁共振成像
电磁学、影像学与生物医学在不断发展完善的同时也在推动生物电磁学向前发展。借助生物体自身电磁场和外加电磁场,与生物电磁有关的成像技术包括磁共振成像[1](Magnetic Resonance Imaging, MRI)、电阻抗成像[2-3](Electrical Impedance Tomography, EIT)和太赫兹波成像[4]等。目前常用的生物成像方法主要为X射线成像、计算机断层扫描成像(Computed Tomography, CT)、超声成像(Ultrasonic Imaging, US)、MRI、正电子发射断层成像(Positron Emission Tomography, PET)和光热成像。不同于X射线、CT和PET的电离辐射成像,MRI和US属于非电离辐射成像[5],即无需使用核素和射线,对人体更加安全。US利用多普勒效应进行成像,更适合于检测运动流体。而MRI则利用生物体中的质子进行成像,可对全身系统进行成像诊断。
肿瘤[6]作为中国乃至全世界第二大死亡原因,世界各国都投入了巨大的财力、物力和人力等资源支持其研究。目前判断是否为肿瘤以及分型、分级和分期最精准的方式为病理检查。病理组织切片虽能反映细胞组织形态的变化,却无法提供代谢相关信息。而肿瘤的代谢变化一般早于组织解剖的变化。MRI除具有无创检查,安全性高,对时间、空间和软组织分辨率高的优势外,还可利用磁共振波谱成像检测组织代谢物的变化,从而为肿瘤的早期诊断、分型、分级和分期、评估和预测疗效提供重要信息和判断依据,从而帮助医生为患者制定更为个性化的治疗方案。
因此,本文旨在对六种功能磁共振成像(functional MRI, fMRI)和多模态正电子发射断层扫描/磁共振成像(PET/MRI)的原理、特点和其在肿瘤方面的应用研究进行总结和梳理,并对其未来发展趋势和前景进行展望。
MRI是一种基于原子核(通常是氢核)在射频脉冲磁场下[7]产生核磁共振现象,利用空间信息编码信号,重建人体图像的成像方式。无外加磁场情况下,人体内质子随机排列,自旋产生的磁化矢量可相互抵消,宏观磁化矢量和为零。施加一个与质子同频率的外界磁场,质子由低能态跃迁到高能态,人体被磁化,产生纵向的宏观磁化矢量。由于不同组织质子密度和弛豫速度不同[8],MRI可利用此特性来区分不同组织。
fMRI在MRI的基础上进一步发展。传统磁共振成像主要呈现组织、器官等静态结构的解剖信息,很少包含代谢等过程的生理信息[9],已无法满足临床需求。fMRI可评估组织和器官的代谢等活动过程,提供更加丰富的信息。当前,fMRI主要分为扩散加权成像(Diffusion Weighted Imaging, DWI)、弥散张量成像(Diffusion Tensor Imaging, DTI)、灌注加权成像(Perfusion Weighted Imaging, PWI)、磁敏感加权成像(Susceptibility Weighted Imaging, SWI)、磁共振波谱(Magnetic Resonance Spectroscopy, MRS)成像和血氧水平依赖的功能磁共振成像(Blood Oxygen Level Dependent functional Magnetic Resonance Imaging, BOLD-fMRI)。
扩散是指分子的无规则运动,即布朗运动。DWI主要依据人体不同组织间水分子扩散速率的差异进行成像[10]。扩散速度与细胞的关系如图1所示[11],正常生理状态下,人体内水分子根据组织和结构特征进行扩散;发生病变后,同一区域内细胞体积增大或细胞数量增多[11],水分子的运动会受到一定影响,称之为扩散受限。这种变化可借助表观扩散系数(Apparent Diffusion Coefficient, ADC)进行分 析[12],如发生脑梗后,如图2所示[13],水分子扩散受限的区域在ADC图上呈现低信号。

图1 扩散速度与细胞的关系
Fig.1 The relationship of speed of diffusion to the cells

图2 急性梗塞
Fig.2 Acute infarct
除ADC外,b(弥散敏感系数)值、分子的各向异性和T2穿透效应等因素也会影响DWI序列的弥散信号。信号强度以灰度的形式反映于图像中。通过对比DWI和ADC图像信号的差异,医生可分析患者病情。DWI除应用于中枢神经系统疾病[14],如脑卒中、颅内肿瘤、多发性硬化等研究外,在区分良恶性肿瘤、肿瘤分型、分级和分期、评估和预测疗效等[15]方面也扮演着越来越重要的角色。
DTI是在DWI的基础上,利用水分子的各向异性进行成像。均匀介质中,分子向各个方向运动的机会均等。非均匀介质中,分子会在扩散方向上有所侧重。大脑中水分子沿神经束纵向扩散[14],而非自由扩散。脑白质在神经纤维[16]平行方向的扩散速度快于垂直方向。通过彩色标记,可反映脑白质的空间方向性。相比于DWI的二维成像,DTI可增加扩散梯度,研究水分子的三维扩散[10],获取更多有关病灶部位的空间信息。
PWI主要通过施加外界磁场,利用对比剂对血管及灌注状态进行高时间分辨率[15]成像。对比剂可增强血管内部的磁敏感性,引起体内磁场变化和质子自旋失相,并缩短弛豫时间(T1或T2)。对磁化率效应敏感的回波平面成像(Echo Planar Imaging, EPI)技术可将对比剂浓度变化转化为弛豫时间变化,获得时间-浓度曲线,定量分析脑血容量(Cerebral Blood Volume, CBV)、脑血流量(Cerebral Blood Flow, CBF)、平均通过时间(Mean Transit Time, MTT)等参数,评价组织血流灌注状态。根据对比剂性质的不同,PWI可分为使用外源性对比剂(通常为钆喷酸葡胺, Gadopentetate Dimeglumine, Gd- DTPA)的动态增强成像和利用自身动脉血标记的动脉自旋标记(Arterial Spin Labeling, ASL)成像[17]。除Gd-DTPA外,顺磁性细胞外对比剂包括钆特酸葡胺、钆双胺;特异性对比剂主要有高特异性的钆塞酸二钠和特异性稍低的钆贝普胺。动态增强又可分为动态敏感性灌注加权成像(Dynamic Susceptibility Perfusion Weighted Imaging, DSC-PWI)和动态对比增强灌注加权成像(Dynamic Contrast Enhanced Perfusion Weighted Imaging, DCE-PWI)。外源性成像研究多聚焦于脑卒中、脑肿瘤血液供应、心脏、肾脏和肝脏血流灌注及肿瘤分级、组织学评估[18]等方面。
SWI是一种利用磁敏感物质的内在特性,增强静脉与周围组织对比度的成像方式[18]。去氧血红蛋白和氧合血红蛋白是人体中最常见的磁敏感物质。顺磁性的去氧血红蛋白中,Fe2+含有4个未成对电子,易造成局部磁场不均匀,缩短横向弛豫时间T2。反磁性的氧合血红蛋白无未成对电子,对质子弛豫时间无影响。目前,SWI广泛应用于静脉中的去氧血红蛋白、铁沉积[19]、出血、微出血和钙化等方面的临床研究。利用SWI中磁矩图和相位图的信息,可定性分析组织磁场的变化[20]。联合定量磁敏感成像(Quantitative Susceptibility Mapping, QSM)技术可进一步获得更为量化的信息。
MRS是一种利用磁共振化学位移,定量分析体内代谢物质含量变化的技术。用于MRS研究的物质,质子数一般为奇数,主要有1H、13C、19F、23Na和31P。目前临床上应用的主要为1H-MRS和31P-MRS。1H-MRS常用于脑部、乳腺和前列腺,用于检测脂肪、氨基酸、酮体等物质的代谢产物,包括N-乙酰天门冬氨酸(NAA)、肌酸(Cr)、胆碱(Cho)和肌醇(mI)等。31P-MRS通过检测磷酸单酯(PME)、无机磷(Pi)、磷酸二脂(PDE)、磷酸肌酸(PCr)、三磷酸腺苷等物质了解机体能量代谢过程。13C-MRS主要标记物为丙酮酸、乳酸和谷氨酰胺,目前在临床应用极少。体内19F的浓度极低,因此19F-MRS采用静脉注射氟辛基溴化物(PFOB)或全氟-15-冠乙醚(PFCE)增强图像对比。23Na-MRS可检测生物体内Na+浓度及其分布,主要用于研究Na-K泵的相关信息。
发生病变时,因病变组织的代谢变化早于解剖变化[9],MRS诊断比传统MRI更具优势。通过分析代谢物质或中间产物的变化,MRS可用于疾病的早期诊断、观察疾病进展、监测治疗、了解疾病的发病机制[9]。
BOLD-fMRI主要是利用人体内源性对比剂血红蛋白在不同状态下磁性不同的性质[21],对比血氧饱和度来进行成像。血红蛋白主要有氧合血红蛋白和去氧血红蛋白两种存在形式。氧合血红蛋白与去氧血红蛋白的比例决定了信号强度[10]。去氧血红蛋白是一种顺磁性物质,其在外加磁场作用下能够使血管及其周围产生局部梯度磁场,质子快速失相,T2W1信号降低。当脑部受到刺激后,局部血流量增加[22],氧合/去氧血红蛋白比例相对增加,T2W1信号增强[23],局部MRI信号也会相应增强。一般使用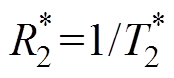 作为相关评价指标。
作为相关评价指标。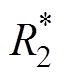 为横向弛豫率,
为横向弛豫率,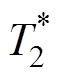 为横向弛豫时间。
为横向弛豫时间。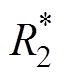 与组织中的含氧量呈负相关。
与组织中的含氧量呈负相关。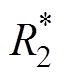 值越大,含氧量越低;反之则越高。M. L. Naik等[24]利用BOLD-fMRI对肝癌患者进行评估后发现,肝癌组织的
值越大,含氧量越低;反之则越高。M. L. Naik等[24]利用BOLD-fMRI对肝癌患者进行评估后发现,肝癌组织的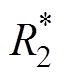 值低于正常组织。脑皮质激活虽然能够引起血液中含氧量的变化,但脑皮质中含氧量发生变化并不意味着脑皮质激活,存在激活区被误判的风险。未来如何通过技术迭代、利用诊断经验等方式减少误判风险也是需要重点考虑的问题。
值低于正常组织。脑皮质激活虽然能够引起血液中含氧量的变化,但脑皮质中含氧量发生变化并不意味着脑皮质激活,存在激活区被误判的风险。未来如何通过技术迭代、利用诊断经验等方式减少误判风险也是需要重点考虑的问题。
肿瘤已成为全球范围内除心脑血管外的第二大死亡原因。数据显示[25],国内心血管疾病死亡率占居民死亡40%以上,且心血管患病率和死亡率仍处在上升阶段。最新癌症统计数据显示[26],2015年全国新发恶性肿瘤329.9万例,233.8万人死于肿瘤,占全部死亡人数的23.9%。在老龄化速度加快、环境恶化、生活压力增大等多重因素作用下,肿瘤的发病率和死亡率分别以3.9%和2.5%的平均年复合增长率增长。
在中国及全球肿瘤发病率和死亡率如此严峻的情况下,采用无创无辐射的成像方式进行早期诊断,确定肿瘤分型、分级和分期,评估疗效及预后,对患者和医生都具有重要意义。MRI虽多用于神经系统疾病,如脑卒中、阿尔兹海默、帕金森、多发性硬化等,但功能和技术的不断完善,使其在肿瘤领域的作用愈来愈凸显。各fMRI成像原理和特点不同使其在肿瘤领域的应用范围也不尽相同。目前临床上使用较多的DWI和PWI,其他几种功能成像也在肿瘤领域积极探索。
DWI的信号强度能够反映出组织密度[27],可用以区分良恶性病变,确定肿瘤分型、分级和分期,评估疗效及预后,也便于在随访中检测可能存在的残留/复发/转移的肿瘤。
研究表明,DWI对胸腹腔肿瘤如肺癌和肝癌等之外的肿瘤具有良好的检测效果[28]。正常组织发生病变后,病变组织中水分子扩散受限,因此,ADC值一般低于正常组织或良性病变。功能磁共振图像参数结果见表1[29],良性软组织肿瘤和恶性软组织肿瘤的ADC信号值虽会有部分重叠,依旧能观察到恶性软组织肿瘤的ADC显著低于良性病变组织。
表1 功能磁共振图像参数结果
Tab.1 Results of parameters for fMRI
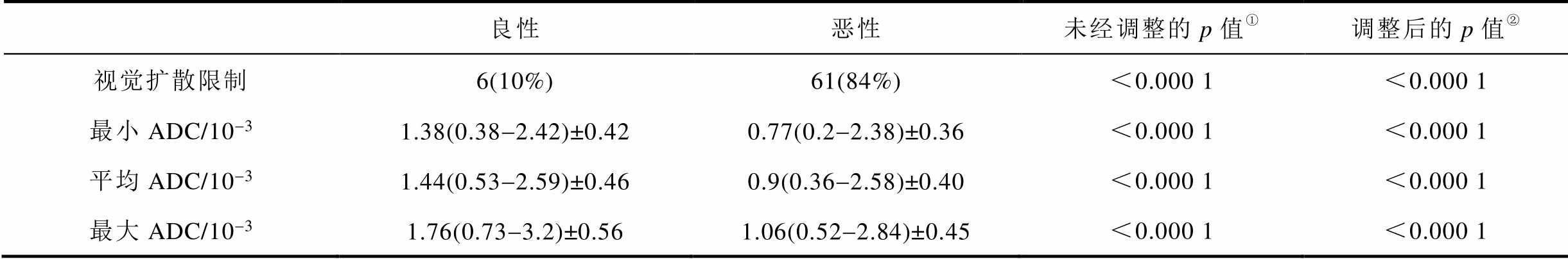
良性恶性未经调整的p值①调整后的p值② 视觉扩散限制6(10%)61(84%)<0.000 1<0.000 1 最小ADC/10-31.38(0.38-2.42)±0.420.77(0.2-2.38)±0.36<0.000 1<0.000 1 平均ADC/10-31.44(0.53-2.59)±0.460.9(0.36-2.58)±0.40<0.000 1<0.000 1 最大ADC/10-31.76(0.73-3.2)±0.561.06(0.52-2.84)±0.45<0.000 1<0.000 1
①p值来源于卡方检验和双样本t检验。
②p值来源于调整后的年龄和性别的多元数据回归分析。
良恶性嗜铬细胞瘤患者的ADC如图3所示[30]。Dong Yin等[30]使用3T MRI扫描仪对40位患者诊断后发现,恶性嗜铬细胞瘤的ADC显著高于良性病变(p<0.001 。图3a为44岁女性,良性嗜铬细胞瘤,肿瘤(ROI 1和ROI 2)的ADC值分别为0.930× 10-3mm2/s和0.825×10-3mm2/s。肾实质(ROI 3)的ADC值为1.847×10-3mm2/s。图3b为33岁女性,恶性嗜铬细胞瘤患者。肿瘤(ROI 1)的ADC值为1.294× 10-3mm2/s,肾实质(ROI 2)和脾实质(ROI 3)的ADC分别为1.820×10-3mm2/s和0.826×10-3mm2/s。
。图3a为44岁女性,良性嗜铬细胞瘤,肿瘤(ROI 1和ROI 2)的ADC值分别为0.930× 10-3mm2/s和0.825×10-3mm2/s。肾实质(ROI 3)的ADC值为1.847×10-3mm2/s。图3b为33岁女性,恶性嗜铬细胞瘤患者。肿瘤(ROI 1)的ADC值为1.294× 10-3mm2/s,肾实质(ROI 2)和脾实质(ROI 3)的ADC分别为1.820×10-3mm2/s和0.826×10-3mm2/s。
T. Mickael等[31]利用ADC对肾透明细胞癌(ccRCC)和其他肾癌亚型分析后发现,相比于整体ADC,排除囊肿和坏死区的ADC可更精准地识别ccRCC。诊断胸腹腔病变时,DWI信号受到心脏搏动、胃肠蠕动和呼吸等方面影响,会产生伪影或模糊[32],一定程度上影响了诊断的准确性。
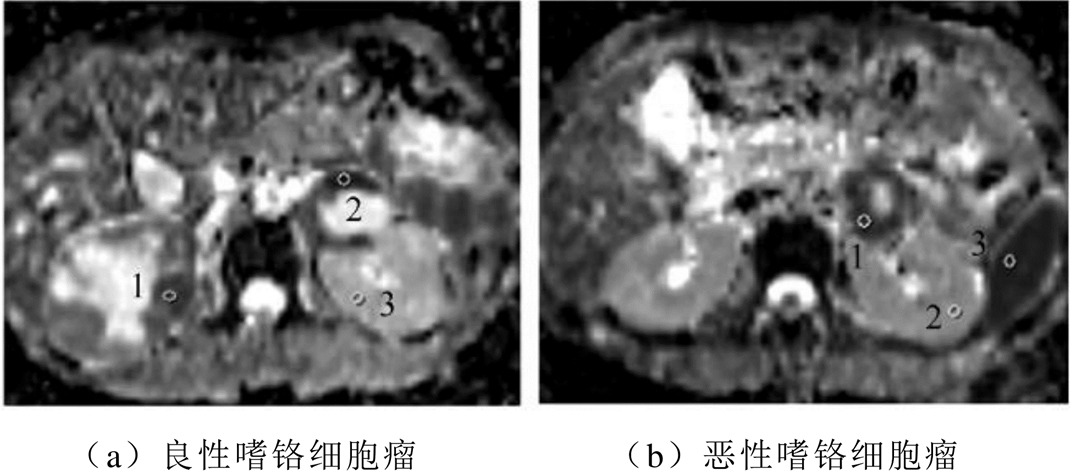
图3 良恶性嗜铬细胞瘤患者的ADC
Fig.3 ADC images of benign and malignant pheochromocytomas
Wang Jifei等[27]研究了12位骨肉瘤患者新辅助化疗后ADC值与组织病理学亚型之间的关系。选择的切片样本可分为四种类型,包括非软骨活性肿瘤、非软骨肿瘤细胞坏死、软骨活性肿瘤和囊性/出血性坏死样本。箱型图比较不同组织病理区域ADC值的差异,囊性区ADC值最高,非软骨瘤最低,如图4所示[27],非软骨活性肿瘤样本的ADC值显著低于其他三类样本(p<0.05 。非软骨肿瘤细胞坏死样本的平均ADC值显著低于软骨活性肿瘤和囊性/出血性坏死肿瘤(p<0.001),但软骨活性肿瘤和囊性/出血性坏死样本的ADC值无显著性差异(p>0.05)。
。非软骨肿瘤细胞坏死样本的平均ADC值显著低于软骨活性肿瘤和囊性/出血性坏死肿瘤(p<0.001),但软骨活性肿瘤和囊性/出血性坏死样本的ADC值无显著性差异(p>0.05)。
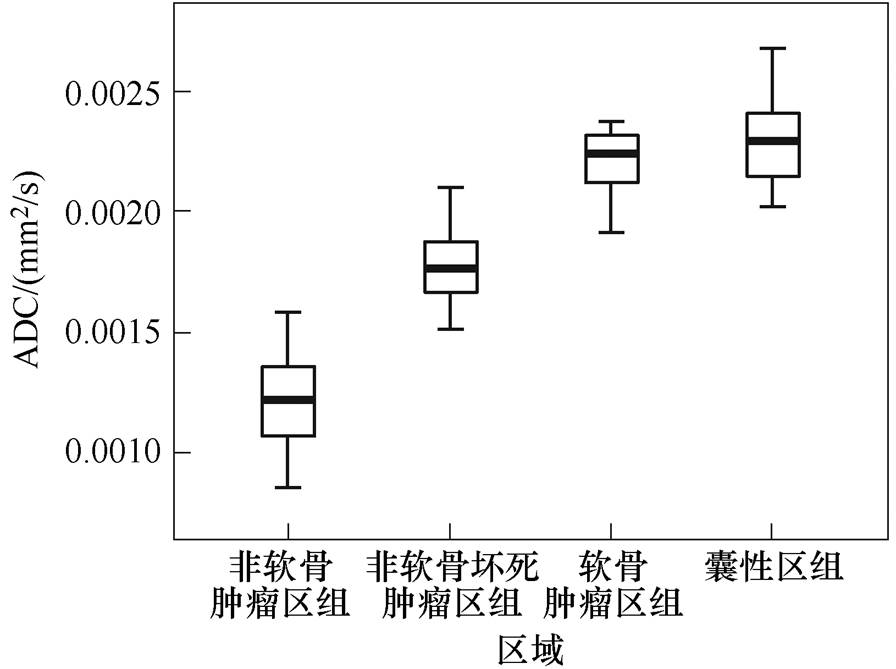
图4 箱型图比较不同组织病理区域ADC值的差异
Fig.4 Box plot comparing difference in mean ADC values among different histopathologic regions
除区分肿瘤类型和良恶性病变外,研究者们也研究了ADC与预后的关系。低ADC值代表预后效果可能不理想[29]。肿瘤患者在接受治疗后,如果该方案有效,肿瘤会发生如细胞活性降低、坏死,肿瘤体积缩小等变化,水分子运动范围扩大,肿瘤DWI信号降低,ADC值升高;若对治疗方案无响应,则可能引起肿瘤恶化或进一步扩散。不同ADC cut-off总生存率Kaplan-Meier曲线如图5所示[33],胃癌患者的生存率与ADC值存在相关性。Ⅲ期胃癌患者ADC≤1.36×10–3mm2/s,生存率远低于Ⅱ期(1.36×10–3mm2/s≥ADC>1.80×10–3mm2/s)和Ⅰ期(ADC>1.80×10–3mm2/s)的患者。
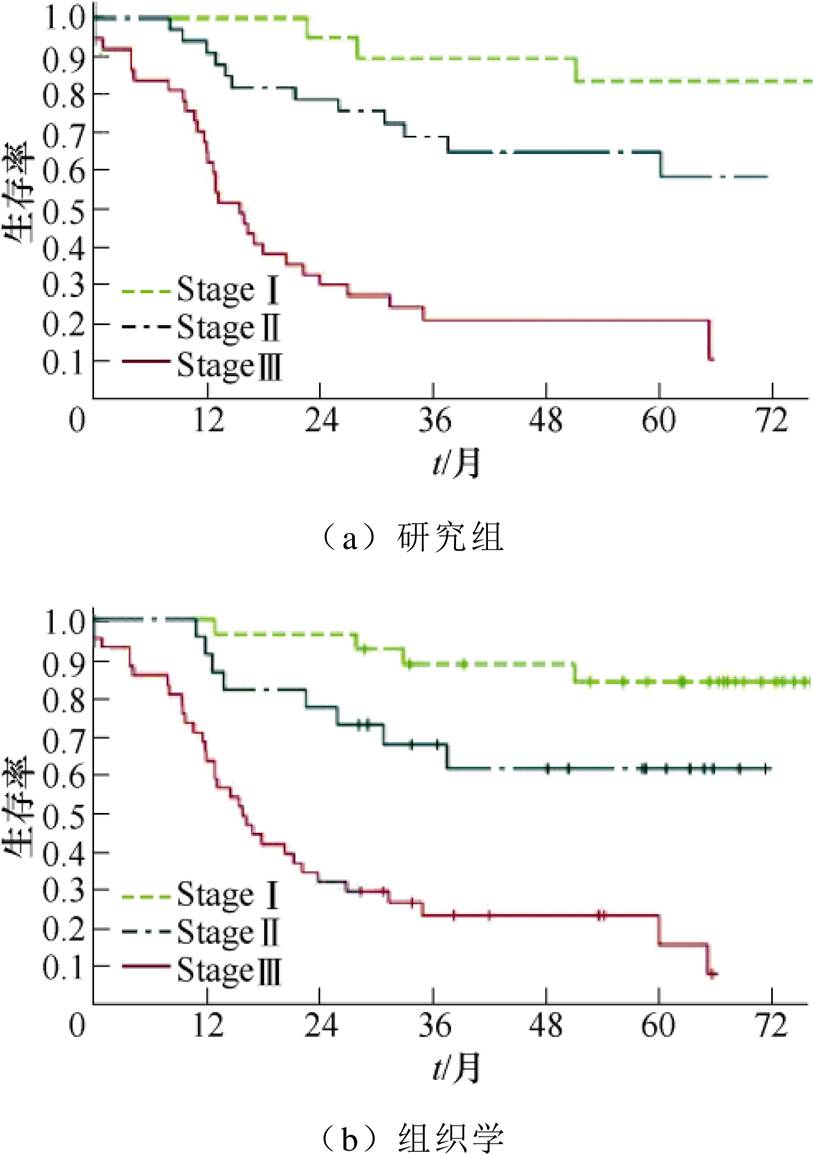
图5 不同ADC cut-off总生存率Kaplan-Meier曲线
Fig.5 Kaplan-Meier curves show the overall survival rates according to the different ADC cut-offs (10–3mm2/s)
肿瘤细胞增殖和分化较快,需要更多的氧气和营养物质,因此肿瘤周围的毛细血管更加丰富。PWI利用毛细血管灌注情况对肿瘤进行判断。早期研究发现PWI信号强度与CBV有关。血管内皮生长因子(Vascular Endothelial Growth Factor, VEGF)、微血管密度(Microvessel Density, MVD)等因素[28]也会影响CBV。研究表明,CBV与胶质瘤级别呈现一定相关性。低级别胶质瘤的CBV较低,而高级别胶质瘤的CBV较高[34]。然而PWI区分良恶性脑膜瘤的结果却不完全一致。Shi Ruihua等[35]发现良性脑膜瘤的rCBV为9.61±4.76,显著高于恶性脑膜瘤的3.61±0.25,且最大rCBV均值与MVD呈正相关。而Zhang Hao等[36]研究发现,良恶性脑膜瘤的CBV虽无显著差异,如图6所示[36],但可进一步通过瘤周水肿区来区分。原因可能为恶性脑膜瘤水肿区有新生血管,灌注增加,CBV高于良性水肿区。图6a为良性脑膜瘤(WHO Ⅰ级)的rCBV。肿瘤实质ROI 1(白色)表示rCBV高于周围脑组织,瘤周水肿ROI 2(灰色)比正常白质ROI 3(黑色)更“热”。图6b为良性脑膜瘤(WHO Ⅰ级)的rMTE,肿瘤实质和瘤周水肿的颜色与正常脑组织相似,没有清晰的界面。图6c为恶性脑膜瘤(WHO Ⅲ级)rCBV,肿瘤实质ROI 1(白色)表示rCBV高于周围脑组织;瘤周水肿ROI 2(灰色)也比正常白质中的ROI 3(黑色)更“热”。图6d为恶性脑膜瘤(WHO Ⅲ级)的rMTE,大多数肿瘤实质显示出比正常脑组织稍“热”的颜色,反映了长时间的rMTE。

图6 组织病理学证实的脑膜瘤
Fig.6 Histopathologically confirmed meningioma
早期PWI肿瘤研究多集中在脑部、头颈、乳腺、肝脏和肾脏等血管较为丰富的组织,现在也应用于宫颈癌、肠系膜肿瘤等研究。传统MRI检测上肠系膜肿瘤敏感性、特异性和准确性分别为24%、93%和50%[37],DCE-PWI的检测敏感性、特异性和准确性显著优于传统MRI,分别为100%、92%和97%。另有研究发现,DWI与DCE-PWI联合诊断乳腺癌的准确性显著高于DCE-PWI单一检测模式[38]。
除参数CBV可帮助诊断肿瘤外,定量参数容积转运常数Ktrans也可帮助评估治疗效果。Jon-Vidar Gaustad等[39]系统分析了Ktrans与肿瘤缺氧之间的关系后发现,经过抗血管生成药物治疗后,肿瘤周围毛细血管生成减少、灌注减少、缺氧情况加剧、Ktrans减小、肿瘤生长受到抑制。同时,Ktrans也可以预测肿瘤转移和患者生存。Ktrans值越小,发生淋巴结和肺转移的可能性越大,肿瘤恶化进展的可能性也越高;相反,Ktrans值越大,无进展生存率和整体生存率都较高。
SWI通过反映肿瘤内部出血、钙化情况[40]和肿瘤血管结构等信息,帮助实现肿瘤分级。Xing Wei等[41]对32位ccRCC患者进行回顾分析后发现,相比CT和传统MRI,SWI不仅能够更好地显示ccRCC的出血情况,也能更准确地反映出血模式。SWI对ccRCC出血模式的判断与病理分析结果一致,对ccRCC的检测敏感性和准确性都达到了100%。
此外,出血情况与胶质瘤的恶性程度也存在一定关系。肿瘤分级越高,出血风险也越大[42-45]。高级别(Ⅲ级和Ⅳ级)胶质瘤的出血风险高于低级别胶质瘤(Ⅰ级和Ⅱ级)。48岁男性,多形性胶质母细胞瘤病史,如图7所示[40]。图7a为快速自旋回波(Fast Spin Echo,FSE)T2W图像,图中显示右额叶异质肿物高信号及浸润性水肿周围高强度,肿瘤压迫右侧脑室,由右至左移位。图7b显示轴向SE T1W对比增强,肿瘤异质性对比增强。图7c为SWI最小强度投影算法(minimum Intensity Projection algorithm, minIP)图像,显示肿瘤周边微出血,提示肿瘤级别高。在SWI图中,显示胶质母细胞瘤(Glioblastoma, GBM)周围存在微出血的情况,提示此GBM的级别为高级别。

图7 48岁男性,多形性胶质母细胞瘤病史
Fig.7 A 48-year-old man with a history of glioblastoma multiforme
除出血外,钙化也是评估肿瘤的重要因素。少突胶质细胞瘤中,钙化在磁矩图中表现为低信号,在相位图上呈现高密度[46],与钙化在CT中呈现高密度的图像相吻合。M. Zulfiqar等[47]回顾分析了经病理证实的71位患者MRI图像。以CT数据为基准,经过Fisher检验后,SWI检测瘤内钙化的敏感性和准确性均显著优于传统MRI(p=0.015、p=0.048)。Dou Shewei等[48]发现,相比于CT、传统MRI和DWI,SWI能够更好地诊断出前列腺癌(PCa)如图8所示[48]。图8c和图8d均未显示前列腺癌和出血。图8e和图8f箭头证明了前列腺癌的微异常。

图8 81岁男性,外周区前列腺癌
Fig.8 An 81-year-old male with prostate cancer in the left peripheral zone
研究发现,新诊断的GBM患者[49],图像中低信号的比例越高,辅助治疗的应答效果越好。
MRS可通过定量分析组织代谢判断疾病进展,这一技术在脑肿瘤和前列腺癌的诊断中得到了较为广泛的应用。1H-MRS的脑肿瘤临床应用较为成熟。NAA作为神经元的主要标志物,通过检测神经元的状态判断疾病进展。NAA浓度降低表明神经元的功能受损,可用于诊断脑肿瘤、脑卒中和神经退行性疾病等。Cho参与细胞膜磷脂代谢,含量升高意味着胶质增生、细胞增殖和跨膜转运增多。mI是星形细胞的标志物,可调节胞内渗透压。此外,机体处于缺血缺氧状态时,能够检测到乳酸(Lac)峰。高级别脑肿瘤中脂质和乳酸盐的含量水平也相对较高。S. J. Nelson等[50]发现新诊断GBM患者的总体生存率与Cho、Lac和脂质含量水平相关。除1H-MRS外,31P-MRI和23Na-MRI也在不断发展。31P-MRS[51]获取更大的体素时虽然需要使用双共振技术来保证成像质量,但它的优势是可以区分胆碱和乙醇胺类化合物。23Na虽然只有一个共振,但可利用此特点来获取空间信息,且弛豫时间T1和T2均小于50ms,可快速实现对采集信号的最大化。
MRS中,(Cho+Cr)/Cit(枸橼酸盐)的比例是区分前列腺病变的重要指标,诊断标准(4分量表)如图9所示[52]。图9a为1分,正常,(Cho/Cr)/Cit≤1/3,Cit峰值至少比Cho/Cr峰值高2倍;图9b为2分,可能为良性,1/2≤(Cho/Cr)/Cit,Cit峰值小于或等于Cho/Cr峰值的2倍;图9c为3分,可能为恶性,1<(Cho/Cr)/Cit<3,Cho/Cr的峰值低于2倍的Cit峰值,但高于Cit峰值;图9d为4分,恶性,3≤(Cho/Cr)/Cit,若存在Cit峰值,Cho/Cr的峰值至少高于Cit峰值2倍。(Cho+Cr)/Cit的峰值比例在前列腺癌中明显高于前列腺良性病变和正常组织[52]。G. M. Villeirs等[52]发现MRS联合T2W1 MRI对高级别前列腺癌的检测敏感性为92.7%,高于低级别前列腺癌的67.6%的检测敏感性。
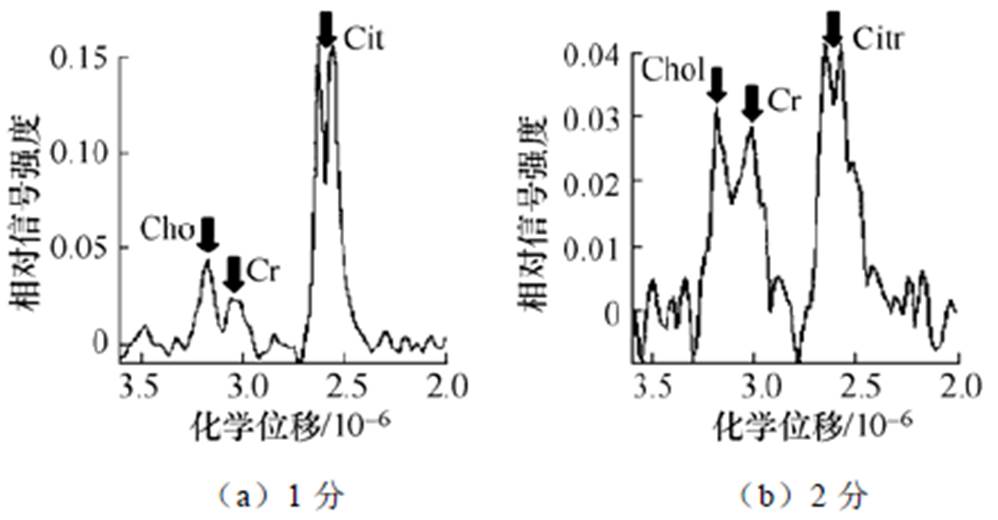
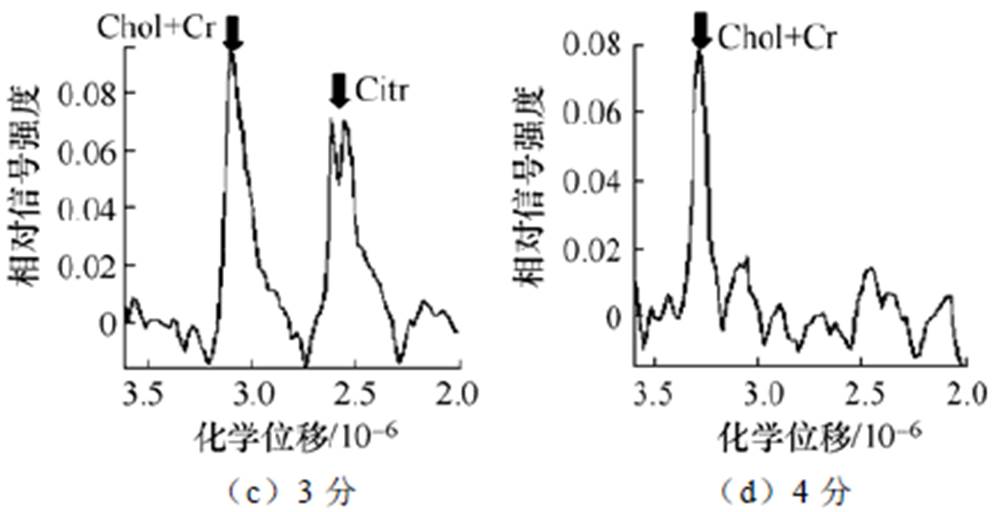
图9 诊断标准(4分量表)
Fig.9 Diagnostic criteria (4-point scale)
在乳腺癌中,1H-MRS应用受限主要有两方面原因:①总胆碱的测量会受到乳腺脂肪组织[51]的影响;②在乳腺中可能会出现梯度诱导产生的声侧带。除了常用的1H-MRS,31P-MRS和23Na-MRS也用于研究乳腺癌。31P-MRS在磁感应强度1.5T下产生的信号较弱,已不能满足临床早期诊断的需求,7T仪器的诞生和应用[53]又给研究者带来了新希望。O. Zaric等[54]在磁感应强度7T下,利用23Na-MRS对健康者和乳腺癌患者进行扫描成像。结果发现,恶性癌变乳腺组织中Na+浓度为(69±10)mmol/kg,而良性组织中浓度为(47±8)mmol/kg。此发现为临床利用Na+区分良恶性病变组织提供了依据。
MRS也在其他肿瘤如子宫内膜癌、癌肉瘤和肝癌等中进行了探究。子宫内膜癌中胆碱的峰值显著高于子宫肌层组织和侵袭性肉瘤[55-56]。癌变肝脏组织与良性组织的胆碱/脂质比具有明显差异[57]。同时也发现,相比于单一的传统MRI评估,MRS可小幅度提高检测肝癌的敏感性和特异性。
BOLD-fMRI多聚焦于血氧水平和肿瘤缺氧研究。研究表明,缺氧可认为是实体瘤不良预后的指标,也可导致放化疗、手术和靶向治疗的失败[58]。肿瘤缺氧研究一般以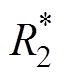 为基线,
为基线,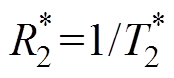 。高血容量的缺氧肿瘤不仅可提高基线
。高血容量的缺氧肿瘤不仅可提高基线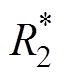 ,也更易对卡波金气体(95%O2和5%CO2的混合气体)产生响应,引起
,也更易对卡波金气体(95%O2和5%CO2的混合气体)产生响应,引起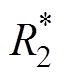 和放射敏感性发生较大变化。而低血容量缺氧肿瘤则相反,对
和放射敏感性发生较大变化。而低血容量缺氧肿瘤则相反,对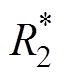 和放射敏感性的影响可忽略不 计[59]。张培贤等[60]发现利用BOLD定量参数
和放射敏感性的影响可忽略不 计[59]。张培贤等[60]发现利用BOLD定量参数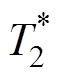 ,可帮助医生明确放化疗对鼻咽癌的治疗效果,提供确切的参考。
,可帮助医生明确放化疗对鼻咽癌的治疗效果,提供确切的参考。
BOLD虽可间接测量肿瘤血管、显示血流变化,但其也易受到伪影的影响,导致图像失真。此外,BOLD的图像质量还会受到核心体温、药物[61]如咖啡因、左旋多巴等因素的影响。进行研究时,受试者还需吸入100%的O2或卡波金气体,其中有25%~35%的患者因发生呼吸窘迫导致临床检查失败。这些亟待解决的问题都延迟了其转化到临床的速度。
目前PET/CT已在临床得到实际应用,对于肿瘤定位、定性诊断、肿瘤分期、肿瘤活检部位的选择、放化疗计划的制定等具有重要指导意义[62],但其存在肿瘤诊断假阳性和假阴性的问题[63],成像质量也会受到呼吸、腹部脏器运动的影响。CT诊断中使用的X射线会产生电离辐射,对人体产生一定危害。而非电离辐射MRI不仅对软组织的分辨率高于CT,MRI与PET相融合的技术难题也已通过光电二极管得到解决,这些都促进了PET/MRI的发展。相比于PET/CT,PET/MRI在时间和空间[64]上高度适配,可在同一时间对同一区域进行成像,避免单独成像时拍摄部位不一致的问题,从而提供质量更佳的多功能图像,揭示更详细的肿瘤信息[65]。
当前PET/MRI肿瘤研究多聚焦于肿瘤肝胆转移和前列腺癌。研究表明,PET/MRI在评估肿瘤肝胆转移方面具有重要作用,但对肺转移的检测效果较差[64]。相比单一的PET或MRI模式,整合PET/ MRI能够提高前列腺癌分期的能力。这种方式在欧洲相对常见,美国临床中虽也有应用,但尚未真正纳入临床规范中[64]。此外,PET/MRI在乳腺癌、胰腺导管癌和头颈癌等肿瘤中也有所研究。MRI可改善乳腺癌成像特征,而PET对远端转移有较高的诊断性能[66],两者强强联合提高了在乳腺癌的应用潜力。Eun-Jung Kong等[67]发现PET/MRI可将乳腺癌高分辨率影像和代谢影像相结合,精准诊断尺寸<1cm的浸润肿瘤。氟脱氧葡萄-PET/MRI(FDG- PET/MRI)在胰腺导管癌上应用较少,原因可能为FDG在此类肿瘤中的活性较低。借助PET/MRI高软组织分辨率的优势,头颈癌成像研究也在进行中,但当前研究结果并不完全统一[68]。A. Varoquaux 等[69]发现在图像融合质量、病灶大小及数目等方面,PET/MRI与PET/CT表现相当;但K. Kubiessa等[70]却发现PET/ MRI诊断头颈癌恶性肿瘤的能力并不比PET/CT突出。这一差异的主要原因可能是样本量和研究数量都相对较少,还需进行更大样本量和更深层次的研究探索。
Buchbender等[71-72]以大量病例为基础,阐述了PET/MRI在肿瘤分期中的潜在应用价值。对于T分期的实体瘤,PET/MRI诊断准确性更高,特别是对于头颈鳞癌。对于N分期的实体瘤,PET/MRI与PET/CT诊断能力相当,但超顺磁性纳米颗粒的出现为PET/MRI提供了新机会。M分期肿瘤,PET/ MRI在脑部、肝脏和骨头病变的检测中具有更高的准确性。
技术的进步已成功推动PET/MRI向前发展,但若像PET/CT一样能够成为临床诊断标准,还需解决扫描协议、临床监管[73]、风险控制、费用成本等方面的问题。
fMRI在MRI的基础上,进一步利用水分子、血红蛋白等物质对病灶部位进行代谢、血流灌注、出血和钙化等生理层面信息的成像。根据fMRI的灰度图和相关参数如ADC、Ktrans、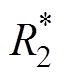 等对肿瘤进行早期诊断、分型、分期、制定治疗方案并评估疗效评估。PET/MRI联用也为肿瘤临床应用提供了新机会。然而,fMRI也存在一些如胸腹部伪影、衰减校正、扫描时间长、临床标准规范不明确、某些肿瘤临床研究较少等问题。未来,随着软硬件技术、新型磁纳米颗粒造影剂如双模态造影剂等的发展和临床研究力度的加大,上述问题可能会得到逐步改善或解决,fMRI或多模态成像有望为肿瘤患者提供更为方便精准的服务。
等对肿瘤进行早期诊断、分型、分期、制定治疗方案并评估疗效评估。PET/MRI联用也为肿瘤临床应用提供了新机会。然而,fMRI也存在一些如胸腹部伪影、衰减校正、扫描时间长、临床标准规范不明确、某些肿瘤临床研究较少等问题。未来,随着软硬件技术、新型磁纳米颗粒造影剂如双模态造影剂等的发展和临床研究力度的加大,上述问题可能会得到逐步改善或解决,fMRI或多模态成像有望为肿瘤患者提供更为方便精准的服务。
参考文献
[1] 任自艳, 谢德馨, 李会香. 开放式MRI永磁型主磁体的匀场方法[J]. 电工技术学报, 2010, 25(3): 1-5.
Ren Ziyan, Xie Dexin, Li Huixiang. Shimming method for open MRI permanent main magnet[J]. Transactions of China Electrotechnical Society, 2010, 25(3): 1-5.
[2] Grasland-Mongrain P, Lafon C. Review on bio- medical techniques for imaging electrical impe- dance[J]. IRBM, 2018, 39(4): 243-250.
[3] 李星, 杨帆, 余晓, 等. 基于内源式电阻抗成像的接地网缺陷诊断逆问题研究[J]. 电工技术学报, 2019, 34(5): 902-909.
Li Xing, Yang Fan, Yu Xiao, et al. Research on the inverse problem of grounding grid fault diagnosis based on inner-source EIT[J]. Transactions of China Electrotechnical Society, 2019, 34(5): 902-909.
[4] Wan Min, Healy J J, Sheridan J T. Terahertz phase imaging and biomedical applications[J]. Optics and Laser Technology, 2020: 105859.
[5] Xia Yang, Matham M V, Su Haibin, et al. Nanoparticulate contrast agents for multimodality molecular imaging[J]. Journal of Biomedical Nano- technology, 2016, 12(8): 1553-1584.
[6] 刘红梅, 董守龙, 宁郡怡, 等. 纳秒脉冲高频透膜效应优先杀伤化疗抗性肿瘤细胞的仿真与实验研究[J]. 电工技术学报, 2019, 34(22): 4839-4848.
Liu Hongmei, Dong Shoulong, Ning Junyi, et al. Simulation and experimental study on preferential killing of chemoresistance tumor cells induced by the high-frequency permeation effect of nanosecond pulse field[J]. Transactions of China Electrotechnical Society, 2019, 34(22): 4839-4848.
[7] Wallyn J, Anton N, Akram S, et al. Biomedical imaging: principles, technologies, clinical aspects, contrast agents, limitations and future trends in nanomedicines[J]. Pharmaceutical Research, 2019, 36(6): 78.
[8] Tognarelli J M, Dawood M, Shariff M I F, et al. Magnetic resonance spectroscopy: principles and techniques: lessons for clinicians[J]. Journal of Clinical and Experimental Hepatology, 2015, 5(4): 320-328.
[9] Ratai Eva-Maria, Gilberto G R. Clinical magnetic resonance spectroscopy of the central nervous system[J]. Handbook of Clinical Neurology, 2016, 135: 93-116.
[10] Meoded A, Orman G, Huisman T A G M. Diffusion weighted and diffusion tensor MRI in pediatric neuroimaging including connectomics: principles and applications[J]. Seminars in Pediatric Neurology, 2020, 33: 100797.
[11] Fornasa F. Diffusion-weighted magnetic resonance imaging: what makes water run fast or slow?[J]. Journal of Clinical Imaging Science, 2011, 1: 27.
[12] Messina C, Bignone R, Bruno A, et al. Diffusion- weighted imaging in oncology: an update[J]. Cancers, 2020, 12(6): 1493.
[13] Baliyan V, Das C J, Sharma R, et al. Diffusion weighted imaging: technique and applications[J]. World Journal of Radiology, 2016, 8(9): 785-798.
[14] Chilla G S, Tan C H, Xu Chenjie, et al. Diffusion weighted magnetic resonance imaging and its recent trend-a survey[J]. Quantitative Imaging in Medicine and Surgery, 2015, 5(3): 407-422.
[15] Malayeri A A, El K R H, Zaheer A, et al. Principles and applications of diffusion-weighted imaging in cancer detection, staging, and treatment follow-up[J]. Radiographics, 2011, 31(6): 1773-1791.
[16] 郭磊, 刘东钊, 黄凤荣, 等. 基于突触可塑性的自适应脉冲神经网络在高斯白噪声刺激下的抗扰功能研究[J]. 电工技术学报, 2020, 35(2): 225-235.
Guo Lei, Liu Dongzhao, Huang Fengrong, et al. Research on disturbance rejection of adaptive spiking neural network based on synaptic plasticity under white gaussian noise[J]. Transactions of China Electrotechnical Society, 2020, 35(2): 225-235.
[17] Jahng Geon-Ho, Li Ka-Loh, Ostergaard L, et al. Perfusion magnetic resonance imaging: a com- prehensive update on principles and techniques[J]. Korean Journal of Radiology, 2014, 15(5): 554-577.
[18] Liu Saifeng, Buch S, Chen Yongsheng, et al. Susceptibility-weighted imaging: current status and future directions[J]. NMR in Biomedicine, 2017, 30(4): 10.1002/nbm.3552.
[19] Yan Fuhua, He Naying, Lin Huimin, et al. Iron deposition quantification: applications in the brain and liver[J]. Journal of Magnetic Resonance Imaging, 2018, 48(2): 301-317.
[20] Ruetten P P R, Gillard J H, Graves M J. Introduction to quantitative susceptibility mapping and susce- ptibility weighted imaging[J]. British Journal of Radiology, 92(1101): 20181016.
[21] Barrett T, Brechbiel M, Bernardo M, et al. MRI of tumor angiogenesis[J]. Journal of Magnetic Resonance Imaging, 2007, 26(2): 235-249.
[22] Detre J A, Wang J J. Technical aspects and utility of fMRI using BOLD and ASL[J]. Clinical Neurophy- siology, 2002, 113(5): 621-634.
[23] Edlow B L, Giacino J T, Wu O. Functional MRI and outcome in traumatic coma[J]. Current Neurology and Neuroscience Reports, 2013, 13(9): 375.
[24] Naik M L, Mannelli H, Chandarana V, et al. Hepato- cellular carcinoma assessment of tumor oxygenation with BOLD MRI[C]//16th International Society for Magnetic Resonance in Medicine, Toronto, 2008: 1-2.
[25] 胡盛寿, 高润霖, 刘力生, 等. 《中国心血管病报告2018》[J]. 中国循环杂志, 2019, 34(3): 209-220.
Hu Chengshou, Gao Runlin, Liu Lisheng, et al. Summary of the 2018 report on cardiovascular diseases in China[J]. Chinese Circulation Journal, 2019, 34(3): 209-220.
[26] 郑荣寿, 孙可欣, 张思维, 等. 2015年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2019, 30(1): 19-28.
Zheng Rongshou, Sun Kexin, Zhang Siwei, et al. Report of cancer epidemiology in China, 2015[J]. Chinese Journal of Oncology, 2019, 30(1): 19-28.
[27] Wang Jifei, Sun Meili, Liu Dawei, et al. Correlation between apparent diffusion coefficient and histo- pathology subtypes of osteosarcoma after neoadjuvant chemotherapy[J]. Acta Radiologica, 2017, 58(8): 971-976.
[28] Haj-Mirzaian A, Kadivar A, Kamel I R, et al. Updates on imaging of liver tumors[J]. Current Oncology Reports, 2020, 22(5): 46.
[29] Choi Y J, Lee I S, Song Y S, et al. Diagnostic performance of diffusion-weighted (DWI) and dynamic contrast-enhanced (DCE) MRI for the differentiation of benign from malignant soft-tissue tumors[J]. Journal of Magnetic Resonance Imaging, 2019, 50(3): 798-809.
[30] Dong Yin, Liu Qingwei. Differentiation of malignant from benign pheochromocytomas with diffusion- weighted and dynamic contrast enhanced magnetic resonance at 3.0T[J]. Journal of Computer Assisted Tomography, 2012, 36(4): 361-366.
[31] Mickael T, Mali R, Madelin G, et al. Diagnostic test accuracy of ADC values for identification of clear cell renal cell carcinoma: systematic review and meta-analysis[J]. European Radiology, 2020, 30(7): 4023-4038.
[32] Dhanda S, Thakur M, Kerkar R, et al. Diffusion- weighted imaging of gynecologic tumors: diagnostic pearls and potential pitfalls[J]. Radiographics, 2014, 34(5): 1393-1416.
[33] Giganti F, Ambrosi A, Chiari D, et al. Apparent diffusion coefficient by diffusion-weighted magnetic resonance imaging as a sole biomarker for staging and prognosis of gastric cancer[J]. Chinese Journal of Cancer Research, 2017, 29(2): 118-126.
[34] Aydin S, Fatihoglu E, Kosar P N, et al. Perfusion and permeability MRI in glioma grading[J]. Egyptian Journal of Radiology and Nuclear Medicine, 2020, 51(1): 2.
[35] Shi Ruihua, Jiang Tao, Si Lifang, et al. Correlations of magnetic resonance, perfusion-weighed imaging parameters and microvessel density in meningioma[J]. Journal of the Balkan Union of Oncology, 2016, 21(3): 709-713.
[36] Zhang Hao, Rodiger L A, Shen Tianzhen, et al. Perfusion MR imaging for differentiation of benign and malignant meningiomas[J]. Neuroradiology, 2008, 50(6): 525-530.
[37] Low R N, Barone R M, Duggan B, et al. Detection of mesenteric tumor using dynamic contrast enhanced MRI[J]. Annals of Surgical Oncology, 2020, 27(7): 2525-2536.
[38] Zhang Li, Tang Min, Min Zhiqian, et al. Accuracy of combined dynamic contrast-enhanced magnetic resonance imaging and diffusion-weighted imaging for breast cancer detection: a meta-analysis[J]. Acta Radiologica, 2016, 57(6): 651-660.
[39] Gaustad Jon-Vidar, Hauge A, Wegner C S, et al. DCE-MRI of tumor hypoxia and hypoxia- associated aggressiveness[J]. Cancers, 2020, 12(7): 1979.
[40] Halefoglu A M, Yousem D M. Susceptibility weighted imaging: clinical applications and future directions[J]. World Journal of Radiology, 2018, 10(4): 30-45.
[41] Xing Wei, He Xiaozhou, Kassir M A, et al. Evaluating hemorrhage in renal cell carcinoma using susceptibility weighted imaging[J]. Plos One, 2013, 8(2): e57691.
[42] Rauscher A, Sedlacik J, Fitzek C, et al. High resolution susceptibility weighted MR-imaging of brain tumors during the application of a gaseous agent[J]. Rofo-Fortschritte Auf Dem Gebiet Der Rontgenstrahlen Und Der Bildgebenden Verfahren, 2005, 177(8): 1065-1069.
[43] Sehgal V, Delproposto Z, Haacke E M, et al. Clinical applications of neuroimaging with susceptibility- weighted imaging[J]. Journal of Magnetic Resonance Imaging, 2005, 22(4): 439-450.
[44] Hammond K E, Lupo J M, Xu Duan, et al. Development of a robust method for generating 7.0T multichannel phase images of the brain with application to normal volunteers and patients with neurological diseases[J]. Neuroimage, 2008, 39(4): 1682-1692.
[45] Thomas B, Somasundaram S, Thamburaj K, et al. Clinical applications of susceptibility weighted MR imaging of the brain-a pictorial review[J]. Neuroradiology, 2008, 50(2): 105-116.
[46] Wu Zhen, Mittal S, Kish K, et al. Identification of calcification with MRI using susceptibility-weighted imaging: a case study[J]. Journal of Magnetic Resonance Imaging, 2009, 29(1): 177-182.
[47] Zulfiqar M, Dumrongpisutikul N, Intrapiromkul J, et al. Detection of intratumoral calcification in oligo- dendrogliomas by susceptibility-weighted MR Imaging[J]. American Journal of Neuroradiology, 2012, 33(5): 858-864.
[48] Dou Shewei, Bai Yan, Shandil A, et al. Detecting prostate cancer and prostatic calcifications using advanced magnetic resonance imaging[J]. Asian Journal of Andrology, 2017, 19(4): 439-443.
[49] Di L A, Lam T, Alcaide-Leon P, et al. Magnetic resonance susceptibility weighted imaging in neuro- surgery: current applications and future perspe- ctives[J]. Journal of Neurosurgery, 2015, 123(6): 1463-1475.
[50] Nelson S J, Kadambi A K, Park I, et al. Association of early changes in H-1 MRSI parameters with survival for patients with newly diagnosed glioblastoma receiving a multimodality treatment regimen[J]. Neuro-Oncology, 2017, 19(3): 430-439.
[51] Payne G S. Clinical applications of in vivo magnetic resonance spectroscopy in oncology[J]. Physics in Medicine and Biology, 2018, 63(21): 21TR02.
[52] Villeirs G M, Oosterlinck W, Vanherreweghe E, et al. A qualitative approach to combined magnetic resonance imaging and spectroscopy in the diagnosis of prostate cancer[J]. European Journal of Radiology, 2010, 73(2): 352-356.
[53] van der Kemp Wybe J M, Stehouwer B L, Boer V O, et al. Proton and phosphorus magnetic resonance spectroscopy of the healthy human breast at 7T[J]. NMR in Biomedicine, 2017, 30(2): e3684.
[54] Zaric O, Pinker K, Zbyn S, et al. Quantitative sodium MR imaging at 7T: initial results and comparison with diffusion-weighted imaging in patients with breast tumors[J]. Radiology, 2016, 280(1): 39-48.
[55] Takeuchi M, Matsuzaki K, Harada M. Carcinosarcoma of the uterus: MRI findings including diffusion- weighted imaging and MR spectroscopy[J]. Acta Radiologica, 2016, 57(10): 1277-1284.
[56] Ytre-Hauge S, Esmaeili M, Sjobakk T E, et al. In vivo MR spectroscopy predicts high tumor grade in endometrial cancer[J]. Acta Radiologica, 2018, 59(4): 497-505.
[57] Yang Zifeng, Sun Shiqiang, Chen Yuanli, et al. Application of single voxel H-1 magnetic resonance spectroscopy in hepatic benign and malignant lesions[J]. Medical Science Monitor, 2016, 22: 5003-5010.
[58] O'Connor J P B, Robinson S P, Waterton J C. Imaging tumour hypoxia with oxygen- enhanced MRI and BOLD MRI[J]. British Journal of Radiology, 2019, 92(1095): 20180642.
[59] Rijpkema M, Kaanders J, Joosten F B M, et al. Effects of breathing a hyperoxic hypercapnic gas mixture on blood oxygenation and vascularity of head-and-neck tumors as measured by magnetic resonance imaging[J]. International Journal of Radiation Oncology Biology Physics, 2002, 53(5): 1185-1191.
[60] 张培贤, 俞胜男, 丁玖乐, 等. 磁共振血氧水平依赖成像在鼻咽癌化放疗近期疗效评估中的价值[J]. 磁共振成像, 2019, 10(3): 190-194.
Zhang Peixian, Yu Shengnan, Ding Jiule, et al. Value of BOLD-MRI for the evaluation of short-term chemoradiotherapy efficacy in nasopharyngealcar- cinoma[J]. Chinese Journal of Magnetic Resonance Imaging, 2019, 10(3): 190-194.
[61] Vlieger E J, Majoie C B, Leenstra S, et al. Functional magnetic resonance imaging for neurosurgical planning in neurooncology[J]. European Radiology, 2004, 14(7): 1143-1153.
[62] Zheng Yuanda, Sun Xiaojiang, Wang Jian, et al. FDG-PET/CT imaging for tumor staging and definition of tumor volumes in radiation treatment planning in non-small cell lung cancer[J]. Oncology Letters, 2014, 7(4): 1015-1020.
[63] Wang Shunyi, Chen Xianxia, Li Yi, et al. Appli- cation of multimodality imaging fusion technology in diagnosis and treatment of malignant tumors under the precision medicine plan[J]. Chinese Medical Journal, 2016, 129(24): 2991-2997.
[64] Broski S M, Goenka A H, Kemp B J, et al. Clinical PET/MRI: 2018 update[J]. American Journal of Roentgenology, 2018, 211(2): 295-313.
[65] Ishii S, Shimao D, Hara T, et al. Comparison of integrated whole-body PET/MR and PET/CT: is PET/MR alternative to PET/CT in routine clinical oncology?[J]. Annals of Nuclear Medicine, 2016, 30(3): 225-233.
[66] Pujara A C, Kim E, Axelrod D, et al. PET/MRI in breast cancer[J]. Journal of Magnetic Resonance Imaging, 2019, 49(2): 328-342.
[67] Kong Eun-Jung, Chun Kyung-Ah, Bom Hee-Seung, et al. Initial experience of integrated PET/MR mammography in patients with invasive ductal carcinoma[J]. Hellenic Journal of Nuclear Medicine, 2014, 17(3): 171-176.
[68] Nensa F, Beiderwellen K, Heusch P, et al. Clinical applications of PET/MRI: current status and future perspectives[J]. Diagnostic and Interventional Radiology, 2014, 20(5): 438-447.
[69] Varoquaux A, Rager O, Poncet A, et al. Detection and quantification of focal uptake in head and neck tumours: F-18-FDG PET/MR versus PET/CT[J]. European Journal of Nuclear Medicine and Molecular Imaging, 2014, 41(3): 462-475.
[70] Kubiessa K, Purz S, Gawlitza M, et al. Initial clinical results of simultaneous F-18-FDG PET/MRI in comparison to F-18-FDG PET/CT in patients with head and neck cancer[J]. European Journal of Nuclear Medicine and Molecular Imaging, 2014, 41(4): 639- 648.
[71] Buchbender C, Heusner T A, Lauenstein T C, et al. Oncologic PET/MRI, part 1: tumors of the brain, head and neck, chest, abdomen, and pelvis[J]. Journal of Nuclear Medicine, 2012, 53(6): 928-938.
[72] Buchbender C, Heusner T A, Lauenstein T C, et al. Oncologic PET/MRI, part 2: bone tumors, soft-tissue tumors, melanoma, and lymphoma[J]. Journal of Nuclear Medicine, 2012, 53(8): 1244-1252.
[73] Jadvar H, Colletti P M. Competitive advantage of PET/MRI[J]. European Journal of Radiology, 2014, 83(1): 84-94.
Application of Functional Magnetic Resonance Imaging in the Field of Oncology
Abstract As a non-invasive and non-ionizing radiation imaging, functional magnetic resonance imaging (fMRI) can be used for imaging diagnosis of systemic diseases, such as cardiovascular diseases, neurodegenerative diseases, tumors, trauma, inflammation and so on. Tumor is the second leading cause of death in the world, and scientists from all over the world are committed to tackling tumors. fMRI imaging of tumors can achieve the classification, grading and staging of tumors, which plays an important role in the formulation of treatment plans, evaluation and prediction of curative effect. This paper summarizes and discusses 6 types of fMRI, including diffusion weighted imaging (DWI), diffusion tensor imaging (DTI), perfusion weighted imaging (PWI), susceptibility weighted imaging (SWI), magnetic resonance spectroscopy (MRS), and blood oxygen level dependent functional magnetic resonance imaging (BOLD-fMRI). The application research of multimodal imaging positron emission tomography/magnetic resonance imaging (PET/MRI) in the field of oncology and the application prospects in related therapeutic fields are discussed.
keywords:Functional magnetic resonance imaging, multimodal imaging, cancer, positron emission tomography/magnetic resonance imaging (PET/MRI)
中图分类号:R445.2
DOI: 10.19595/j.cnki.1000-6753.tces.201255
江苏省重点研发计划(BE2019716)和国家自然科学基金(91753106)资助项目。
收稿日期 2020-09-21
修稿日期 2020-10-10
冯 焕 女,1995年生,硕士研究生,研究方向为生物传感和多模态成像。E-mail: 220181844@seu.edu.cn
王雪梅 女,1968年生,教授,博士生导师,研究方向为生物电子与生物传感、多模态生物成像、纳米医学和精准医疗。E-mail: xuewang@seu.edu.cn(通信作者)
(编辑 崔文静)