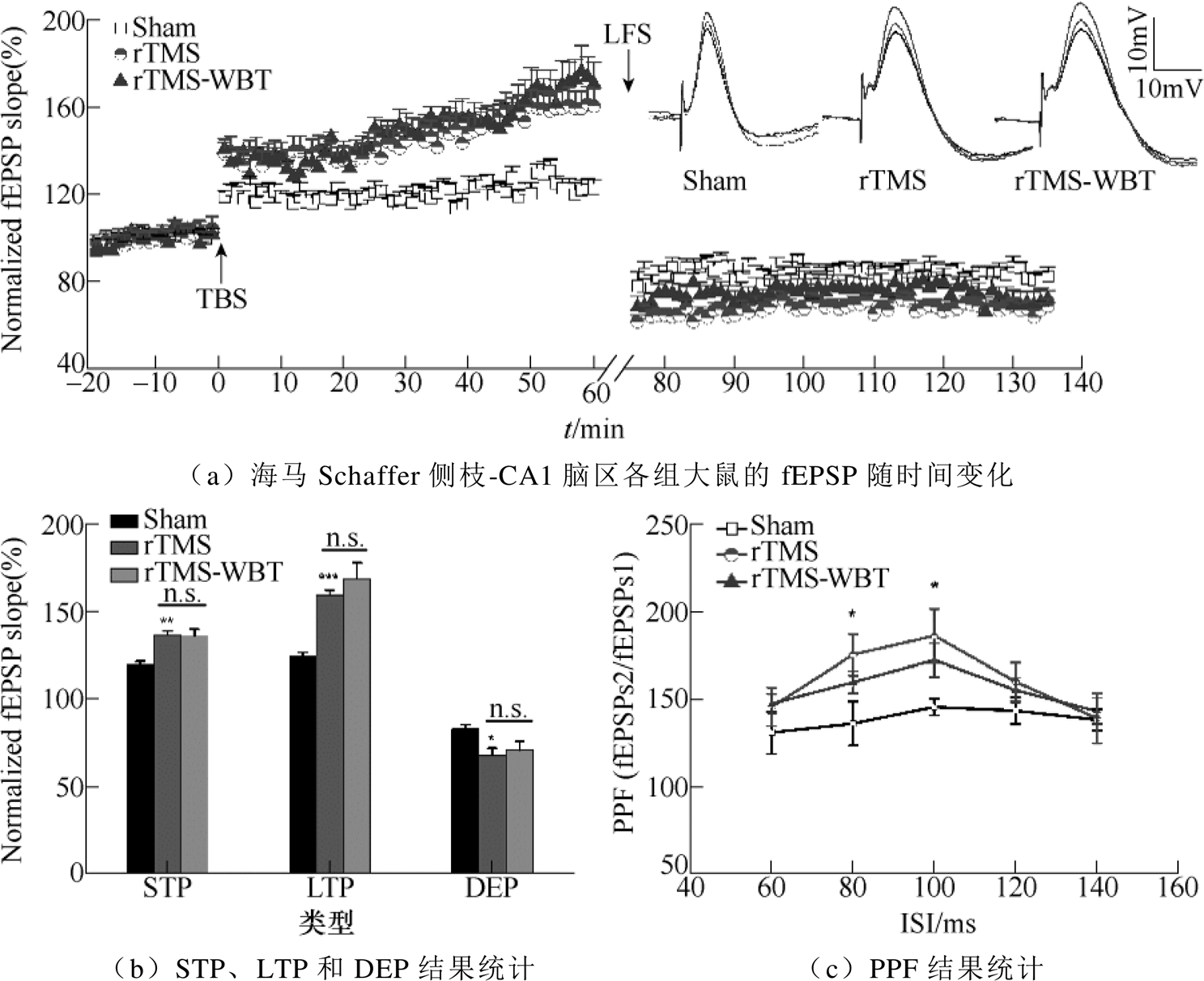
图1 rTMS促进海马Schaffer侧枝-CA1突触可塑性的作用
Fig.1 The effects of rTMS on facilitating hippocampal synaptic plasticity from Schaffer collaterals to the hippocampal CA1
摘要 重复经颅磁刺激(rTMS)作为一种非侵入性的物理干预手段,其原理是利用交变磁场在一个局部脑区产生感应电流。目前rTMS已经成为一种选择性改变神经元电活动的方法,并广泛应用于精神类和神经类疾病的临床辅助治疗。认知功能障碍是许多大脑疾病的核心症状,是影响患者生存质量的主要因素。rTMS能够显著改善患者大脑的神经功能网络,有望成为一种改善认知功能障碍的治疗方法。该文主要针对rTMS对正常生理状态以及在精神类疾病、神经类疾病和其他疾病导致的认知功能障碍中作用及其潜在分子机理进行综述。
关键词:重复经颅磁刺激 认知功能 突触可塑性 脑源性神经营养因子
经颅磁刺激(Transcranial Magnetic Stimulation, TMS)是由Barker等创立的一种用于调节和干预大脑功能的物理方法,其主要作用原理为利用脉冲磁场作用于中枢神经系统,改变皮质神经细胞的膜电位,使之产生感应电流,影响脑内代谢和神经电活动,从而引起一系列相应的生理生化反应。重复经颅磁刺激(repetitive Transcranial Magnetic Stimulation,rTMS)是指刺激重复输出的TMS。目前,随着工程技术的进步,rTMS技术在临床治疗抑郁症(depression)、精神分裂症(schizophrenia)、血管性痴呆(Vascular Dementia, VD)、阿尔兹海默病(Alzheimer Disease, AD)等精神与神经系统疾病中得到了广泛的应用。认知功能障碍是精神及神经病类疾病的主要临床症状。有研究表明,rTMS能够显著恢复患者或实验动物的认知功能障碍。本文将围绕rTMS对认知功能的作用及其潜在的分子机理对近年来本实验室和其他课题组部分研究工作进行综述。
rTMS广泛应用于神经科学领域中。人们逐渐发现,rTMS应用于健康人能够产生神经元易化以及认知功能强化的现象。W. Klimesch等[1]对健康青年进行5Hz的rTMS后,立即让其完成延迟匹配样本工作记忆任务。结果显示,与对照组相比,给予rTMS后能够显著降低反应时间。2014年,J. X. Wang等[2]发现rTMS可以增加海马与前额叶皮层等脑区之间的联系,提高健康成年人的联想学习记忆,但是其具体作用机制并不清楚。rTMS对大脑有长时间的持续作用,于是有人认为rTMS产生的效果与长时程增强(Long-Term Potentiation, LTP)和长时程抑制(Long-Term Depression, LTD)类似,从而提示可能与突触可塑性相关[3-4]。LTP和LTD被认为是学习记忆细胞学基础,2016年,本课题组在动物实验中进行了验证,结果指出,5Hz的rTMS可以提高正常大鼠的空间认知能力,在体电生理实验证明rTMS的有益作用与海马CA3-CA1脑区的LTP和去增益(Depotentiation, DEP)的增强有关[5]。rTMS促进海马Schaffer侧枝-CA1突触可塑性的作用如图1[3]所示。图1中,rTMS-WBT(rTMS without behavioral tasks)组,*P<0.05,**P<0.01,***P<0.01表示与sham组相比;n=6。图1a是波形示意图,前20min为基础兴奋性突触后电位(field Excitatory Postsynaptic Potentials, fEPSP),给予爆发式刺激(Theta Burst Stimulation, TBS)后统计前10min为短时程增强(Short-Time Potentiatio, STP),最后10min为LTP,然后给予15min的LFS,记录60min的DEP,DEP统计最后10min。

图1 rTMS促进海马Schaffer侧枝-CA1突触可塑性的作用
Fig.1 The effects of rTMS on facilitating hippocampal synaptic plasticity from Schaffer collaterals to the hippocampal CA1
rTMS对精神类疾病认知功能影响的研究多集中在抑郁症和自闭症中。应用rTMS治疗单向抑郁症已通过了美国食品药品监督管理局(Food and Drug Administration, FDA)许可,国内外学者将rTMS应用于治疗抑郁症也取得了较为明显的效果。M. O'Connor等[6]对重度抑郁症患者的左侧前额叶背外侧皮质进行高频刺激,结果显示,rTMS对抑郁症具有治疗作用,综合分析发现,其不仅能够改善患者的情感障碍,且可以改善患者的认知功能障碍。低频刺激也能够在一定程度上改善抑郁症的认知功能障碍,包括执行功能和记忆,但是治疗抑郁症认知功能障碍的确切机制尚不完全清楚。抑郁症模型中组织细胞免疫激活,小胶质细胞等免疫因子增加。而rTMS能通过抑制小胶质细胞等免疫因子的激活进而缓解抑郁症的症状[7],同时,也有研究发现,rTMS干预能够改善抑郁症模型大鼠的学习记忆与突触前相关蛋白SYP(synaptophysin)有关[8]。
2019年,本课题组的研究结果显示,给予大鼠5Hz的rTMS能够明显改善产前束缚应激造成的子代大鼠的学习记忆能力和海马突触可塑性的损伤[9]。各组大鼠海马脑区脑源性神经营养因子(Brain-Derived Neurotrophic Factor, BDNF)、TrKB(tropomyosin receptor kinase B)、P-CREB/CREB(cAMP response element binding protein)蛋白的表达量如图2[5]所示。图2中,*P<0.05,***P<0.01表示PNS组与CON组比较;#P<0.05,##P<0.01,###P<0.001表示PNS+ rTMS组与PNS组比较;&&P<0.01,&&P<0.001表示PNS+rTMS+K252a组与PNS+rTMS+DMSO组比较。BDNF对神经元的生长、发育、分化、损伤细胞的修复以及突触传递和可塑性起到了非常重要的作用。BDNF-TrKB通路对突触传递的调节至关重要,与大脑学习记忆功能密切相关。在以上的实验中注射了BDNF-TrKB通路的抑制剂K252a,结果表明,rTMS的作用显著减弱。rTMS改善抑郁症与BDNF的分泌和传递有关。rTMS可以增加BDNF表达量的机制与即刻早期基因有关,即刻早期基因与神经系统的学习记忆过程密切相关,即刻早期基因c-fos可以被高频的rTMS诱导并快速表达,c-fos作为第三信使可以调节BDNF基因的表达,进而发挥相关的功能。

图2 各组大鼠海马脑区BDNF、TrKB、P-CREB/CREB蛋白的表达量
Fig.2 The expression of BDNF, TrkB, and P-CREB/CREB in the hippocampus
在临床研究中,焦虑情绪是自闭症的常见症状,而青春期的自闭症患者表现出更严重的焦虑情绪。除自闭症的核心症状外,约70%的自闭症患者存在一定程度的认知损伤。在自闭症干预治疗中,高频rTMS易引起癫痫,因此低频rTMS是更合适、更安全的选择。rTMS治疗精神分裂症在临床上研究较多,效果较为明显,且具有良好的重复性,已有的报道缺乏在动物实验机制上的进一步探讨[10-11]。本课题组研究结果显示,1Hz的rTMS能有效地改善自闭症模型大鼠的认知功能损伤和突触修剪的异常。自闭症患者中枢神经系统炎症水平显著升高,主要体现在小胶质细胞过度激活以及存在大量的炎症标志物。神经炎症的发生会引起突触损伤,影响突触可塑性。小胶质细胞是神经炎症的主要参与者,过度活化的小胶质细胞会分泌大量促炎因子,造成或促进神经炎症。自闭症模型鼠海马脑区小胶质细胞和炎症因子IL-1b、TNF-a 及IL-6明显激活,低频rTMS能有效抑制自闭症大鼠中小胶质细胞的激活,而激活的小胶质细胞有时也会反过来造成细胞和分子层面的变化,同时伴随着神经元活动模式的改变。
阿尔兹海默病是常见的痴呆症之一,随着病变范围的扩展,认知功能损害将不可逆地逐渐加深。迄今为止,没有有效的治疗AD的方法和手段。Wang Furong等[12]发现,10Hz和15Hz的rTMS能够活化大电导率钙激活钾通道(Large Conductance Calcium- Activated Potassium, BK),有效改善AD模型小鼠的空间学习和记忆。认知功能的损伤往往伴随着神经元活动模式的改变,而神经元活动的异常有时也会反过来造成细胞和分子层面的变化[13]。AD等认知功能相关的疾病都存在着类似的神经网络活动的改变,而这些改变往往出现在疾病早期,甚至会早于认知功能的异常。近年来,越来越多的文章报道了AD早期存在的神经网络振荡活动异常。
T. D. Cummins等[14]研究发现,患有轻度痴呆的病人在进行文字识别任务时,多个脑电图(Electro- encephalogram, EEG)位点的theta节律的能量都要明显低于对照组。在动物模型中,Romain等[15]发现TgCRND8小鼠在1个月时就出现了海马theta-gamma相位-幅值耦合(Phase-Amplitude Coupling, PAC)的显著性变化,而TgCRND8小鼠直到4个月时才会出现Ab 的大量沉积。这些研究表明,以theta和gamma节律为代表海马区神经振荡可能与AD早期的发病机制相关,并具有其他病理学特征不具备的“预警”功能。因此,随着EEG等无创的电生理技术的发展,越来越多的科学家提出基于神经网络活动的振荡分析指标可以被用于预报阿尔兹海默症的发生。本课题组近期的研究发现,连续14天的rTMS治疗对5×FAD小鼠的早期神经振荡异常有缓解作用,rTMS的改善作用可能是通过调节GABAergic中间神经元活动进而激活gamma节律来完成的[16],海马穿质通路(Perforant Path, PP)和齿状回(Dentate Gyrus, DG)脑区间神经振荡的同步如图3[9]所示,图中,*p<0.05表示与野生型(Wild-Type, WT)组相比,##p<0.01表示与5×FAD组相比,相锁值(Phase Locking Value, PLV)为PLV。
rTMS对血管性痴呆的认知功能损害的研究,主要集中在记忆力及执行力上。I. Rektorova等[17]对有认知功能障碍的脑血管疾病患者进行了随机对照研究,结果发现,高频rTMS刺激左前额叶外侧皮质能够改善患者的执行和认知功能。另外,研究人员试图通过动物实验对可能机制进行探讨,结果发现,低频和高频的rTMS均能够改善VD模型大鼠的空间学习记忆能力[17]。进一步的研究指出,rTMS能够促进血管内皮生长因子(Vascular Endothelial Growth Factor, VEGF)和BDNF的分泌,同时提高了NR1、NR2B的表达水平,这些蛋白参与了神经保护、突触传递等功能,进而增强了海马脑区的突触可塑性功能。
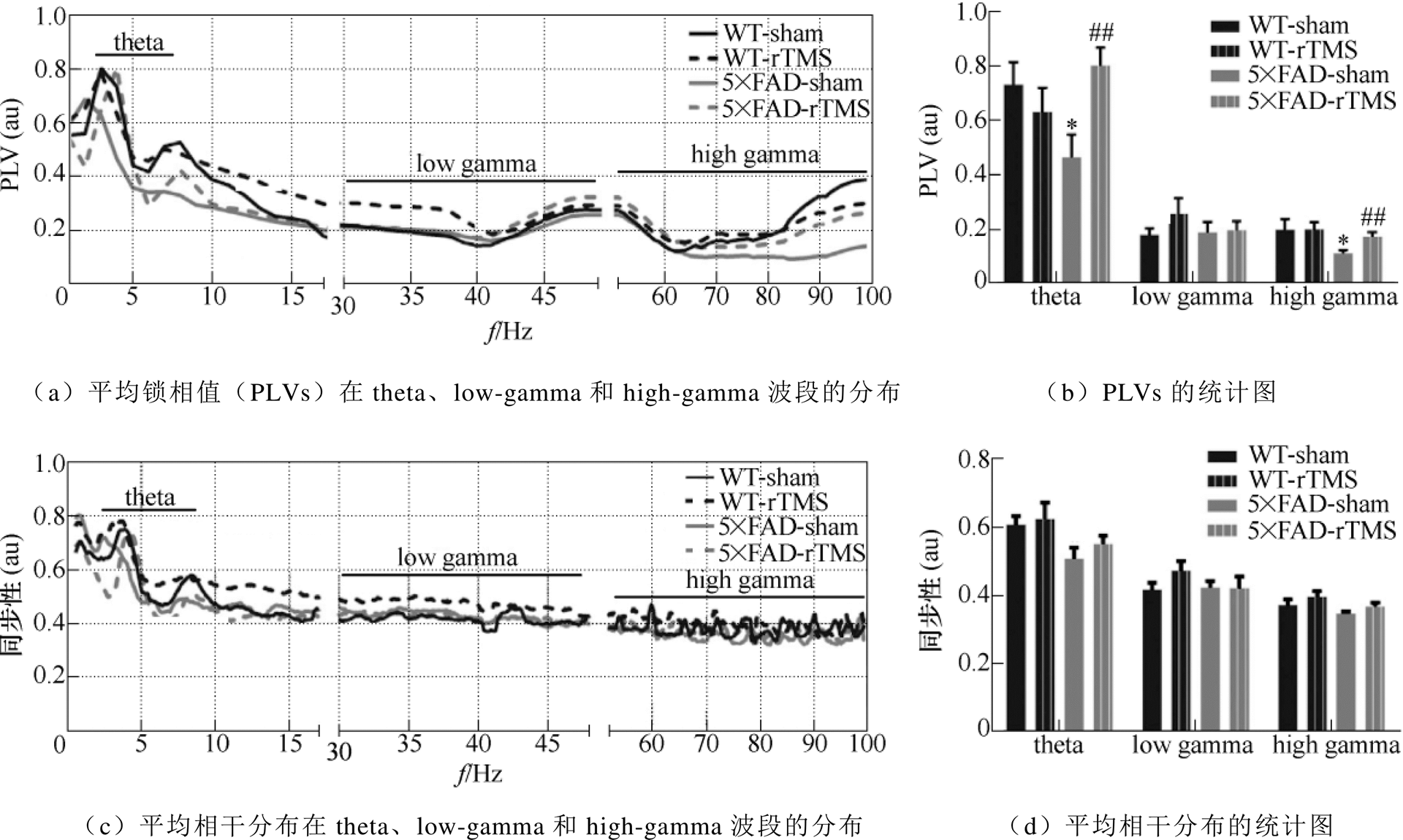
图3 海马PP和DG脑区间神经振荡的同步
Fig.3 The synchronization of neural oscillations between the hippocampal PP and DG regions
rTMS除了能够改善中枢神经系统疾病导致的认知功能障碍外,对其他形式的损伤所导致的认知功能障碍也有显著作用。在太空环境下,宇航员的学习认知能力会受到影响。由于受到空间、经费、环境等的限制,对处于真实太空环境中的人或动物进行相关机制的研究是十分困难的。因此,啮齿动物尾吊模型(rodent Hindlimb Unloading model, HU),如今被广泛应用于模拟微重力的研究。本课题组的研究指出,HU损伤了小鼠的认知功能,而给予小鼠15Hz的rTMS能够有效改善HU造成的小鼠新异物体识别记忆能力的损伤[18-19],两周HU联合rTMS对小鼠学习记忆的影响如图4所示[12]。图中,*p<0.05表示与Sham组比较,#p<0.05表示与HU组比较;n=8。同时还发现,rTMS能够有效预防HU造成的小鼠认知功能的损伤,同时发现,其机制与突触可塑性及其NR2B/CAMKⅡ/CREB通路的激活有关[20],蛋白水平的表达如图5所示[13]。图中,*p<0.05,**p< 0.01,***p<0.001表示与Sham组相比。#p<0.05,##p<0.01,###p<0.001表示与HU组相比;n=3。

图4 两周HU联合rTMS对小鼠学习记忆的影响
Fig.4 The effect of two-week HU combined with rTMS treatment on performances of mice in NOR test


图5 蛋白水平的表达
Fig.5 The measurements of proteins level
创伤后应激障碍(Post-Traumatic Stress Disorder, PTSD)指人在遭遇车祸、离婚和地震等重大压力后,其心理状态产生失调之后的遗症,有调查显示,在一个国家样本中PTSD的终生患病率为7.8%。经过药物治疗,虽然PTSD的大部分症状均能得到缓解,但负性的认知却常常给患者的学习与生活带来持久且恶劣的影响。近期,Li Yang等[21]发现高频(10Hz)和低频(0.5Hz)的rTMS能够明显改善PTSD的核心症状,同时患者的认知功能得到了极大改善,高频rTMS和低频rTMS治疗PTSD的疗效差别不大,其机制与rTMS能够抑制血清促炎因子(IL-2、IL-6和TNF-a)的分泌有关。重复经颅磁刺激提高认知能力的可能机制如图6所示。
综上所述,rTMS不仅能够提高正常生理状态的认知功能,还能够减缓各种神经系统疾病导致的认知功能障碍。虽然现阶段无法找到直接证据来证明rTMS对大脑作用的内在机制,但发现了rTMS能够介导BDNF、NMDAR、CAMKⅡ等蛋白的分泌和表达,进而调控突触可塑性。同时,rTMS抑制了胶质细胞炎性介质的释放,进而起到神经保护作用。然而,未来的创新研究需要以更直接的方式来研究rTMS是否真的对突触产生影响。如果rTMS线圈能在技术上得到改进[22-24],使局部刺激(例如对小型啮齿动物)成为可能,那将成为对机制研究的一个巨大的进步,这对于提高rTMS在神经和精神疾病治疗中的应用具有重要意义。
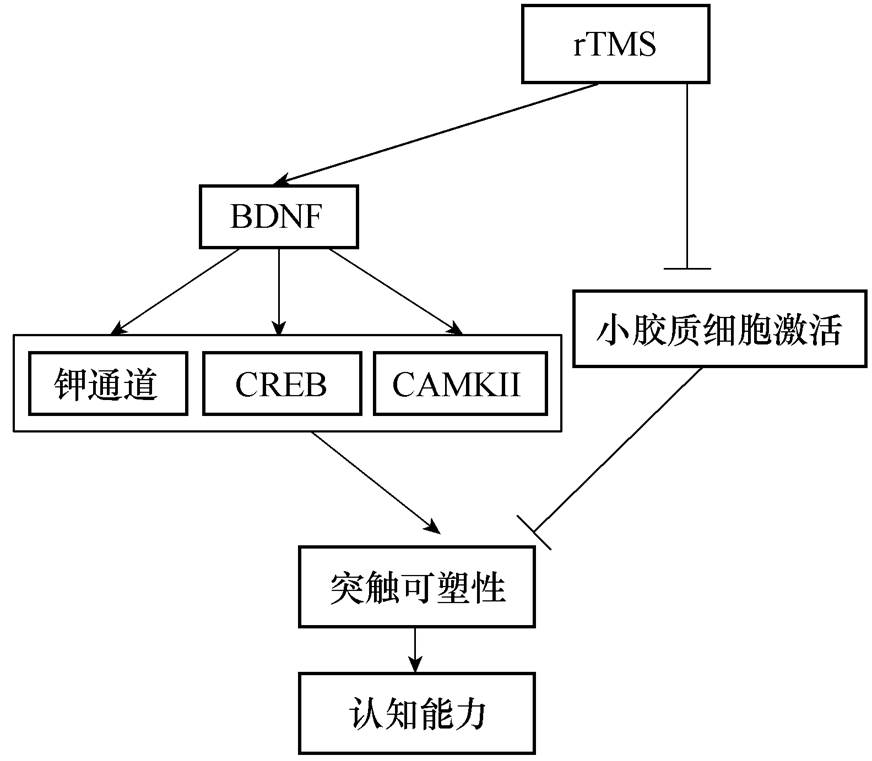
图6 重复经颅磁刺激提高认知能力的可能机制
Fig.6 Schematic diagram depicting possible mechanisms involved in effect of rTMS in cognitive ability
参考文献
[1] Klimesch W, Sauseng P, Gerloff C. Enhancing cognitive performance with repetitive transcranial magnetic stimulation at human individual alpha frequency[J]. European Journal of Neuroence, 2015, 17(5): 1129-1133.
[2] Wang J X, Rogers L M, Gross E Z, et al. Targeted enhancement of cortical-hippocampal brain networks and associative memory[J]. Science, 2014, 345(6200): 1054-1057.
[3] Erickson M A, Maramara L A, Lisman J. A single brief burst induces GluR1-dependent associative short-term potentiation: a potential mechanism for short-term memory[J]. Journal of Cognitive Neuro- science, 2010, 22(11): 2530-2540.
[4] 郭磊, 刘东钊, 黄凤荣, 等. 基于突触可塑性的自适应脉冲神经网络在高斯白噪声刺激下的抗扰功能研究(英文)[J]. 电工技术学报, 2020, 35(2): 225-235.
Guo Lei, Liu Dongzhao, Huang Fengrong, et al. Research on disturbance rejection of adaptive spiking neural network based on synaptic plasticity under white gaussian noise[J]. Transactions of China Electrotechnical Society, 2020, 35(2): 225-235.
[5] Shang Yingchun, Wang Xin, Shang Xueliang, et al. Repetitive transcranial magnetic stimulation effecti- vely facilitates spatial cognition and synaptic plasticity associated with increasing the levels of BDNF and synaptic proteins in Wistar rats[J]. Neurobiology of Learning and Memory, 2016, 134(Pt B): 369-378.
[6] O'Connor M, Brenninkmeyer C, Morgan A, et al. Relative effects of repetitive transcranial magnetic stimulation and electroconvulsive therapy on mood and memory: a neurocognitive risk-benefit analysis[J]. Cognitive and Behavioral Neurology, 2003, 16(2): 118-127.
[7] Bassi M S, Buttari F, Gilio L, et al. Inflammation and corticospinal functioning in multiple sclerosis: a TMS perspective[J]. Frontiers in Neurology, 2020, 11: 566.
[8] Myczkowski M L, Fernandes A, Moreno M, et al. Cognitive outcomes of TMS treatment in bipolar depression: safety data from a randomized controlled trial[J]. Journal of Affective Disorders, 2018, 235: 20-26.
[9] Shang Yingchun, Wang Xin, Li Fangjuan, et al. rTMS ameliorates prenatal stress-induced cognitive deficits in male- offspring rats associated with BDNF/TrkB signaling pathway[J]. Neurorehabil Neural Repair, 2019, 33(4): 271-283.
[10] 甄凤亚, 王硕, 周子璇, 等. 不同部位重复经颅磁刺激治疗对精神分裂症阴性症状及认知功能的影响[J]. 临床精神医学杂志, 2019, 29(1): 5-8.
Zhen Fengya, Wang Shuo, Zhou Zixuan, et al. Efficacy of high-frequency repetitive transcranial magnetic stimulation on different parts of the brain on negative symptoms and cognitive function in patients with schizophrenia[J]. Journal of Clinical Psychiatry, 2019, 29(1): 5-8.
[11] 孙丛丛, 周丹娜, 宁芳平, 等. 重复经颅磁刺激治疗难治性精神分裂症的增效作用研究[J]. 首都医科大学学报, 2018, 39(5): 641-645.
Sun Congcong, Zhou Danna, Ning Fangping, et al. Augmentation of rTMS in the treatment of refractory schizophrenia[J]. Journal of Capital Medical Univer- sity, 2018, 39(5): 641-645.
[12] Wang Furong, Zhang Yu, Wang Li, et al. Improve- ment of spatial learning by facilitating large- conductance calcium-activated potassium channel with transcranial magnetic stimulation in Alzheimer's disease model mice[J]. Neuropharmacology, 2015, 97: 210-219.
[13] 郭磊, 王瑶, 于洪丽, 等. 基于近似熵的磁刺激穴位脑功能网络构建与分析[J]. 电工技术学报, 2015, 30(10): 31-38.
Guo Lei, Wang Yao, Yu Hongli, et al. Brain functional network based on approximate entropy of EEG under magnetic stimulation at acupuncture point[J]. Transactions of China Electrotechnical Society, 2015, 30(10): 31-38.
[14] Cummins T D, Broughton M, Finnigan S. Theta oscillations are affected by amnestic mild cognitive impairment and cognitive load[J]. International Journal of Psychophysiology: Official Journal of the International Organization of Psychophysiology, 2008, 70(1): 75-81.
[15] Goutagny R, Gu N, Cavanagh C, et al. Alterations in hippocampal network oscillations and theta-gamma coupling arise before Ab overproduction in a mouse model of Alzheimer's disease[J]. European Journal of Neuroscience, 2013, 37(12): 1896-1902.
[16] Wang Sitong, Li Kai, Zhao Shaokai, et al. Early-stage dysfunction of hippocampal theta and gamma oscillations and its modulation of neural network in a transgenic 5xFAD mouse model[J]. Neurobiol Aging, 2020, 94: 121-129.
[17] Rektorova I, Megova S, Bares M, et al. Cognitive functioning after repetitive transcranial magnetic stimulation in patients with cerebrovascular disease without dementia: a pilot study of seven patients[J]. Journal of the Neurological Sciences, 2005, 229-230: 157-161.
[18] Zhang N, Xing M, Wang Y, et al. Repetitive transcranial magnetic stimulation enhances spatial learning and synaptic plasticity via the VEGF and BDNF-NMDAR pathways in a rat model of vascular dementia[J]. Neuroscience, 2015, 311: 284-291.
[19] Zhai Baohui, Fu Jingxuan, Xiang Shitong, et al. Repetitive transcranial magnetic stimulation ameli- orates recognition memory impairment induced by hindlimb unloading in mice associated with BDNF/ TrkB signaling[J]. Neuroscience Research, 2019, 153: 40-47.
[20] Xiang Shitong, Zhou Yu, Fu Jingxuan, et al. rTMS pre-treatment effectively protects against cognitive and synaptic plasticity impairments induced by simulated microgravity in mice[J]. Behavioural Brain Research, 2019, 359: 639-647.
[21] Li Yang, Wang Xue, Liu Qianru. An analysis of the effects of repetitive transcranial magnetic stimulation on cognitive function and serum pro-inflammatory cytokines in patients with post-traumatic stress disorder[J]. Hebei Medicine, 2020, 26(6): 971-975.
[22] 李江涛, 曹辉, 郑敏军, 等. 多通道经颅磁刺激线圈阵列的驱动与控制[J]. 电工技术学报, 2017, 32(22): 158-165.
Li Jiangtao, Cao Hui, Zheng Minjun, et al. The drive and control of multi-channel transcranial magnetic stimulation coil array[J]. Transactions of China Electrotechnical Society, 2017, 32(22): 158-165.
[23] 夏能弘, 朱益民, 程志远. 基于垂直中继线圈结构的L形无线充电装置设计与优化[J]. 电工技术学报, 2019, 34(13): 2671-2678.
Xia Nenghong, Zhu Yimin, Cheng Zhiyuan. Design and optimization of an L-shaped wireless charging device based on vertical repeater structure[J]. Transactions of China Electrotechnical Society, 2019, 34(13): 2671-2678.
[24] 熊慧, 王玉领, 付浩, 等. 一种应用于经颅磁刺激脉冲宽度可调的节能型激励源[J]. 电工技术学报, 2020, 35(4): 679-686.
Xiong Hui, Wang Yuling, Fu Hao, et al. An energy efficient excitation source for transcranial magnetic stimulation with controllable pulse width[J]. Transa- ctions of China Electrotechnical Society, 2020, 35(4): 679-686.
The Role of Repetitive Transcranial Magnetic Stimulation on Cognitive Function and Its Underlying Molecular Mechanism
Abstract Repetitive transcranial magnetic stimulation (rTMS), a noninvasive physical therapy that applies an alternating magnetic field to induce electrical currents in a local brain region, has been proposed as an approach for selectively altering neural activity, and is widely used in the clinical treatment of psychiatry and neurology. Cognitive dysfunction is the core symptom of many brain diseases and the major factor affecting patients’ quality of life. rTMS can significantly improve patients’ neural networks and is expected to be a treatment method for improving cognitive dysfunction. This paper mainly reviews the role of rTMS in normal physiological states and cognitive dysfunction caused by psychiatry, neurology and other diseases, as well as its underlying molecular mechanism.
keywords:Repetitive transcranial magnetic stimulation, cognitive function, synaptic plasticity, brain-derived neurotrophic factor
中图分类号:Q64
DOI: 10.19595/j.cnki.1000-6753.tces.201296
国家自然科学基金(32070988, 31771148)和天津市自然科学基金(18JCYBJC27400)资助项目。
收稿日期 2020-09-27
改稿日期 2020-10-20
尚莹春 女,1992年生,博士,研究方向为神经生物学。E-mail: shangyingchun@mail.nankai.edu.cn
张 涛 男,1957年生,教授,博士生导师,研究方向为神经生物学。E-mail: zhangtao@nankai.edu.cn(通信作者)
(编辑 崔文静)