0 引言
纳秒脉冲电场是一种新兴的肿瘤物理治疗方法。纳秒脉冲电场能够透过细胞膜作用到细胞核、线粒体、内质网、高尔基体等细胞器膜上产生纳米级的孔洞,同时会伴随Annexin-V绑定、Caspase激活、Cytochrome C释放等凋亡指标出现[1-7]。纳秒脉冲电场治疗肿瘤时,不需要药物的参与,且避免了炎症、溃疡等副作用。此外,欧道明大学A. G. Pakhomov、A. Rossi等新近发现,纳秒脉冲可诱导肿瘤细胞免疫原性死亡,激活机体抗肿瘤免疫应答[8-9],为纳秒脉冲联合免疫疗法治疗肿瘤提供了契机。
为更好地研究纳秒脉冲电场作用下细胞核膜上的电穿孔效应,麻省理工学院J. C. Weaver等采用网格传输模型仿真研究了纳秒脉冲电场作用下细胞膜与细胞核膜的电穿孔效应,发现纳秒脉冲电场能够同时作用于细胞膜与细胞核膜上产生电穿孔[10]。米彦采用场-路复合模型仿真分析了细胞内外膜跨膜电位时频特性,发现纳秒脉冲能够作用于细胞核膜,并使内膜发生穿孔,从而诱导细胞凋亡效应[11]。卢布尔雅那大学D. Miklavčič等基于有限元数值分析方法,对建立的球形单细胞的多层介电模型研究发现,纳秒脉冲作用下细胞核膜的跨膜电压峰值可大于细胞膜的跨膜电压,其大小受细胞核膜及内部基质的结构参数和电气参数影响[12]。
上述文献表明,纳秒脉冲电场作用下细胞核膜是诱导肿瘤细胞凋亡的重要作用靶区,此外,姚陈果团队新近的实验与仿真研究发现,由于肿瘤耐药细胞的核质比较大,相比常规肿瘤细胞,纳秒脉冲电场能够优先杀伤肿瘤耐药细胞。这为临床中杀伤耐药细胞提供了一种新型途径[13]。而核膜的电穿孔程度与其本身的形态等特性密切相关[4],然而,已往的仿真研究中仅将细胞核膜简单等效为完整的形态进行理论分析,但文献表明,核膜上存在大量的核孔复合体(Nuclear Pore Complexes, NPC),其结构较为复杂,主要结构为胞质环、核质环、辐、中央栓[14-16],中央栓是位于NPC中心的中空通道,小分子物质可通过扩散作用自由进出,因此,具有高电导率的特性[17-18]。典型单个哺乳细胞核膜上有3 000~4 000个NPC,直径40~125nm[19],NPC的存在是否对纳秒脉冲电场作用下的细胞核电穿孔效应具有显著性的影响目前犹未可知,因此,本文建立了考虑细胞核上NPC存在的五层细胞介电模型,分析电穿孔关键参数跨膜电压、孔密度参数的时空变化特性,研究纳秒脉冲作用下NPC对细胞电穿孔程度的影响,通过对比无NPC存在下细胞核膜的电穿孔程度,表明NPC的存在会使附近一定区域内的细胞核膜电穿孔状态发生显著性的改变,影响区域大小与NPC个数及分布相关。
1 模型建立
选用COMSOL软件进行仿真计算,模型如图1所示。求解域由电极、球形细胞组成,其中,电极尺寸为200μm×1μm矩形,电极间距为198μm,考虑NPC作用的细胞介电模型如图1b所示。为减少网格计算量,提高仿真准确度,细胞膜、核膜设置为接触阻抗,厚度分别为5nm、40nm[20]。为研究NPC的存在对周围细胞核膜电穿孔的影响,本文的研究分为两部分,首先是在无NPC存在下研究细胞核膜上电穿孔的时空分布作为对比;其次在存在NPC状态下分析细胞核膜上电穿孔的时空分布规律。因电穿孔程度与细胞核膜上的空间位置相关,本文对细胞核膜上的区域进行等距离设置NPC,总数量为8,其介电参数参考电穿孔设定,仿真参数见表1[13]。

图1 COMSOL仿真计算模型
Fig.1 The simulation model in COMSOL
根据式(1)求解细胞膜、核膜电位Ψ为
式中,ε0为真空介电常数;εr为相对介电常数;σ 为电导率;t为时间;∇为梯度算子。
细胞膜、核膜接触阻抗的初始电导率分别为σmem0、σne0,但电穿孔后的磷脂双分子层通透性提高会导致其等效电导率增大,该部分以σmemt、σnet表示,则考虑穿孔效应的细胞膜电导率定义(核膜与细胞膜计算原理相同,下面以核膜为例进行推导)为
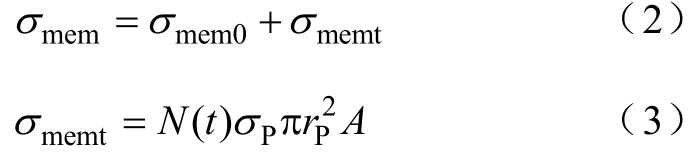
其中
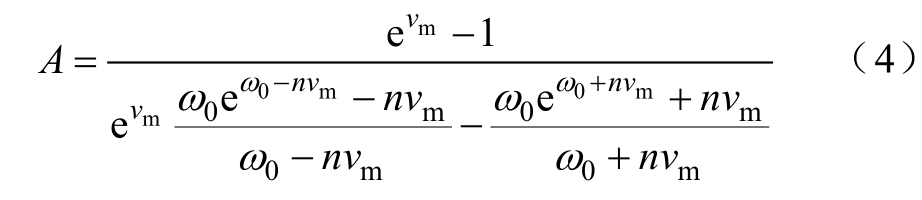
式中,N为电穿孔密度;σP为空隙电导率;rP为穿孔孔半径;n为孔的相对密度。通过微分方程求解相应变量,有
表1 仿真计算参数
Tab.1 Simulation parameters

参 数 数 值 细胞半径rc/μm 10 核质比NCR 0.8 细胞核半径rn/μm 5 细胞膜厚度hmem/nm 5 细胞核膜厚度hne/nm 40 细胞外介质电导率σm/(S/m) 0.2 细胞膜电导率σmem0/(S/m) 3×10−7 细胞质电导率σc/(S/m) 0.3 细胞核膜电导率σne0/(S/m) 6×10−3 细胞核质电导率σnp/(S/m) 1.35 孔隙电导率σp/(S/m) 0.22 真空介电常数ε0/(m−3kg−1s−4A2) 8.85×10−12 细胞外介质介电常数εm 80ε0 细胞膜介电常数εmem 8.57ε0 细胞质介电常数εc 154.4ε0 细胞核膜介电常数εne 28ε0 细胞核质介电常数εnp 52ε0 穿孔系数α/(m−2s−1) 1×109 孔径rP/m 0.8×10−9 初始孔密度N0/m−2 1.5×109 穿孔特征电压UEP/mV 170 静息电位Vrest/mV 80 穿孔有效形成率系数q 2.46 孔的相对密度n 0.15 孔隙阻碍能量系数ω0 2.65 法拉第常数F/(C/mol) 9.65×10−4 气体常数R/(K−1mol−1) 8 314 绝对温度T/K 295 亲水孔最小半径r*/m 0.51×10−9 孔隙扩散系数D/(m−2s−1) 5×10−14 空间排斥能β/J 1.4×10−19 边沿能γ/(J/m) 1.8×10−11 未穿孔膜表面能δ0/(J/m2) 1×10−6 碳水化合物-水界面能δ′/(J/m2) 2×10−2 最大电场作用力Fmax/(N/V2) 0.70×10−9 平流速度常数1 rh/m 0.97×10−9 平流速度常数2 rt/m 0.31×10−9
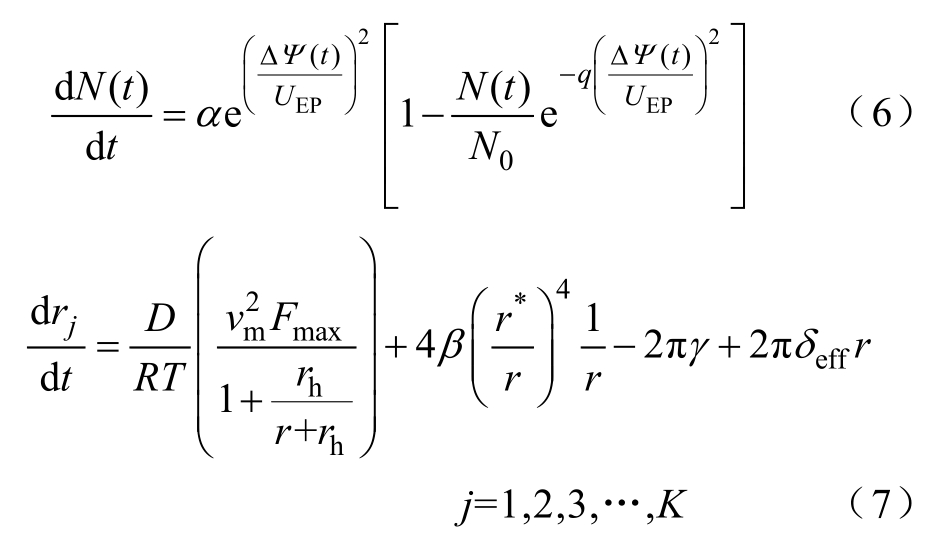
式中,ΔΨ (t)为细胞膜内外电位差;rj为时变穿孔半径;r≥r*;F、R分别为法拉第常数、气体常数;T为热力学温度。式(7)中,第一项为跨膜电位产生的电场力;第二项为磷脂双分子层亲水性头部空间排斥力;第三项为微孔边沿线性张力;第四项为细胞膜表明张力,膜的有效张力系数δeff为
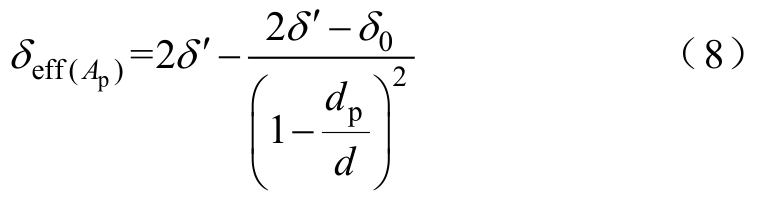
式中,δ0为未穿孔细胞膜的单位面积的表面能;δ′为碳水化合物-水交界面的单位面积的表面能;dp为所有穿孔的孔面积之和;d为细胞膜表面积。
为提高仿真结果准确性,选取平行于电场方向的最大截面进行分析[21-23]。其中,施加的方波脉冲宽度为50ns、幅值为300V、上升沿和下降沿各设置为5ns,仿真模拟时间为0~160ns,最大步长为1ns。上述参数方程代入COMSOL软件的电流模块和偏微分模块求解后,进行相关仿真研究。
2 结果与分析
2.1 对细胞膜电穿孔的影响
本文首先分析纳秒脉冲电场作用下NPC对细胞膜电穿孔的影响。图2为θ =0°处(A点)孔密度、跨膜电压随时间的变化曲线,图2a表明纳秒脉冲作用期间,孔密度瞬间激增至稳定值;图2b表明纳秒脉冲作用期间,跨膜电压达到穿孔阈值后迅速降低。 曲线变化高度重合表明NPC的存在不会对细胞膜A点电穿孔产生明显的影响。

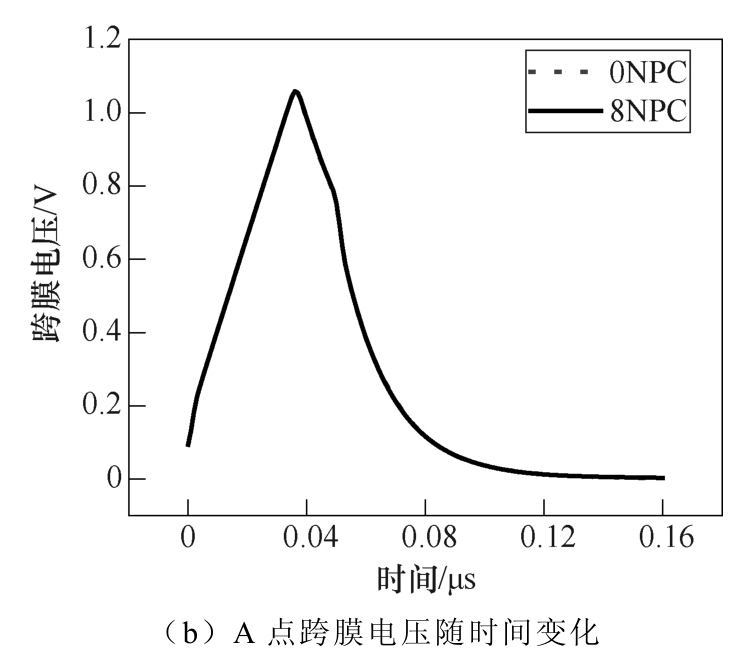
图2 NPC对A点的孔密度、跨膜电压的时间特性影响
Fig.2 The effect on the time characteristics of pore density and transmembrane voltage at piont A
图3为纳秒脉冲作用后细胞膜的孔密度、跨膜电压的空间分布。因其他时刻下的细胞膜孔密度和跨膜电压随相位变化曲线所得结果与脉冲电场作用后(t =50ns)的孔密度和跨膜电压随相位变化曲线结果基本相同,这里主要展示t =50ns的跨膜电压和孔 密度变化曲线。从图中可以看出,NPC的存在也未对细胞膜电穿孔产生明显的影响,本文重点分析NPC对核膜电穿孔的影响。
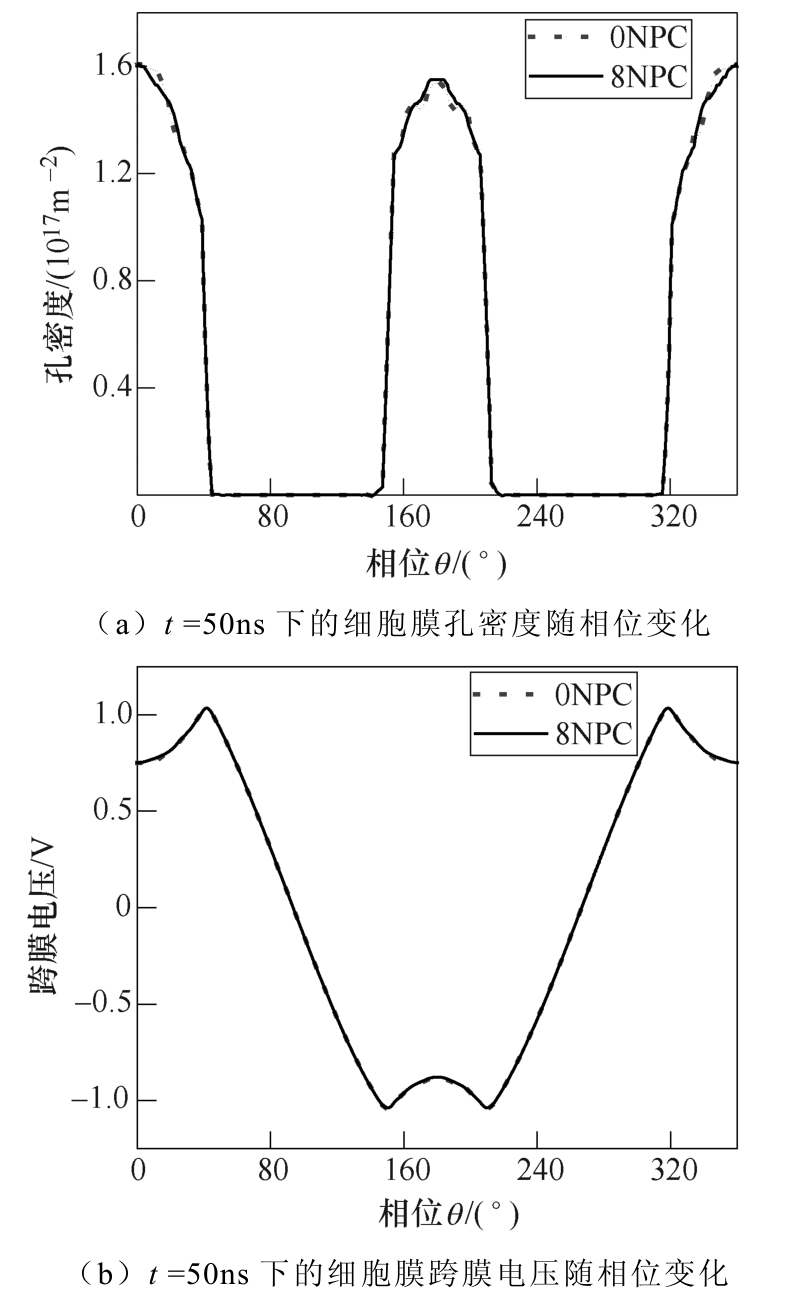
图3 NPC对细胞膜的孔密度、跨膜电压的 空间特性影响
Fig.3 The effect on the spatial characteristics of pore density and transmembrane voltage on cell membrane
2.2 对核膜电穿孔的影响
本节首先分析距离NPC1 1nm处(见图1中M点)跨膜电压、孔密度的时间变化特性。图4a为NPC对M点跨膜电压的影响。在无NPC时,M点的跨膜电压迅速上升至1.09V,脉冲结束后跨膜电压下降至0.51V。当M点附近存在NPC时,其跨膜电压的峰值仅为0.64V。脉冲结束后,跨膜电压下降至0.53V。上述对比表明,NPC的存在会降低M点的跨膜电压的幅值。图4b为NPC对M点孔密度的影响。当M点无NPC时,M点的孔密度迅速上升至1.6×1018m−2;当M点存在NPC时,M点孔密度仅为1×107m−2,表明NPC的存在对周围电穿孔特性有显著性影响。

图4 NPC对M点的跨膜电压、孔密度的时间特性影响
Fig.4 The effect on the time characteristics of transmembrane voltage and pore density at piont M
为研究NPC分布对核膜电穿孔分布的影响,同时定量分析NPC有效作用区域,图5分析了不同脉冲电场作用时刻(t =10ns, 30ns, 50ns)的跨膜电压空间分布,其NPC的位置如图5的黑色小圆所示。脉冲上升期间(t =10ns),NPC区域的跨膜电压较NPC=0下降幅度最大可达55.3%,在脉冲作用期间与脉冲作用后,跨膜电压的空间分布差异逐渐变大,表明NPC对周围区域的电穿孔影响范围也在逐渐扩大。

图5 NPC对核膜的跨膜电压空间特性影响, 圆圈代表NPC及其所在位置
Fig.5 The effect on the spatial characteristics of transmembrane voltage on nuclear membrane, where the circle represents NPC
图6为脉冲电场作用后(t =50ns),NPC对核膜孔密度的影响。通过对比发现,NPC周围的孔密度显著性低于未设置NPC时的孔密度,如NPC-1、NPC-2区域内孔密度峰值减少90%以上,表明该部分区域由穿孔状态转变为穿孔程度较小甚至未穿孔状态。
为进一步量化NPC影响范围,小于初始孔密度N0 的区域定义为未穿孔,同时定义电穿孔衰减系数αk为
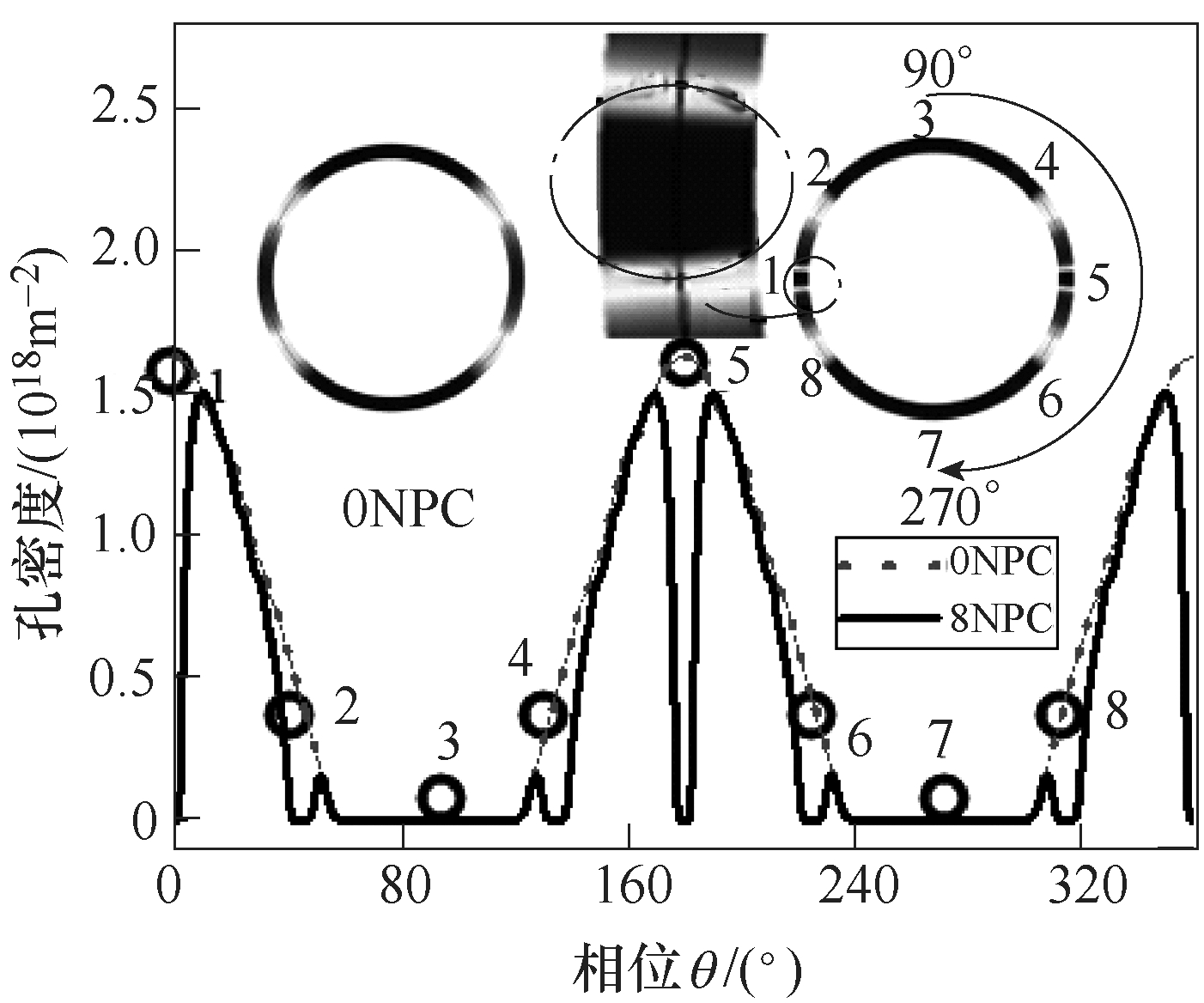
图6 NPC对核膜的孔密度空间特性影响
Fig.6 The effect on the spatial characteristics of pore density on nuclear membrane
式中,Ni为核膜上第i点在模型中没有设定NPC条件下得到的孔密度数值;NNPCi为第i点在模型中设定NPC条件下得到的孔密度数值。电穿孔衰减系数αk 达到90%以上且大于N0的区域定义为严重衰减;电穿孔衰减系数αk为50%~90%的区域定义为中度衰减;电穿孔衰减系数αk为10%~50%的区域定义为轻度衰减。
在模型中设定NPC个数为8的条件下,分别计算未穿孔和严重衰减区域(αk≥90%)大小,结果如图7所示。

图7 未穿孔、穿孔程度较小区域示意图
Fig.7 The none-electroporation and less-electroporation regions of nuclear membrane produced by NPC
从图7可明显看出,因90°与270°区域本身在无NPC时不会发生电穿孔,所以,此区域即使存在NPC,也不会对结果产生明显的影响。而在其他NPC周围,均有一定区域内的核膜由电穿孔状态转变为穿孔程度较小甚至未穿孔状态,其中,在45°、135°、225°、315°附近影响的范围最广,未穿孔、严重衰减的相位区域分别为1.68°、6.90°,而0°、180°附近的响应区域只有1.06°、3.88°,即不同位置下的NPC对核膜电穿孔影响程度不同,半径方向电场强度较弱的区域对NPC相对敏感。弧长I与相位θ 转换公式为
经计算可得,在当前设定条件下,单一的NPC对细胞核膜电穿孔产生影响的范围可达617.8nm,其中,距离NPC较近的66.6nm范围内的细胞核膜由穿孔状态转变为未电穿孔状态。
上述分析表明,NPC对细胞核膜附近区域电穿孔状态具有显著性影响,为研究NPC的存在及个数对整体细胞核膜上电穿孔的影响,本文分别计算了NPC个数分别为2、4、8、16、32时核膜未穿孔、电穿孔程度严重衰减、中度衰减、轻度衰减的区域大小,其中,NPC进行等距离分布,例如,当NPC=2时,每隔180°设置NPC;当NPC=16时,每隔22.5°设置NPC。核膜未穿孔、穿孔程度衰减区域随NPC个数变化趋势如图8所示,区域百分比为核膜电穿孔衰减区域与没有NPC存在时核膜的总电穿孔区域大小(23 774.58nm)的百分比值。

图8 核膜未穿孔、穿孔程度衰减区域随 NPC个数变化趋势
Fig.8 The area size of none and decay electroporation and varies with the number of NPC
与无NPC存在下的电穿孔程度相比,随着NPC个数的增加,未穿孔、穿孔程度衰减区域逐渐增加,当NPC=32,轻度衰减、中度衰减、严重衰减的区域分别为89.93%、36.00%、22.94%,表明绝大部分核膜电穿孔程度都因NPC的存在受到不同程度的影响;由电穿孔区域转变为未穿孔区域的百分比为2.54%,而典型哺乳动物核膜NPC个数可达3 000~4 000(合成功能旺盛的细胞具有更多的NPC数量,而癌细胞普遍具有旺盛的合成功能),这必然导致核膜在一定电场强度下无法形成大面积电穿孔区域,造成类似“电场屏蔽”效果,从而影响基于电穿孔疗法的治疗效果。因此,在进行脉冲电场参数设计和优化过程中,应充分考虑NPC的存在导致核膜电穿孔效应衰减的影响。
本文通过两种模型(传统细胞五层介电模型和含核孔复合体的细胞五层介电模型)分析了细胞核膜上电穿孔的空间分布规律,通过对比表明,核孔复合体的存在会极大地降低其周围细胞核区域电穿孔效应及整体细胞核电穿孔的程度。本文模型将核孔复合体设定为均匀分布,从而研究不同位置上核孔复合体对附近区域电穿孔程度的影响,然而,核孔复合体的数量、分布与细胞生理状态关系密切,不同种类的哺乳细胞核复合体的数目及大小有所不同,即使是同一细胞在不同阶段也会有所差异。后续将选取核孔复合体分布存在较大差异的哺乳类细胞,完善本文模型中核孔复合体的空间分布设置,并通过纳秒脉冲电场细胞实验,分析不同类别细胞的核膜电穿孔程度差异,进一步验证仿真所得到的结论。
3 结论
本文建立了考虑NPC作用的五层介电模型,利用COMSOL软件电流模块和偏微分模块分析了细胞电穿孔过程中的关键参数跨膜电压、孔密度的时空变化特性,得到主要结论如下:
1)NPC的存在会导致附近一定区域内的核膜由电穿孔状态转变为未电穿孔,并且也会显著性衰减周围一定核膜区域的电穿孔程度,离核膜越近,其衰减程度越大,单一NPC(半径为80nm)对核膜电穿孔产生影响的范围可达617.8nm(衰减90%),其中,距离NPC较近的66.6nm范围内的核膜由穿孔状态转变为未电穿孔状态。
2)NPC附近核膜电穿孔衰减程度也与NPC的位置相关,半径方向电场强度较弱的区域对NPC相对敏感。相位在45°、135°、225°、315°区域对NPC相对敏感,而在90°、270°区域设置核孔时对电穿孔的发展没有影响。
3)随着NPC数目的增加,与无NPC状态下的电穿孔程度对比,核膜上电穿孔受影响的区域可达89.93%,而电穿孔程度严重衰减的区域也达到22.94%。较多数量的NPC将会产生类似“电场屏蔽”现象,严重影响基于纳秒脉冲电场靶向作用细胞核进而治疗肿瘤的效果。
[1] Rems L, Miklavcic D. Tutorial: electroporation of cells in complex materials and tissue[J]. Journal of Applied Physics, 2016, 119(20): 201101.
[2] Yarmush M L, Golberg A, Sersa G, et al. Electroporation- based technologies for medicine: principles, appli- cations, and challenges[J]. Annual Review of Bio- medical Engineering, 2014, 16(1): 295-320.
[3] 姚陈果. 新型复合脉冲不可逆电穿孔治疗肿瘤关键技术及临床应用研究进展[J]. 高电压技术, 2018, 44(1): 248-263.
Yao Chenguo. Key technology and progress of novel composite pulse irreversible electroporation for tumtor treatment with its clinical application[J]. High Voltage Engineering, 2018, 44(1): 248-263.
[4] 姚陈果, 宁郡怡, 刘红梅, 等. 微/纳秒脉冲电场靶向不同尺寸肿瘤细胞内外膜电穿孔效应研究[J]. 电工技术学报, 2020, 35(1): 115-124.
Yao Chenguo, Ning Junyi, Liu Hongmei, et al. Study of electroporation effect of different size tumor cells targeted by micro-nanosecond pulsed electric field[J]. Transactions of China Electrotechnical Society, 2020, 35(1): 115-124.
[5] 陈新华, 孙军辉, 殷胜勇, 等. 脉冲电场与生物医药技术的交叉及其对肿瘤治疗模式的改变[J]. 高电压技术, 2014, 40(12): 3746-3754.
Chen Xinhua, Sun Junhui, Yin Shengyong, et al. Interaction of pulsed electric field and biomedicine technology and the influence on solid tumor therapy[J]. High Voltage Engineering, 2014, 40(12): 3746-3754.
[6] 唐靖超, 殷海荣, 马佳路, 等. 纳秒电脉冲作用下KcsA-膜蛋白体系电穿孔的分子动力学模拟(英文)[J]. 真空电子技术, 2019, 338(1): 19-25.
Tang Jingchao, Yin Hairong, Ma Jialu, et al. Electro- poration of KcsA membrane protein system under nanosecond pulsed electric field: a molecular dynamics simulation[J]. Vacuum Electronics, 2019, 338(1): 19-25.
[7] 米彦, 刘权, 李盼, 等. 低强度纳秒脉冲电场联合靶向金纳米棒对A375黑色素瘤细胞的杀伤效果研究[J]. 电工技术学报, 2020, 35(12): 2534-2544.
Mi Yan, Liu Quan, Li Pan, et al. Study of killing effects of A375 melanoma cells treated by low intensity nanosecond pulsed electric fields combined with targeted gold nanorods[J]. Transactions of China Electrotechnical Society, 2020, 35(12): 2534-2544.
[8] Pakhomov A G, Pakhomova O N. The interplay of excitation and electroporation in nanosecond pulse stimulation[J]. Bioelectrochemistry, 2020, 136: 107598.
[9] Rossi A, Pakhomova O N, Mollica P A, et al. Nanosecond pulsed electric fields induce endoplasmic reticulum stress accompanied by immunogenic cell death in murine models of lymphoma and colorectal cancer[J]. Cancers, 2019, 11(12): 2034-2052.
[10] Gowrishankar T R, Weaver J C. An approach to electrical modeling of single and multiple cells[J]. Proceedings of the National Academy of Sciences, 2003, 100(6): 3203-3208.
[11] 米彦. 纳秒脉冲电场诱导肿瘤凋亡的窗口效应与实验研究[D]. 重庆: 重庆大学, 2009.
[12] Tadej K, Miklavčič D. Theoretical evaluation of voltage inducement on internal membranes of biolo- gical cells exposed to electric fields[J]. Biophysical Journal, 2006, 90(2): 480-491.
[13] 刘红梅, 董守龙, 宁郡怡, 等. 纳秒脉冲高频透膜效应优先杀伤化疗抗性肿瘤细胞的仿真与实验研究[J]. 电工技术学报, 2019, 34(22): 4839-4848.
Liu Hongmei, Dong Shoulong, Ning Junyi, et al. Simulation and experimental study on preferential killing of chemoresistance tumor cells induced by the high-frequency permeation effect of nanosecond pulse field[J]. Transactions of China Electrotechnical Society, 2019, 34(22): 4839-4848.
[14] Kosinski J, Mosalaganti S, Appen A, et al. Molecular architecture of the inner ring scaffold of the human nuclear pore complex[J]. Science, 2016, 352(6283): 363-365.
[15] Lin D H, Stuwe T, Schilbach S, et al. Architecture of the symmetric core of the nuclear pore[J]. Science, 2016, 352(6283): 10151-101518.
[16] Ohno M, Fornerod B, Mattaj W. Nucleocytoplasmic transport: the last 200 nanometers[J]. Cell, 92(3): 327-336.
[17] Beck M, Vladan V, Friedrich F, et al. Snapshots of nuclear pore complexes in action captured by cryo- electron tomography[J]. Nature, 2007, 449(7162): 611-615.
[18] Peters R. Functionalization of a nanopore: the nuclear pore complex paradigm[J]. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 2009, 1793(10): 1533-1539.
[19] 翟中和, 王喜忠, 丁明孝. 细胞生物学[M]. 4版. 北京: 高等教育出版社, 2011.
[20] 张玉, 张琳, 刘欣, 等. 纳秒脉冲作用下球形细胞电穿孔过程仿真[J]. 高电压技术, 2018, 44(10): 3307-3313.
Zhang Yu, Zhang Lin, Liu Xin, et al. Simulation of electroporation process of spherical cell with nanosecond pulsed electric fields[J]. High Voltage Engineering, 2018, 44(10): 3307-3313.
[21] 姚陈果, 刘红梅, 赵亚军, 等. 基于有限元分析的球形单细胞及不规则真实细胞电穿孔动态过程仿真[J]. 高电压技术, 2016, 42(8): 2479-2486.
Yao Chenguo, Liu Hongmei, Zhao Yajun, et al. Simulation on the process of electroporation in spherical single-cell and irregularly shaped real cells based on finite elements analysis[J]. High Voltage Engineering, 2016, 42(8): 2479-2486.
[22] 张帅, 李子秀, 张雪莹, 等. 基于时间反演的磁动力超声成像仿真与实验[J]. 电工技术学报, 2019, 34(16): 3303-3310.
Zhang Shuai, Li Zixiu, Zhang Xueying, et al. The simulation and experiment of magneto-motive ultra- sound imaging based on time reversal method[J]. Transactions of China Electrotechnical Society, 2019, 34(16): 3303-3310.
[23] 朱寒, 何湘, 陈秉岩, 等. 容性耦合射频放电等离子体的仿真模拟与实验诊断研究[J]. 电工技术学报, 2019, 34(16): 3504-3511.
Zhu Han, He Xiang, Chen Bingyan, et al. Simulations and experimental diagnostic of capacitively coupled RF discharge plasma[J]. Transactions of China Elec- trotechnical Society, 2019, 34(16): 3504-3511.