0 引言
经颅磁刺激技术是一种无创、非侵入式的神经调控技术[1-2],其利用电磁感应原理,将脑组织置于脉冲电流产生的时变磁场之下[3-4],在大脑皮层中诱导产生感应电场,促使神经元发生迅速的去极化,从而引起某些生理反应,达到调节神经系统及其认知功能的效果[5-6]。经颅磁刺激技术作为重要的神经调控手段被广泛用于抑郁症、精神分裂症及阿尔茨海默症等疾病的治疗与研究中[7-8]。
重复性经颅磁刺激(repetitive Transcranial Magnetic Stimulation, rTMS)是重要的经颅磁刺激模式之一,已发展成为重要的神经调控技术并广泛使用于临床诊疗中[9]。Theta节律刺激(Theta Burst Stimulation, TBS)是模拟中枢神经系统动作电位爆发性放电模式而改进的新兴rTMS模式[10]。标准的rTMS是以一定频率发放脉冲刺激,而TBS以簇状或丛状的形式发放刺激,它的丛间刺激频率为5Hz、丛内频率为50Hz。TBS可分为连续性Theta节律刺激(continuous Theta Burst Stimulation, cTBS)和间断性Theta节律刺激(intermittent Theta Burst Stimulation, iTBS)[10]。cTBS连续不间断地发放丛刺激,作用时间通常为20~40s;iTBS每隔8s发放一段2s的丛刺激;iTBS和cTBS在临床和研究中应用广泛,iTBS能够增加皮层兴奋性,而cTBS能够降低皮层兴奋性[9-10]。与标准的rTMS相比,TBS可以以较低的刺激强度在较短时间内对特定神经元集群产生持久的后效应,被认为是更加有效的刺激手段[10]。
工作记忆(Working Memory, WM)是认知心理学中的重要概念,是一种对信息进行短时加工存储的容量有限的记忆系统,在许多复杂的认知活动中起重要作用。工作记忆障碍是神经精神类疾病如阿尔茨海默症的主要临床表现之一。近年来,TMS结合在体多通道电生理记录技术探索工作记忆神经电生理活动的研究方法发展迅速。K. Wimmer等[11]研究表明,前额叶皮层(Prefrontal Cortex, PFC)是工作记忆功能的主要责任脑区之一。S. Laroche等[12]发现,大鼠前额叶皮层的功能异常导致认知功能障碍。认知功能障碍是神经精神类疾病的显著症状之一,工作记忆障碍则是认知功能障碍的主要表现[13-15],陈忠等[16]研究表明,通过TMS刺激WM相关脑区能够有效改善工作记忆障碍等症状。Guo Zhiwei 等[17]发现,用5Hz高频rTMS作用于左侧背外侧前额叶皮层能够改善由睡眠剥夺导致的工作记忆障碍。S. De Witte等[18]证实了iTBS能改善抑郁症患者的压力恢复过程。F. Di Lorenzo等[19]将iTBS作用于小脑-丘脑皮质通路,证实了iTBS能够有效调节胆碱能神经元功能,从而促进阿尔茨海默症的治疗。C. M. Cheng等[20]将iTBS、cTBS以及二者结合的模式应用于抗药性抑郁症治疗中。研究结果表明,左前额叶的iTBS相比于其他两种方法更有效,能够显著改进患者工作记忆的执行能力。
TMS在神经精神类疾病的治疗和调控领域应用广泛,其中,TBS模式能在短期作用后对皮层兴奋性产生更有效的影响,在神经调控中具有很好的应用前景。但TMS对工作记忆功能的作用机制尚无具体定论,其仍是一个复杂的问题;且各模式及其不同参数TMS对神经系统的影响差异较大,目前尚无公认标准,在实际的应用中仍存在一定的盲目性[21]。因此,探究TMS技术对WM的调控机制有重要的临床意义。
脑网络是近年来新兴的脑科学前沿领域,其中,脑功能网络是依赖于神经信号的脑网络,不同层次神经信号的脑功能网络反映了不同水平神经单元的功能连接关系。局部场电位(Local Field Potential, LFPs)能够反映神经元的局部网络活动状态。大量研究表明,LFPs信号中的θ 频段以及γ 频段的信号参与了哺乳动物工作记忆功能编码[22-26]。在体多通道电生理记录技术能够获得实验对象大脑某些区域的LFPs。LFPs能够反映神经元局部网络的活动状态且LFPs信号相对其他信号有更好的行为特异性及时空分辨率。脑功能网络的指标主要有皮尔森相关系数、相干性、相锁值、互信息以及因果关系等。线性相关程度是一种重要的变量之间关系的评估方法,皮尔森相关系数是较为常用的线性相关性分析方法,其主要反映两个变量的线性相关程度。通过对目标脑区的脑电信号进行加窗截断,可以获取在体多通道电生理记录技术电极间的动态功能连接关系。
本文以rTMS、cTBS及iTBS三种刺激模式的大鼠实验模型与无刺激对照组大鼠模型为研究对象,结合在体多通道电生理记录技术与T迷宫工作记忆行为学任务实验,从局部脑功能网络的角度入手,基于LFPs信号数据构建脑功能网络,探究不同模式TMS对WM影响的差异,以促进TMS刺激模式的优化,为TMS在临床应用及脑认知功能领域的研究提供参考。
1 材料与方法
本文以成年雄性Wistar大鼠为实验对象,首先制备三种磁刺激模式下的模型鼠,之后对大鼠实施在体多通道微电极植入手术,最后进行T迷宫工作记忆行为学任务实验,同时记录实验过程中大鼠的脑电数据。实验整体时间进度如图1所示。实验结束后统计大鼠的行为学参数,基于皮尔森相关系数构建LFPs网络并分析其网络连接特性。
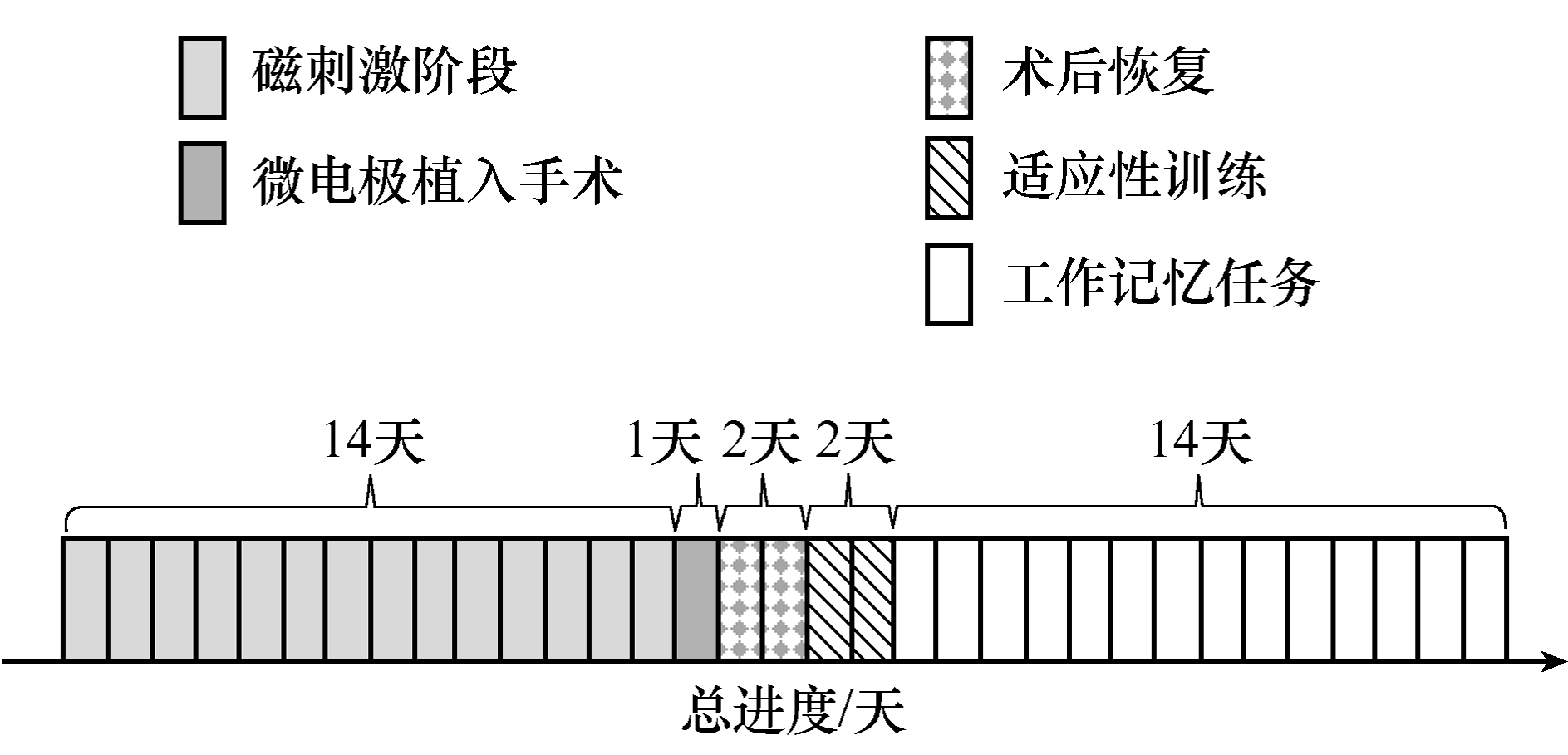
图1 实验整体时间进度
Fig.1 The arrangement of experimental schedule
1.1 动物实验模型
本文以8~9周龄体重约300g的成年雄性Wistar大鼠作为实验模型。将实验模型鼠随机分为四组,分别记为control组(空白组)、rTMS组(重复组)、cTBS组(连续组)及iTBS组(间断组),每组6只。本实验所有程序均已由河北工业大学生物医学伦理委员会审查通过(审查编号:HEBUTaCUC201905)。
1.2 实验模型制备
除control组外,其余三组实验大鼠均需接受磁刺激。磁刺激设备采用英国Magstim公司生产的Rapid2重复经颅磁刺激系统,其刺激频率范围为0~100Hz,刺激强度最大值为2.2T,刺激时间连续可调节,刺激线圈采用8字型线圈。对大鼠进行磁刺激前需先确定刺激强度,为此,需先测量大鼠的运动阈值,得到测量结果的平均值作为磁刺激强度(22%最大机器输出)。rTMS组使用5Hz的刺激频率对大鼠头部前额叶区域进行120s的rTMS刺激,cTBS组进行40s的cTBS刺激,iTBS组进行200s的iTBS刺激,保证每只大鼠均接受600个刺激脉冲。三种磁刺激模式示意图如图2所示。

图2 三种模式刺激示意图
Fig.2 Three patterns of transcranial magnetic stimulation
每只大鼠每天刺激一次,每次600个脉冲,刺激持续14天,期间对control组进行除刺激外的全部相同操作。
1.3 在体多通道微电极植入手术
为采集大鼠在进行T迷宫任务过程中的脑电信号,需对大鼠实施在体多通道微电极植入手术,手术开始前24h对大鼠进行禁食但保证其饮水。在体多通道微电极植入手术准备工作包括向模型鼠的腹腔注射水合氯醛(40mg/kg)以对大鼠进行麻醉,再进行皮下注射阿托品以减少大鼠的呼吸道分泌。待模型鼠完全麻醉后,将大鼠的头部毛发剔除并将大鼠头部固定到立体定位仪上。完成准备工作后正式开始在体多通道微电极植入手术:切开模型鼠头皮,使其颅骨暴露以找出冠状缝与矢状缝的交点,参考大鼠脑部立体定位图谱,找出PFC区域并与此交点的相对位置,以该点为原点,使用颅钻在颅骨上向前后取2.5~4.5mm、左右0.2~1mm开矩形窗,直至硬脑膜暴露。将硬脑膜挑除后,将16(2×8)通道微电极阵列垂直推进至PFC脑区内,与此同时,对神经元的电活动信号进行实时监测。电极阵列达到正确深度且电极检测所得信号稳定则认为电极植入成功,用生理盐水对创口进行清理后使用琼脂覆盖创口。待琼脂完全固化后,使用牙科水泥将电极阵列固定在颅骨上,最后对创口进行消毒防止感染,在体多通道微电极植入手术完成。
在体多通道微电极植入术后,令大鼠静养恢复约48h,保证其饮食,期间观察大鼠的恢复情况,直至大鼠恢复至精神状态良好。
1.4 工作记忆行为学T迷宫实验
大鼠恢复完成后进行为期两天的T迷宫适应性训练。大鼠可以在T迷宫中进行自由探索,每天训练两次,每次30min。
训练完成后正式开始T迷宫实验。每天每只大鼠进行两组T迷宫WM任务实验,每组包含20次实验,所有实验均需在安静环境下进行。单次实验包括自由选择及延时交替选择两个部分:实验开始前,在T迷宫的左右两个臂端放置食物奖励,大鼠被挡板隔离在起始点区域;实验开始时撤离挡板,大鼠从起始点出发到达参考点后开始进行自由选择,选择完成后大鼠即会进入一个臂端,在大鼠得到食物奖励时另一侧臂端被挡板挡住,大鼠取食结束后回到起始点并用挡板隔离,经过5s的延迟后撤离挡板重新出发,延时交替选择阶段开始。此时将会出现两种情况:大鼠延时交替选择与自由选择均选择了同一侧臂端记为一次错误执行WM任务,大鼠延时交替选择与自由选择均选择了不同侧臂端,记为一次正确执行了WM任务。T迷宫示意图如图3所示,图3a中,大鼠自由选择了左侧臂端,则延时交替时若选择左端记为错误,选择右端记为正确,图3b中,大鼠自由选择了右侧臂端,则延时交替时若选择右端记为错误,选择左端记为正确。
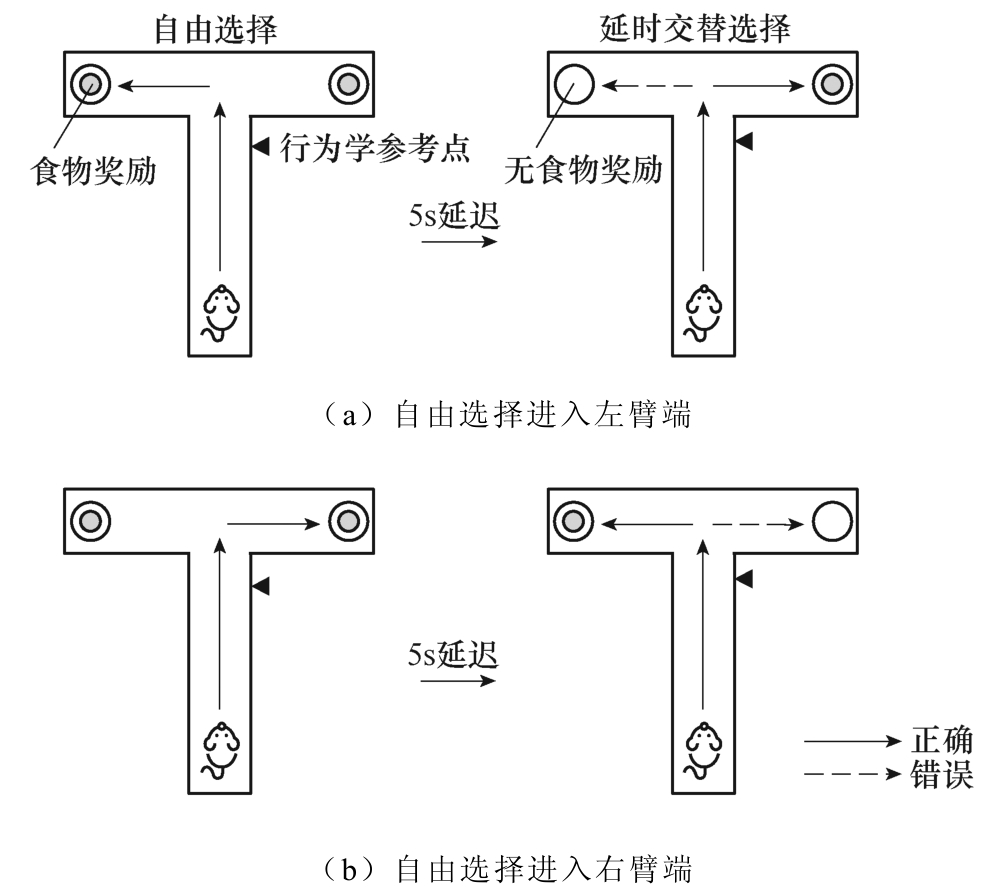
图3 T迷宫 Fig.3 T-maze
一次实验完成后大鼠需回到起始点准备下一次WM任务。大鼠执行任务过程中需记录其行为学数据、LFPs信号以及大鼠每次实验经过参考点的时刻。当大鼠完成T迷宫实验的正确率连续两天大于或等于80%,即认为大鼠学会了此项任务。
1.5 数据采集
本文应用美国Plexon公司生产的OmniPlex128通道神经电生理信号采集系统对四组大鼠PFC区域的神经电活动信号进行记录,采样频率为1kHz。在大鼠进行T迷宫实验时同步采集脑电信号,共得到四组大鼠在执行WM任务实验时的16通道原始脑电信号数据。
1.6 数据处理及分析
1.6.1 行为学数据
记录大鼠每日各次实验正确率情况。迷宫实验完成后统计四组大鼠达到“学会”标准的平均天数。
1.6.2 数据预处理
对在体多通道记录技术所得到的原始脑电信号数据进行预处理以得到LFPs数据。首先采用50Hz陷波器去除工频干扰,之后应用0~100Hz低通滤波器获取包含θ 及γ 频段的LFPs数据。
1.6.3 LFPs网络构建
得到0~100Hz的16通道LFPs信号后,应用基 于皮尔森相关系数rij的网络构建方法,对四组大鼠在进行WM任务实验过程中延时交替阶段的LFPs 信号进行分析,基于各个通道LFPs之间的皮尔森相关系数值构建网络矩阵探究刺激组大鼠与对照组大鼠PFC的LFPs相关网络特征模式,其中,皮尔森相关系数为
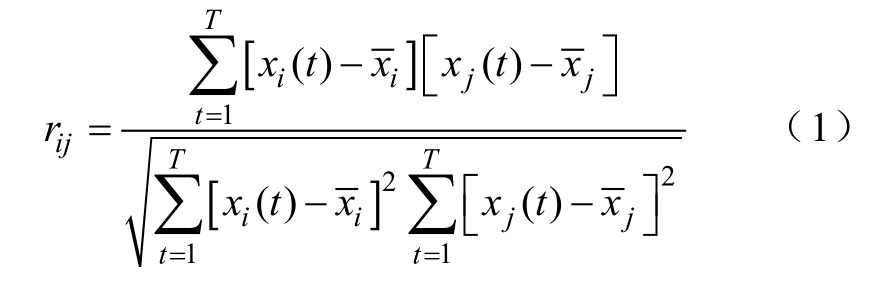
式中,t为时间;T为时间序列总长度;xi、xj为通道节点i与j的时间序列;![]() 分别为通道 节点i与j的时间序列平均值。最终可得到一个 16×16的网络关联矩阵。
分别为通道 节点i与j的时间序列平均值。最终可得到一个 16×16的网络关联矩阵。
1.6.4 基于皮尔森相关的LFPs网络连接特性分析
本文选取基于图论的网络连接密度D以及全 局效率Eg来进一步分析四组大鼠在执行WM任务过程中LFPs信号网络的连接特性。
首先需引入最短路径长度Lij的概念:网络中两个节点的最短路径长度指连接两个节点的最少边 数。进一步计算网络连接密度及全局效率,网络连接密度表征网络中各个节点之间连接的紧密程度,网络中节点之间的连接数目越多,强度越大,则网络连接密度越大[27]。网络连接密度的定义为
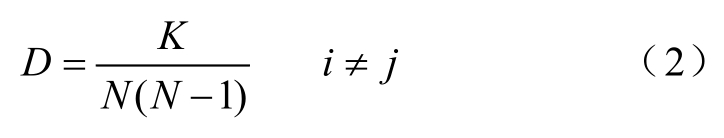
式中,N为通道个数;K为网络中节点间的实际最短路径个数。连接密度的取值范围在0~1之间。当网络的连接状态到达理想状态时,即网络中的每个节点与其他节点之间均存在最短路径时,网络连接密度取得最大值1。
全局效率指网络中各节点间实际存在的最短路径长度的调和平均数的倒数,它是衡量网络对信息总体传输能力的指标[28],全局效率越高网络中节点传递信息的速率则越快。全局效率的定义为
式中,n为节点数;ijL为节点i与节点j之间的最短路径长度;gE的取值范围为[0, 1][29-30]。
1.6.5 统计学分析
本实验所得数据采用单因素方差分析与t检验法进行统计学分析,以P值为参考对组间数据有无统计学意义进行判断,认为当P≥0.05时数据无显著性差异,当P<0.05时数据具有显著性差异并记为“*”。
2 结果
2.1 行为学统计分析
每组大鼠每天执行WM任务的平均正确率能够反映出大鼠在整个实验过程中整体任务完成情况,四组大鼠每天平均正确率如图4所示。

图4 四组大鼠每天平均正确率
Fig.4 Average daily correct rate of rats in each group
图4中横坐标表示实验天数,纵坐标表示正确率,结果表明,随着训练天数的增加,大鼠执行任务的正确率均呈现上升趋势,各组别大鼠在经过一定天数的训练后均能够达到“学会”标准。此外,从图中可看出,在实验初期阶段(第1~5天)刺激组大鼠的正确率均高于空白对照组,说明不同刺激模式作用对大鼠的认知行为产生了一定的影响。
达到“学会”标准所用天数反映了各组大鼠学习T迷宫WM任务规则的速率,是本文中评价磁刺激对四组大鼠WM能力影响的重要指标,统计四组大鼠达到“学会”标准的平均天数,如图5所示。图中采用“平均值±标准差”的形式表示数据,四组大鼠达到“学会”标准的平均天数为:control组(9.75±1.875)天,rTMS组(5.25±2.276)天,cTBS组(6.17±1.863)天,iTBS组(4.25±1.920)天;经过单因素方差分析,结果表明,三种刺激模式造成各组大鼠间达到标准天数的差异具有统计学意义(P<0.05),认为刺激组均先于空白对照组达到了“学会”标准,且iTBS平均4.25天达到“学会”标准,远早于cTBS平均6.17天达到“学会”标准(P<0.05),说明本文所选用的三种TMS模式均能改善大鼠的工作记忆行为学表现;且刺激组中iTBS达到“学会”标准所用时间最短,rTMS组所 用时间次之,cTBS组在刺激组中达到标准所用时间最长,说明iTBS能够显著改善工作记忆功能。

图5 四组大鼠达到标准平均天数
Fig.5 The average days of reaching the standard in four groups
2.2 基于皮尔森相关系数的LFPs网络关联关系
对T迷宫任务中大鼠位于参考点前后各2 000ms(共4 000ms)时间段内的数据进行相关性分析。利用皮尔森相关系数公式,得到四组不同模式磁刺激大鼠的16×16的关联矩阵,如图6所示。
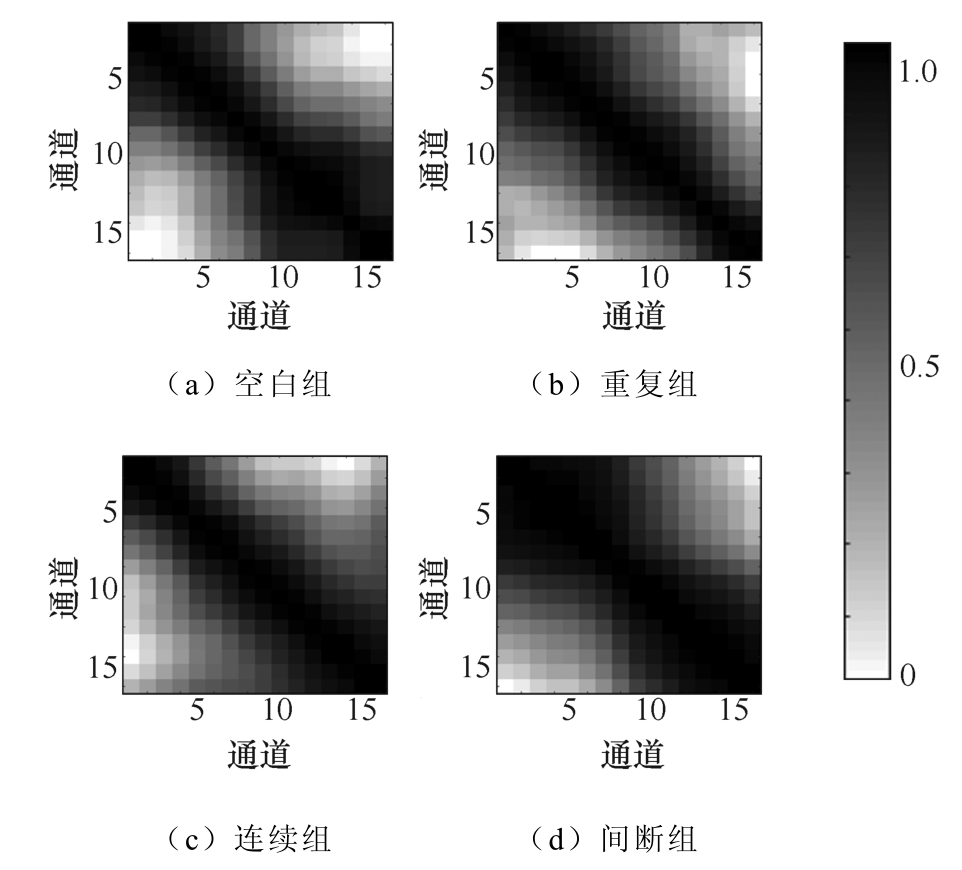
图6 四组大鼠通道间关联矩阵
Fig.6 The correlation matrix between channels of four groups of rats
图6中,图6a~图6d分别表示空白组、重复组、连续组以及间断组执行WM任务过程中通道间关联值矩阵,矩阵的横坐标与纵坐标均表示在体多通道电极编号,矩阵中的每个元素对应从横轴对应通道到纵轴对应通道的皮尔森相关系数,相关值以颜色进行标识,颜色由白至黑代表相关值从0~1增大,每个矩阵均关于对角线呈对称分布,矩阵中的对角线表示通道自身与自身的相关值,均将其设置为1。可以看出,相邻的电极对的相关性较高,空间距离越远,相关性的差值越明显,表明大鼠在进行选择时前额叶皮层相邻的神经元集群之间的关联性显著增大。
图7为阈值为0.7时四组不同模式刺激下大鼠的16×16邻接二值矩阵。

图7 四组大鼠通道间邻接二值矩阵
Fig.7 Adjacency binary matrices of four groups of rats
图7显示,当通道间的相关系数小于阈值时,邻接矩阵中对应的位置取0,表示两通道之间没有连接,而当通道之间的相关系数大于或等于阈值时,邻接矩阵中对应的位置取1,表示两个通道之间存在连接。图7a~图7d分别表示空白组、重复组、连续组以及间断组可以看出,在阈值0.7下磁刺激组邻接矩阵中1的数量高于空白对照组,且刺激组5~7通道中1的数量显著高于空白对照组,在cTBS组中5~16通道的连接较多,而在iTBS组中1~10通道的连接较多,这可能是由于不同的TBS对神经元集群的作用效果不同而导致的;同时,相隔较远的通道依然保持较低水平的相关性,与上述结果具有一致性。
图8为四组大鼠在执行WM任务期间的皮尔森相关系数平均值。图中,横坐标表示不同组别,纵坐标表示各个模式大鼠执行WM任务过程中的平均相关值大小,采用“平均值±标准差”的形式表示数据,四组大鼠平均相关值为:空白组(0.469±0.039),重复组(0.547±0.014),连续组(0.578±0.013),间断组(0.656±0.014);经过单因素方差分析,表明 刺激造成的各组大鼠间平均相关值的差异具有统计学意义(P<0.05);图中结果表明,刺激组大鼠的平均相关值均高于空白对照组(P<0.05),且iTBS组平均相关值达到0.65,显著高于其他两个刺激组(P<0.05),说明磁刺激能够在一定程度上改善WM任务中LFPs信号间的相关性,其中,iTBS的改善效果最为显著(P<0.05),此结果与前述行为学结果及网络关系结果具有一致性。

图8 四组大鼠平均相关值
Fig.8 The average of the correlation coefficients of the four groups
2.3 LFPs网络连接特性
为进一步对各组大鼠LFPs网络连接特性进行分析,引入网络连接密度及全局效率。四组大鼠的网络连接密度如图9所示。
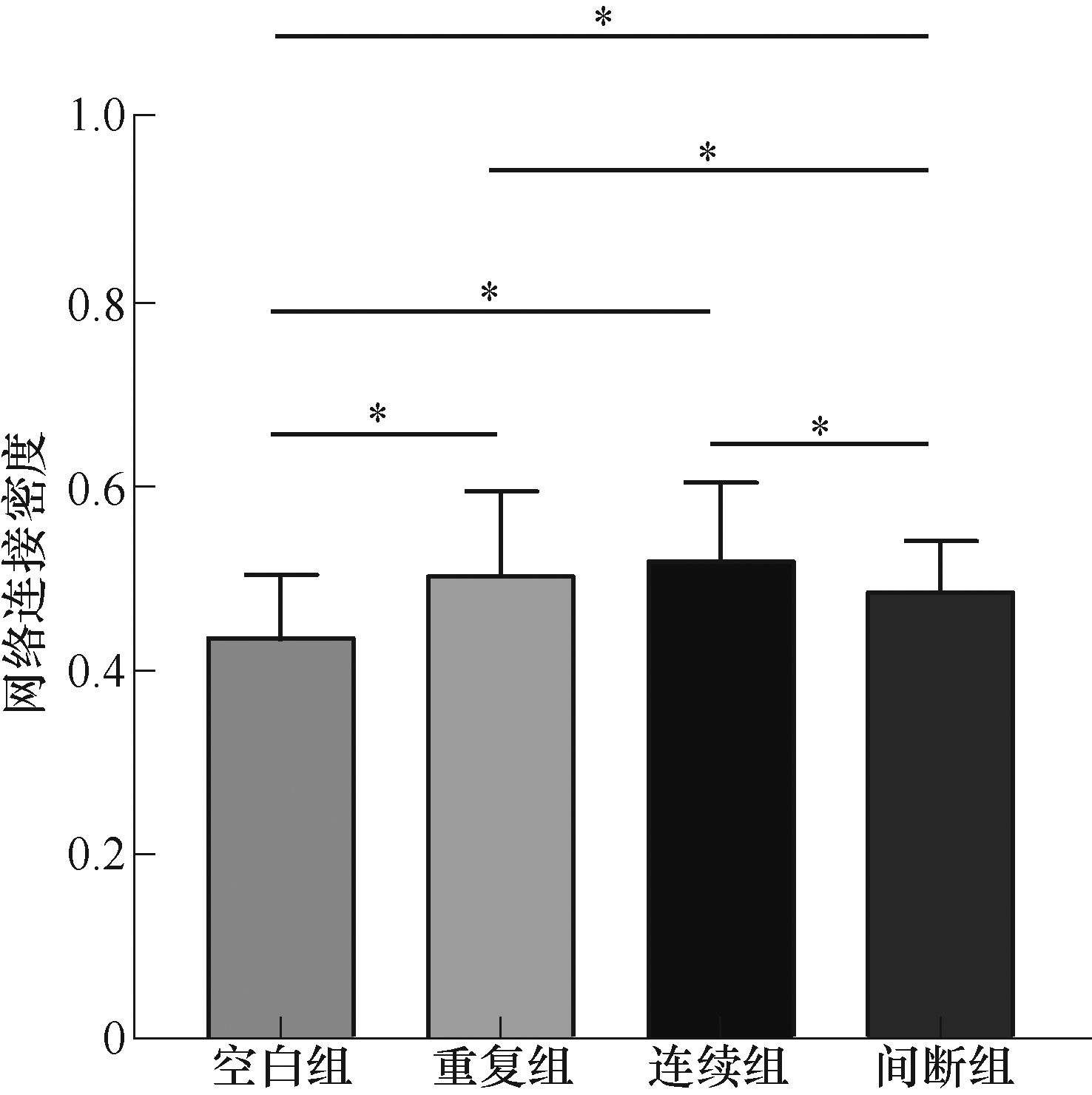
图9 四组大鼠的网络连接密度
Fig.9 Network connection density of four groups
图9给出了四组大鼠LFPs网络连接密度结果,其中,空白组(0.433±0.071),重复组(0.5±0.095),连续组(0.517±0.088)以及间断组(0.483±0.058);可以看出,四组大鼠中刺激组的网络连接密度比空白对照组高(P<0.05),且刺激组中呈现cTBS的网络连接密度高于iTBS组、iTBS的网络连接密度高于rTMS组(P<0.05),说明磁刺激使得脑功能网络各个节点的紧密化程度得到提高,且cTBS可以使网络的连接密度显著增大。
四组大鼠的LFPs网络全局效率如图10所示。图10中给出了四组大鼠LFPs网络全局效率结果,其中,空白组(0.528±0.085),重复组(0.554±0.094),连续组(0.618±0.046)以及间断组(0.688±0.076);结果表明,刺激组大鼠的网络全局效率均高于空白对照组(P<0.05),且iTBS组的全局效率最大(P<0.05),说明刺激组大鼠在WM任务的延时交替选择中LFPs网络的信息总体传输能力高于空白对照组,其中,iTBS对网络信息传输速率的改善最为明显,此结果与皮尔森相关系数平均值等结果具有一致性。

图10 四组大鼠的LFPs网络全局效率
Fig.10 The global efficiency of LFPs networks of four groups
2.4 LFPs相关值的动态变化
对T迷宫WM任务中大鼠位于参考点前后各2 000ms(共4 000ms)时间段内的数据进行相关性分析,使用200ms矩形窗进行加窗节段将数据分为不重叠的片段,计算每个片段中每两个通道之间的相关值作为片段中心时刻的各通道对之间的相关性结果,按照相关值随时间动态变化进行分析,四组大鼠相关系数随时间变化曲线如图11所示。图中,带状阴影表示标准差。由图中可以看出,各模式相关值在行为学参考点前1 500ms到前500ms间明显高于其他位置,相关值峰值在位于约参考点前1 000ms处出现,且四组大鼠的相关值变化趋势基本一致,整体呈现先升高后降低的趋势;且刺激组 相关值均高于空白对照组相关值,cTBS与iTBS组大鼠进行选择行为时PFC的LFPs网络相关性峰值结果明显高于rTMS组及control组,其中,iTBS组峰值高于cTBS组,rTMS组峰值高于control组;且iTBS组峰值出现时间约为参考点前700ms,相较于其他组别峰值出现在参考点前约1 000ms更为接近参考点,可见,iTBS刺激可以使潜伏期缩短,说明iTBS能够使大鼠在更短的时间内做出正确的选择。

图11 四组大鼠相关系数随时间变化曲线
Fig.11 The curves of correlation coefficient of four groups
2.5 行为学任务正确率与相关值的关系
为进一步确定磁刺激对大鼠工作记忆的影响,按照相关值对应WM行为学任务正确率进行分析,四组大鼠相关值随正确率变化散点如图12所示。
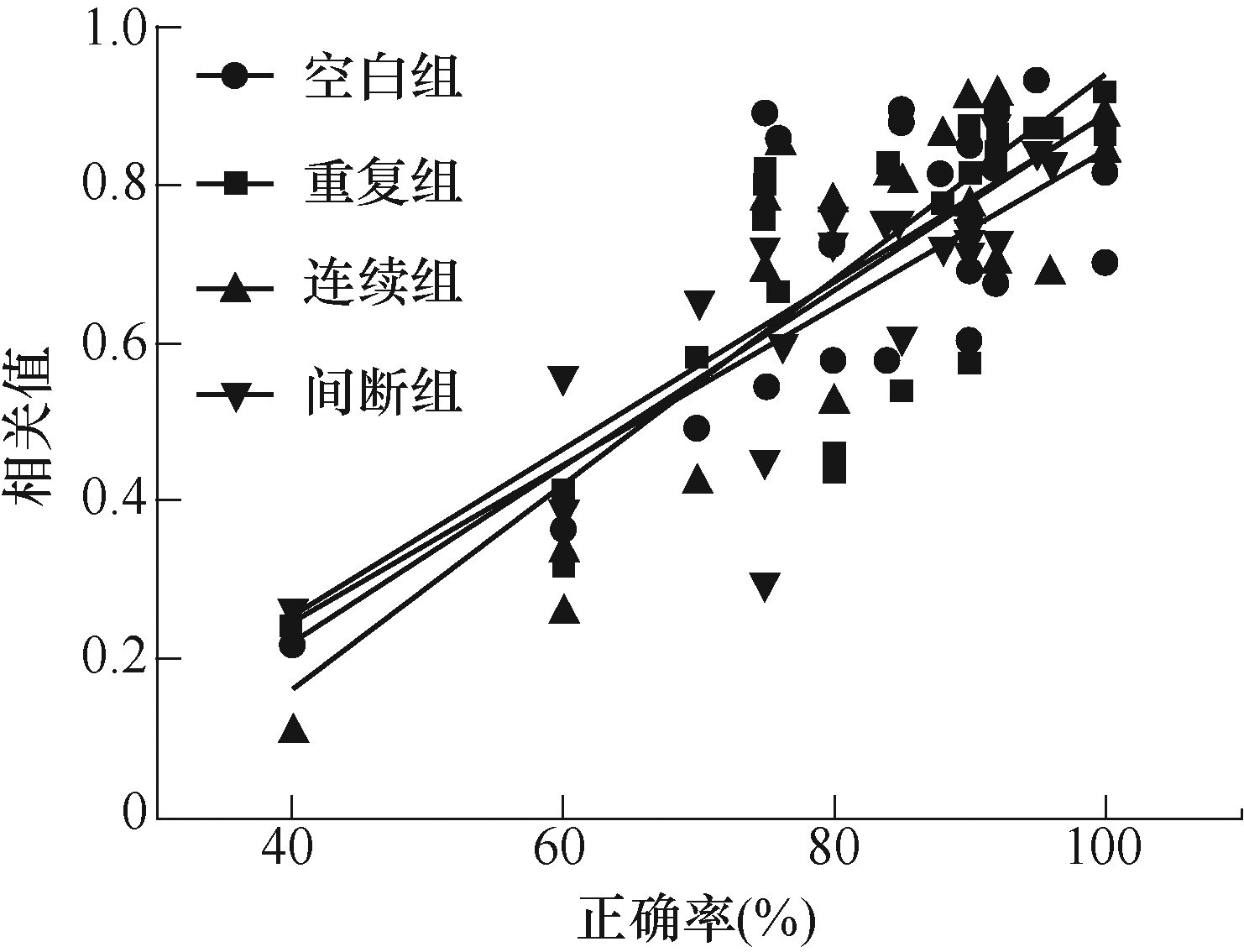
图12 四组大鼠相关值随正确率变化散点
Fig.12 Scatter plot of correlation value with accuracy of four groups
图12可以看出,正确率与相关值呈正相关且二者呈线性变化趋势,经过拟合后整体上各组的相关值均随正确率的增加而增加,这一关系结果表明,前额叶皮层的神经元集群的协同相关作用参与了WM任务学习过程,相关值随着训练正确率的增加而增加,说明经过训练后认知神经网络间的协同性增强。
3 讨论
本文基于皮尔森相关系数对不同模式下经颅磁刺激后大鼠执行WM任务中的LFPs信号进行分析,基于皮尔森相关系数构建了LFPs连接网络并引入网络连接特性参数:网络连接密度及全局效率。通过对比各组大鼠在T迷宫内执行WM任务延时交替过程中的行为学表现及LFPs神经网络参数的差异讨论不同模式经颅磁刺激技术对WM相关神经网络关联特性的影响。
行为学结果表明,经过TMS的正常成年大鼠比无任何刺激的正常成年大鼠达到“学会”标准的天数显著缩短(P<0.05),不同模式的经颅磁刺激对大鼠的认知行为产生了相应的影响。达到“学会”标准的平均天数能够反映出各组大鼠学习WM任务实验规则的速度,是评价大鼠的工作记忆行为学能力的关键指标之一,由结果可以看出,刺激组模型大鼠的学会天数均低于空白对照组,且iTBS组较其他刺激组所需时间最短。W. C. Sung等[31]的研究说明,经过iTBS后与工作记忆相关的神经生理学变化更为显著,与上述结果具有一致性。本文选取的三种不同模式下的TMS均能够在一定程度上改善大鼠在执行工作记忆任务过程中的表现,其中,iTBS的效果最为明显。有研究证实,磁刺激能够增强啮齿类动物的空间学习能力[32-33],王玲[34]等的研究也通过水迷宫证实了上述结论,因此,本文结果可以为TMS能够正向影响WM能力并改善认知功能提供依据。
相关性能够反映神经元信号之间的关联特性,本文进一步对包含θ 及γ 的0~100Hz频段LFPs信号进行相关性分析。LFPs信号能够反映神经元集群的放电情况[35],大鼠在学会某项任务前后的神经元放电情况具有差异性[36],从相关性分析的结果可以看出,相邻电极间的相关值一般大于相隔较远的两电极间的相关值,电极对之间的相关性一般随着空间距离增大而减小。观察四组大鼠执行WM任务过程中相关值随时间变化曲线发现,大鼠在WM任务的延时交替阶段,LFPs网络的相关值在行为学参考点前逐渐升高,并在经过参考点前约1 000ms达到峰值,四组大鼠相关值随时间变化的趋势基本一致,且相关值呈现刺激组大于空白对照组,且θ 节律刺激大于rTMS组;图10中显示,cTBS组大鼠及iTBS组大鼠在进行工作记忆选择行为前的前额叶皮层LFPs相关值起始值与峰值均高于rTMS组及control组,说明TBS能够明显改善大鼠在WM任务期间的LFPs网络关联性。通过计算四组大鼠的平均相关值,发现刺激组的相关值均显著高于空白对照组,且iTBS组的相关值达到最大。四组大鼠平均相关值表明三种磁刺激均正向影响了大鼠在WM任务中延时交替阶段前额叶皮层神经元间协同性,其中,iTBS的影响最为明显。脑认知功能的正确执行需各神经元集群协同完成,LFPs网络的相关性反映了前额叶皮层神经元之间的协同关联性,本文还计算了LFPs的网络连接密度及全局效率以探究磁刺激对网络中节点的紧密程度以及网络的信息传递速率的影响。
对基于皮尔森相关系数LFPs网络的连接密度及全局效率进行分析,可以看出,刺激组大鼠的网络连接密度均高于空白对照组,说明磁刺激使得脑功能网络中各个节点的紧密程度得到增强。进一步对网络的全局效率进行分析,发现刺激组大鼠的网络全局效率值均高于空白对照组,经过磁刺激后大鼠的LFPs网络全局效率明显升高,其中,iTBS组的全局效率最高,说明磁刺激能使网络中信息的传递速率加快且iTBS对网络中信息传输速率的影响最为明显。
正确率与相关性的关系结果表明,当行为学任务正确率逐步升高的同时,对应的LFPs相关值也相应增大,相关值与正确率呈正相关,表明神经元集群间的协同效应在WM行为学任务的表现中具有重要的影响作用,这可能是WM的潜在编码机制;本结果说明磁刺激能够有效提高WM过程中神经元集群间的相关协同作用,进而指导或影响动物的行为。同理,各组的正确率越高,相关值越大,即更高的任务执行准确性及更好的任务表现得益于更紧密的认知神经网络的协同调制。相关值反映了WM过程中网络神经电活动表现,LFPs网络的相关协同贯穿于整个WM任务过程中,帮助大脑做出正确的行为决策和选择。
文中实验分别应用rTMS、cTBS以及iTBS三种经颅磁刺激模式对大鼠的前额叶皮层进行刺激,结果表明,经过磁刺激后大鼠的行为学表现均得到了不同程度的改善,其中,TBS的作用效果好于rTMS,其原因在于TBS是模拟了神经元动作电位放电过程的新兴经颅磁刺激模式,与标准的rTMS相比,TBS能以更高的效率对神经元集群间的协同作用产生较为持续的刺激效果[10],且TBS已被证实对神经可塑性有正向的影响作用[37],P. Vignaud等[38]研究表明,TBS能够增强工作记忆相关脑区的动态功能连通性,印证了TBS能够对工作记忆进行有效改善。在TBS中iTBS对行为学的改善效果好于cTBS,其机理可能在于iTBS能够更有效地引起神经元皮质兴奋,提高神经可塑性。Zhang Guoqin等[39]研究表明,iTBS能使健康被试的运动诱发电位显著增大而cTBS后被试的运动诱发电位无显著变化,说明cTBS引起神经可塑性调节的效率低于iTBS;X. H. Ruan等[40]研究证实了cTBS对初级感觉运动皮质的区域同质性没有显著影响,而iTBS促进了双侧感觉运动皮质区域同质性的提高,与本文中iTBS的刺激效果好于cTBS的结果具有一致性。
本文通过探索WM任务过程中不同模式磁刺激后大鼠LFPs相关性网络及其网络参数的差异,探究三种不同模式的经颅磁刺激对大鼠工作记忆神经网络的影响机制研究,研究结果表明,iTBS、cTBS及rTMS均能促进脑网络的关联性,其中,iTBS在提高正常大鼠工作记忆能力、改善大鼠认知功能方面有较为明显的改善作用。已有相关研究将iTBS应用于精神分裂症[41]及抑郁症[42]并已验证了其安全性与有效性。本文的研究结果可以为TMS在临床应用及脑认知功能领域的研究提供参考。
4 结论
本文对施加不同模式经颅磁刺激后的大鼠实施在体多通道电极植入手术,采集其执行工作记忆行为学T迷宫任务的脑电信号,应用皮尔森相关系数原理对所得脑电信号进行处理,构建了LFPs脑功能网络并对其网络连接密度及全局效率进行分析。行为学结果表明,rTMS、cTBS及iTBS对工作记忆任务的学习效率均具有促进作用,刺激组大鼠达到“学会”标准的天数明显小于对照组,且iTBS的促进效果最为显著。相关性分析的结果表明,经过iTBS及cTBS刺激后的大鼠在参考点前的相关系数显著大于rTMS组与空白对照组。通过分析LFPs网络参数,可以发现经过磁刺激的三组大鼠的网络连接密度更高,即磁刺激加强了网络中节点之间的紧密程度;磁刺激组的网络全局效率均高于空白对照组,且iTBS的全局效率最高,说明iTBS显著提高了网络中的信息传输速率。综上所述,iTBS、cTBS及rTMS均能在一定程度上促进脑网络的关联性,提高正常大鼠的工作记忆能力。其中,iTBS相对其他两个刺激组显示更好的效果。
[1] Klomjai W, Katz R, Lackmy-Vallée A. Basic princi- ples of transcranial magnetic stimulation (TMS) and repetitive TMS (rTMS)[J]. Annals of Physical and Rehabilitation Medicine, 2015, 58(4): 208-213.
[2] Simonetta-Moreau M. Non-invasive brain stimulation (NIBS) and motor recovery after stroke[J]. Annals of Physical and Rehabilitation Medicine, 2014, 57(8): 530-542.
[3] 李江涛, 曹辉, 郑敏军, 等. 多通道经颅磁刺激线圈阵列的驱动与控制[J]. 电工技术学报, 2017, 32(22): 158-165.
Li Jiangtao, Cao Hui, Zheng Minjun, et al. The drive and control of multi-channel transcranial magnetic stimulation coil array[J]. Transactions of China Electrotechnical Society, 2017, 32(22): 158-165.
[4] 熊慧, 王玉领, 付浩, 等. 一种应用于经颅磁刺激脉冲宽度可调的节能型激励源[J]. 电工技术学报, 2020, 35(4): 679-686.
Xiong Hui, Wang Yuling, Fu Hao, et al. An energy efficient excitation source for transcranial magnetic stimulation with controllable pulse width[J]. Transa- ctions of China Electrotechnical Society, 2020, 35(4): 679-686.
[5] Rossi S, Hallett M, Rossini P M, et al. Safety, ethical considerations, and application guidelines for the use of transcranial magnetic stimulation in clinical practice and research[J]. Clinical Neurophysiology: Official Journal of the International Federation of Clinical Neurophysiology, 2009, 120(12): 2008-2039.
[6] Walsh V, Cowey A. Transcranial magnetic stimu- lation and cognitive neuroscience[J]. Nature Reviews Neuroscience, 2000, 1(1): 1-9.
[7] 李江涛, 郑敏军, 曹辉. 经颅磁刺激技术的研究进展[J]. 高电压技术, 2016, 42(4): 1168-1178.
Li Jiangtao, Zheng Minjun, Cao Hui. Research progress in transcranial magnetic stimulation tech- nology[J]. High Voltage Engineering, 2016, 42(4): 1168-1178.
[8] 张帅, 崔琨, 史勋, 等. 经颅磁声电刺激参数对神经元放电模式的影响分析[J]. 电工技术学报, 2019, 34(10): 1-9.
Zhang Shuai, Cui Kun, Shi Xun, et al. Effect analysis of transcranial magneto-acousto-electrical stimulation parameters on neural firing patterns[J]. Transactions of China Electrotechnical Society, 2019, 34(10): 1-9.
[9] 许毅, 李达, 谭立文, 等. 重复经颅磁刺激治疗专家共识[J]. 转化医学杂志, 2018, 7(1): 4-9.
Xu Yi, Li Da, Tan Liwen, et al. Chinese experts consensus on repetitive transcranial tagnetic stimu- lation[J]. Journal of Naval General Hospital, 2018, 7(1): 4-9.
[10] Huang Yingzu, Edwards M J, Rounis E, et al. Theta burst stimulation of the human motor cortex[J]. Neuron, 2005, 45(2): 201-206.
[11] Wimmer K, Nykamp D Q, Constantinidis C, et al. Bump attractor dynamics in prefrontal cortex explains behavioral precision in spatial working memory[J]. Nature Neuroscience, 2014, 17(3): 431-439.
[12] Laroche S, Davis S, Jay T M. Plasticity at hippo- campal to prefrontal cortex synapses: dual roles in working memory and consolidation[J]. Hippocampus, 2000, 10(4): 438-446.
[13] Ashdown-Franks G, Firth J, Carney R, et al. Exercise as medicine for mental and substance use disorders: a meta-review of the benefits for neuropsychiatric and cognitive outcomes[J]. Sports Medicine, 2020, 50(1): 1-20.
[14] 白杨, 杨佳佳, 郑晨光. Gamma节律: 认知障碍疾病的潜在诊断靶点[J]. 生物化学与生物物理进展, 2020, 47(6): 523-537.
Bai Yang, Yang Jiajia, Zheng Chenguang. Gamma rhythms: a potential diagnostic target for cognitive disorders[J]. Progress in Biochemistry and Biophysics, 2020, 47(6): 523-537.
[15] 张帅, 高昕宇, 周振宇, 等. 基于GrC模型的经颅磁声电刺激对神经元放电活动的影响[J]. 电工技术学报, 2019, 34(17): 3572-3580.
Zhuang Shuai, Gao Xinyu, Zhou Zhenyu, et al. Effect of transcranial magnetic-acoustic electrical stimu- lation coupling electrical stimulation on neuronal discharge activity based on GrC model[J]. Transa- ctions of China Electrotechnical Society, 2019, 34(17): 3572-3580.
[16] 陈忠, 张世红. 深部脑刺激在神经精神疾病治疗中的应用研究进展[J]. 浙江大学学报, 2009, 38(6): 549-558. Chen Zhong, Zhang Shihong. Advances in application of deep brain stimulation in treatment of neuropsycholo- gical diseases[J]. Journal of Zhejiang University, 2009, 38(6): 549-558.
[17] Guo Zhiwei, Jiang Zhijun, Jiang Binghu, et al. High-frequency repetitive transcranial magnetic stimulation could improve impaired working memory induced by sleep deprivation[J]. Neural Plasticity, 2019, 2019(1): 1-11.
[18] De Witte S, Baeken C, Pulopulos M M, et al. The effect of neurostimulation applied to the left dorso- lateral prefrontal cortex on post-stress adaptation as a function of depressive brooding[J]. Progress in Neuro- Psychopharmacology and Biological Psychiatry, 2019, 96(1): 1-9.
[19] Di Lorenzo F, Martorana A, Ponzo V, et al. Cere- bellar theta burst stimulation modulates short latency afferent inhibition in Alzheimer's disease patients[J]. Frontiers in Aging Neuroscience, 2013, 5(2): 1-8.
[20] Cheng C M, Juan C H, Chen M H, et al. Different forms of prefrontal theta burst stimulation for executive function of medication-resistant depression: evidence from a randomized sham-controlled study[J]. Progress in Neuro-Psychopharmacology and Biological Psychiatry, 2016, 66(1): 35-40.
[21] Ziemann U. Thirty years of transcranial magnetic stimulation: where do we stand?[J]. Experimental Brain Research, 2017, 235(4): 973-984.
[22] Canolty R T, Knight R T. The functional role of cross-frequency coupling[J]. Trends in Cognitive Sciences, 2010, 14(11): 506-515.
[23] Roux F, Uhlhaas P J. Working memory and neural oscillations: alpha−gamma versus theta−gamma codes for distinct WM information?[J]. Trends in Cognitive Sciences, 2014, 18(1): 16-25.
[24] Li Shuangyan, Bai Wenwen, Liu Tiaotiao, et al. Increases of theta−low gamma coupling in rat medial prefrontal cortex during working memory task[J]. Brain Research Bulletin, 2012, 89(3): 115-123.
[25] Chang C W, Lo Y C, Lin Shenghuang, et al. Modu- lation of theta-band local field potential oscillations across brain networks with central thalamic deep brain stimulation to enhance spatial working memory[J]. Frontiers in Neuroscience, 2019, 13(1): 1-11.
[26] Yu Chunxiu, Fan D, Lopez A, et al. Dynamic changes in single unit activity and gamma oscillations in a thalamocortical circuit during rapid instrumental learning[J]. PLOS One, 2012, 7(11): 1-10.
[27] Rubinov M, Sporns O. Complex network measures of brain connectivity: uses and interpretations[J]. NeuroImage, 2010, 52(3): 1059-1069.
[28] Seth Anil K. A Matlab toolbox for Granger causal connectivity analysis[J]. Journal of Neuroscience Methods, 2010, 186(2): 262-273.
[29] Fairhall A L, Lewen G D, Bialek W, et al. Efficiency and ambiguity in an adaptive neural code[J]. Nature, 2001, 412(6849): 787-792.
[30] Achard S, Bullmore E. Efficiency and cost of economical brain functional networks[J]. PLOS Computational Biology, 2007, 3(2): 174-183.
[31] Sung W C, Nigel C R, Kate E H, et al. Impact of different intensities of intermittent theta burst stimulation on the cortical properties during TMS- EEG and working memory performance[J]. Human Brain Mapping, 2018, 39(2): 783-802.
[32] Yang Huiyun, Liu Yang, Xie Jiacun, et al. Effects of repetitive transcranial magnetic stimulation on synaptic plasticity and apoptosis in vascular dementia rats[J]. Behavioural Brain Research, 2015, 281: 149-155.
[33] Zhang N, Xing M, Wang Y, et al. Repetitive transcranial magnetic stimulation enhances spatial learning and synaptic plasticity via the VEGF and BDNF-NMDAR pathways in a rat model of vascular dementia[J]. Neuroscience, 2015, 311: 284-291.
[34] 王玲, 杨佳佳, 王发颀, 等. 经颅磁刺激对抑郁模型动物的作用研究进展[J]. 中国生物医学工程学报, 2018, 37(4): 498-507.
Wang Ling, Yang Jiajia, Wang Faqi, et al. Research progress of effects of transcranial magnetic stimu- lation on the depression animal model[J]. Chinese Journal of Biomedical Engineering, 2018, 37(4): 498- 507.
[35] Benchenane K, Peyrache A, Khamassi M, et al. Coherent theta oscillations and reorganization of spike timing in the hippocampal prefrontal network upon learning[J]. Neuron, 2010, 66(6): 921-936.
[36] 郭磊, 陈云阁, 王瑶, 等. 基于C0复杂度的磁刺激内关穴的脑功能网络构建与分析[J]. 电工技术学报, 2017, 32(12): 155-163.
Guo Lei, Chen Yunge, Wang Yao, et al. Construction and analysis of brain functional network based on C0 complexity Neiguan[J]. Transactions of China Elec- trotechnical Society, 2017, 32(12): 155-163.
[37] Song Jiaqi, Liu Dan, Zhang Meng, et al. Intermittent theta burst stimulation (iTBS) combined with working memory training to improve cognitive function in schizophrenia: study protocol for a randomized controlled trial[J]. Trials, 2020, 21(1): 1-10.
[38] Vignaud P, Damasceno C, Poulet E, et al. Impaired modulation of corticospinal excitability in drug-free patients with major depressive disorder: a theta burst stimulation study[J]. L'Encéphale, 2019, 45(2): 572- 573.
[39] Zhang Guoqin, Ruan Xiuhang, Li Yuting, et al. Intermittent theta-burst stimulation reverses the after-effects of contralateral virtual lesion on the suprahyoid muscle cortex: evidence from dynamic functional connectivity analysis[J]. Frontiers in Neuroscience, 2019, 13(309): 1-10.
[40] Ruan Xiuhang, Zhang Guoqin, Xu Guangqing, et al. The after-effects of theta burst stimulation over the cortex of the suprahyoid muscle on regional homogeneity in healthy subjects[J]. Frontiers in Behavioral Neuro- science, 2019, 13(35): 1-12.
[41] 张琼. 重复经颅磁刺激对精神分裂症辅助治疗的临床疗效研究[D]. 上海: 上海交通大学, 2018.
[42] 李惠, 徐冰清, 李春波, 等. θ 短阵快速脉冲重复经颅磁刺激治疗抑郁症[J]. 内科理论与实践, 2011, 6(3): 188-191.
Li Hui, Xu Bingqing, Li Chunbo, et al. Theta-burst repetitive transcranial magnetic stimulation in treatment of depression: a randomized double blind controlled trial[J]. Journal of Internal Medicine Concepts & Practice, 2011, 6(3): 188-191.