0 引言
经颅电刺激(transcranial Electrical Stimulator, tES)是一种非侵入式精神类疾病治疗手段,具有低成本、易操作、无创性、副作用小等显著优势[1]。在治疗帕金森疾病、抑郁症、癫痫和脑卒中等疾病中都展现了较好的疗效[2-6],具有巨大的临床应用价值和商业潜力。从经颅电刺激技术出现至今,单通道电刺激的相关研究已经较为充分,并广泛应用于临床医疗领域[7-8]。随着电刺激技术的发展,多通道电刺激凭借高聚焦度、高灵活度、深度刺激、精确定位、多点同步刺激等传统单通道电刺激不具备的出色表现,成为近年来的研究热点[9-11]。
电刺激期间常见的安全性问题主要包括电极脱落、电极接触不良以及电极失效导致的电化学反应等[12]。多通道电刺激有效提高刺激效果的同时,也增加了出现安全性问题的风险,对电刺激的安全性和可靠性提出了更加严格的要求。电极阻抗作为皮肤和电极状态的直接表征量,能有效反映皮肤接触状态及电极电化学环境变化,将其作为安全性监测的评价指标可以及时定位并纠正异常故障,因此,电极阻抗的测量及故障定位对评估刺激安全性有着重要意义[13-14]。
目前的多通道经颅电刺激装置以美国Soterix Medical公司的HD-tES高精度经颅电刺激仪和德国NeuroConn公司的DC-STIMULATOR MC电刺激器为主,上述电刺激装置的电极阻抗监测主要采用直接测量法。由于电极间的串扰会使得电极电位中同时包含自相关电位(源自本电极注入电流)和串扰电位(源自其他电极注入电流),直接测量法无法消除串扰电位的影响,测量误差较大[15],难以定位故障电极。文献[16]提出一种四电极推导法,分别在待测电极和参考电极上施加电压,从而推测电极阻抗,这种分时测量的方法避免了电极串扰,但并不适用于要求持续工作的经颅电刺激装置。文献[17]提出一种交流预测法,通过在刺激电流上叠加交流、小幅值电流,以特定频率的交流阻抗预测电极阻抗。这种方法在不中断刺激的前提下能有效分离电极串扰,定位故障电极,但会引入因阻抗频率依赖特性造成的误差,同时外加电极或电流源的实现方法也极大增加了装置的复杂度。
针对目前阻抗监测存在的技术难点,在交流预测法的基础上提出一种电流扰动法。通过在刺激波形上叠加电流扰动量,对多电极拓扑串扰解耦,从而测量任意N×1电极拓扑中的电极阻抗,实现对故障电极的定位与识别。本文设计了复合放大器增强型Howland电流源电路和基于电流扰动法的阻抗检测电路,以Labview平台搭建用户操作界面,以现场可编程门阵列(Field Programmable Gate Array, FPGA)作为控制器,搭建了多通道多模式经颅电刺激装置。在此基础上,实现了多种刺激模式的灵活切换以及不同刺激参数的调节。最后通过该装置进行一系列人体实验,验证了电流扰动法在线测量多电极阻抗的可行性,以及电流扰动法在不同故障情况下对故障电极的定位能力。
1 电流扰动法简介
对于电极阻抗,其电压降和电流之间的复杂关系为条件线性效应。当电流接近零时电极过电位主导电压降,电压降和电流呈剧烈非线性,电极阻抗处于非线性区域;当电流较大时电极电压降和电流之间呈线性关系,电极阻抗表现为电阻特性[18]。电流扰动法基于电压和电流的条件线性效应,在刺激电流上叠加短时间、小幅值电流扰动量,对多电极拓扑串扰解耦,分离自相关电位和串扰电位,进而求得电极阻抗、定位故障电极。以经颅直流电刺激(transcranial Direct Current Stimulation, tDCS)模式下的2×1电极拓扑(电极与刺激通道一一对应)为例介绍电流扰动法原理。
将经颅直流电刺激中的电极分为与参考电位之间有电流源的有源电极(Active Electrode, AE)以及与参考电位之间无电流源的无源电极(Passive Electrode, PE),PE为公共电流返回通道。将2×1多电极拓扑(2AE+1PE)刺激模型等效为集总参数组成的电路[17],其示意图如图1所示,主要包括3个电极阻抗和组织阻抗网络。图中,S1、S2为电流源;Rt1、Rt2分别为AE1和AE2的组织阻抗,Rt3为PE的组织阻抗;RAE1、RAE2分别为AE1和AE2的电极阻抗,RPE为PE的电极阻抗;i1为流经AE1和PE的电流,i2为流经AE2和PE的电流。

图1 2AE+1PE电刺激模型
Fig.1 2AE+1PE electrical stimulation model
由图1b可知,左侧回路的电压V1和右侧回路的电压V2可分别表示为
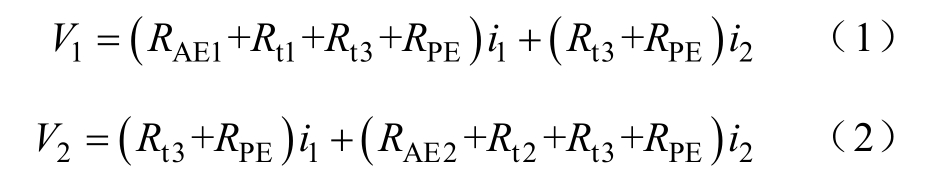
定义Vij(i =1,2,j =1,2)为电流源Si对Vj的贡献电压,它是电流i的函数。当i=j时,Vij为当前AE电极注入电流的函数(如AE1上的V11是电流i1的函数),称之为自相关电位。当i≠j时,Vij为其他AE电极注入电流的函数(如AE1上的V21是电流i2的函数),称为串扰电位。
则有

从式(3)~式(6)得到包含电极阻抗和部分组织阻抗的表达式,以RAE1为例,有

由式(7)可见,等式右侧同时包含自相关电位和串扰电位。串扰电位的产生是由于存在电流公共导电通道,在某一电极的注入电流从额定值到零的变化过程中,公共导电通道始终会存在其他电极注入的电流,因此,公共导电通道上的电压降和电流始终处于线性区域。而自相关电位存在独有的导电通道,在电流的全范围变化中存在非线性区域。因此,自相关电位与对应的电流之间是条件线性的(无法直接测量),串扰电位与对应的电流之间是线性的(可以直接测量)[18]。
将式(1)代入式(7),得到仅包含串扰电位的阻抗(电极阻抗和部分组织阻抗)表达式为
在i1上叠加小幅值、短时间直流阶跃信号Δi1,此时AE2上的电压波动就是ΔV12,然后线性预测对应的串扰电位V12,同样地,V21通过电流i2的扰动预测为
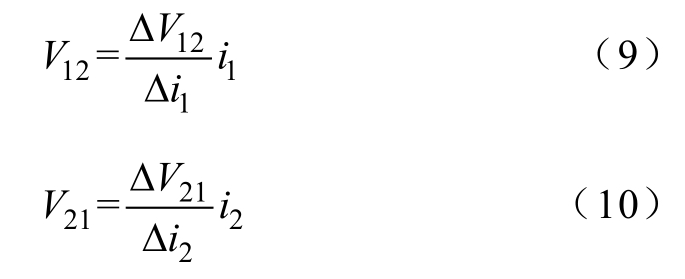
将式(9)、式(10)代入式(8)得
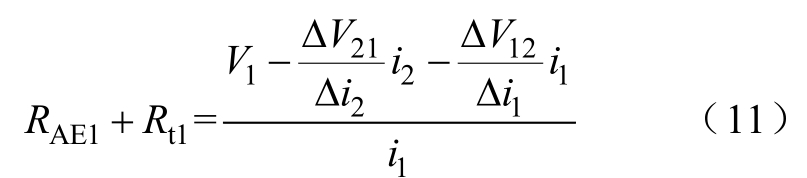
AE2和PE的计算与AE1类似,有
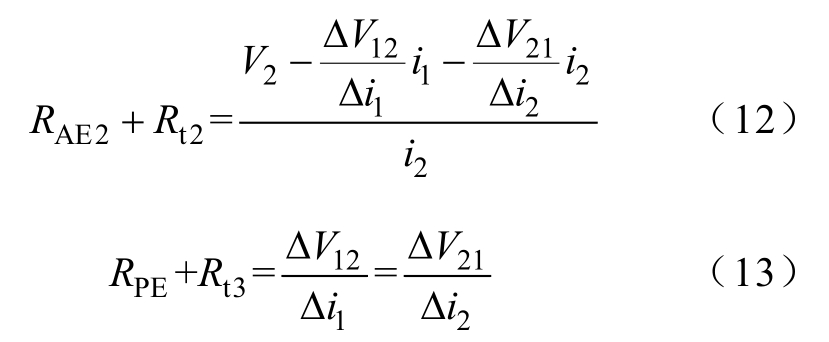
电极阻抗的变化量如ΔRPE可表示为

式中,RPE1、ΔV(12)1、Δi(1)1和RPE2、ΔV(12)2、Δi(1)2分别为相邻两次电流扰动下的电极阻抗、串扰电压变化量和电流变化量;Rt3为PE的组织阻抗,近似不变。
式(11)~式(13)实现了对自相关电位和串扰电位的分离,可以近似计算各电极阻抗并用于故障定位。一方面,组织阻抗的阻值远小于电极阻抗,因此,数值上式(11)~式(13)可以表征电极阻抗。另一方面,当电极故障发生导致电极阻抗异常变化时,电极阻抗的变化量可以准确体现在式(14)中。电流扰动法适用于任意N×1电极拓扑串扰解耦,求解电极阻抗和定位故障电极。
电流扰动法同样适用于经颅交流电刺激(transcranial Alternating Current Stimulation, tACS)和经颅脉冲电刺激(transcranial Pulse Current Stimulation, tPCS),分别在主刺激波形上叠加有限周期的同频同相、小幅值交流和直流扰动,以电压波动预测串扰电位,进而实现多电极拓扑串扰解耦,完成阻抗在线监测[19]。对于预调制电刺激,其本质是多种频率叠加的tACS,阻抗监测方法同上。
2 多通道经颅电刺激装置设计
多通道经颅电刺激装置的总体设计框图如图2所示,主要划分为三个部分:多通道刺激源、控制检测模块、Labview和FPGA软件设计。多通道刺激源实现高精度刺激电流输出,控制检测模块实现基于电流扰动法的阻抗信号采集,软件部分发送指令并驱动上述两个模块,Labview和FPGA之间通过ESP8266、WIFI模块进行数据传输。

图2 装置总体设计框图
Fig.2 Overall design block diagram of device
以8通道经颅电刺激装置为例,依照国际主流的电刺激装置参数标准和临床需求,制定了本装置的主要参数见表1。
表1 8通道经颅电刺激装置参数
Tab.1 Parameters of 8-channel transcranial electrical stimulation device
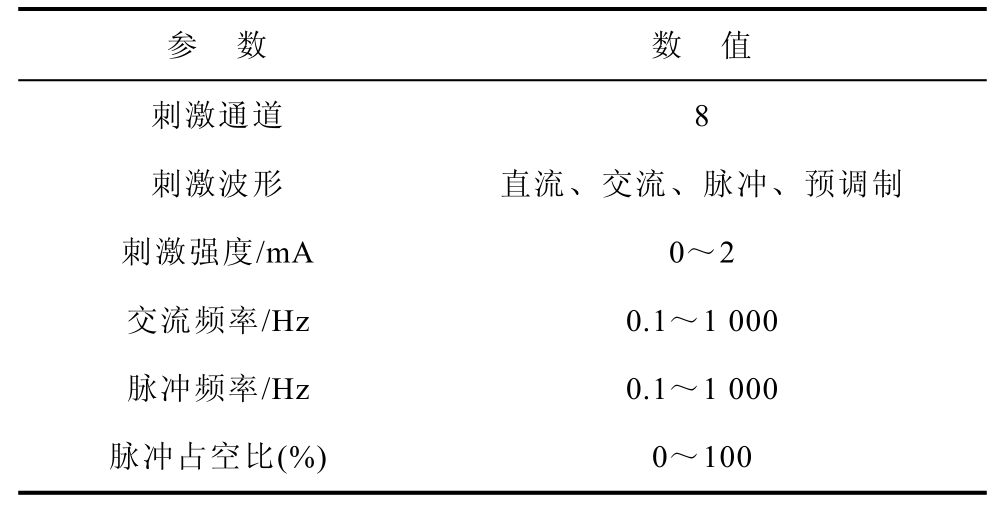
参 数 数 值 刺激通道 8 刺激波形 直流、交流、脉冲、预调制 刺激强度/mA 0~2 交流频率/Hz 0.1~1 000 脉冲频率/Hz 0.1~1 000 脉冲占空比(%) 0~100
2.1 多通道刺激源设计
多通道刺激源输出指定波形的刺激电流,刺激源的设计直接决定了电刺激装置的整体性能。刺激强度和输出精度是刺激源的两个关键参数。考虑到目前标准电刺激安全规范要求刺激强度一般情况下不超过2mA,因此,本装置将单个通道的刺激强度幅值限制在2mA以内。目前,主流的电刺激装置输出精度最高为1%,电流扰动法要求装置误差远小于扰动量(5%),电流输出精度应优化至0.5%以下。此外,需考虑实现多通道刺激的同时尽可能提高装置的集成度[20]。
综上考虑,多通道刺激源由高精度、多通道DAC芯片和精密恒流源电路组成。DAC芯片将驱动代码转换为多路电压信号,恒流源电路将电压信号转换为输出电流。选取16位AD5360作为DAC芯片,输出精度达0.01%。该芯片同时提供16路转换通道,允许对每路通道单独设置,极大地提高了刺激源的集成度。
Howland电流源电路常用于恒流源电路设计,本装置选取复合放大器增强型Howland电流源电路作为参考设计[21],激励源电路设计如图3所示。R0~R4为电流源内部电阻,RL为外部负载电阻,Vin为输入电压。
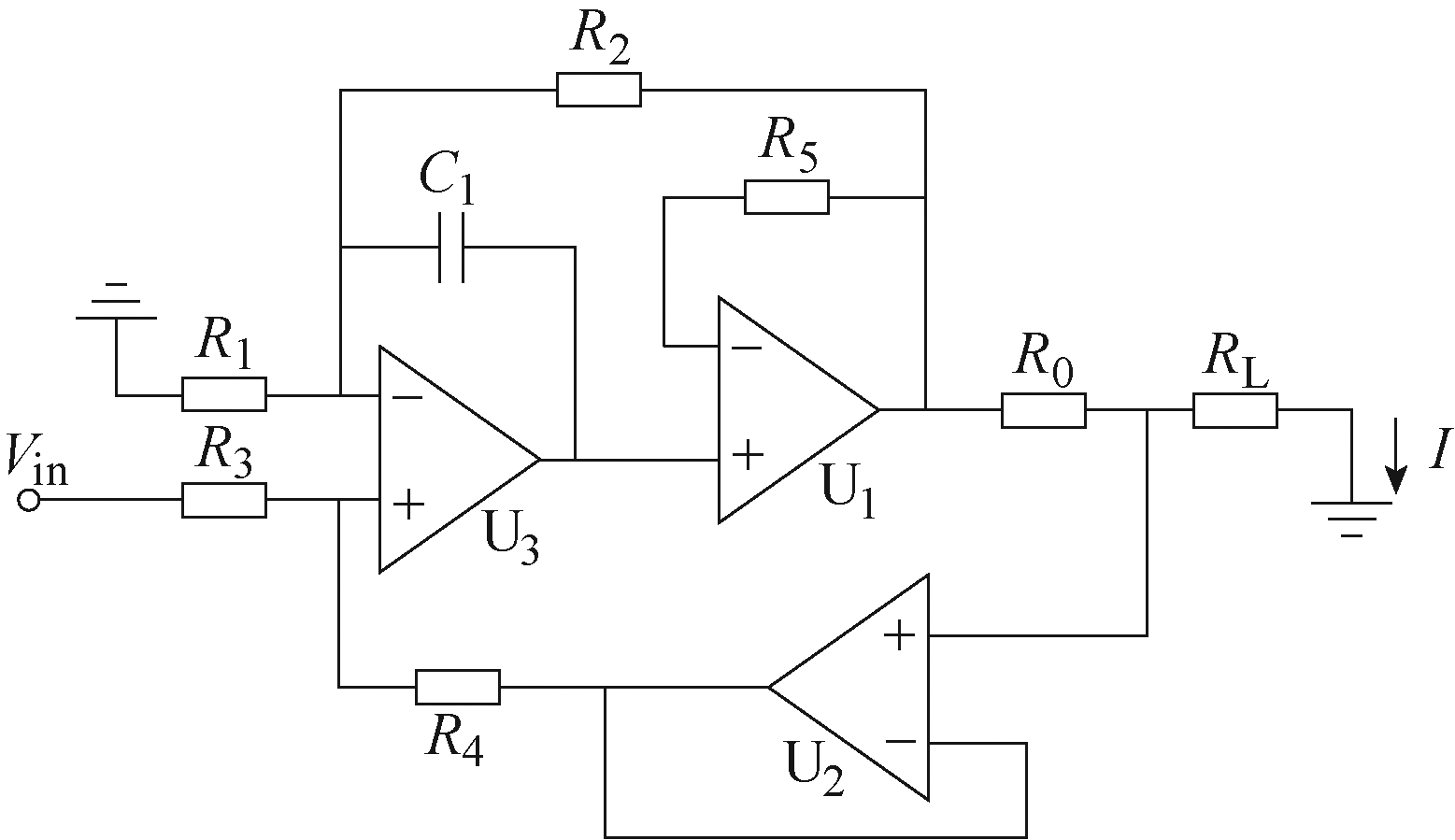
图3 复合放大器增强型Howland电流源电路
Fig.3 Composite amplifier enhanced Howland current source
输出电流I为

当R1=R3、R2=R4时,输出电流I为
输出电流I仅与Vin、K和R0有关,与负载RL无关。考虑器件实际工作特性,电流输出误差ΔI为

式中,K=R1/R2=R3/R4;Vos和Ios分别为U1的输入失调电压和失调电流;Vosbuf和IBbuf分别为U2的输入失调电压和偏置电流。
考虑到电刺激装置刺激源输出电压较高(30V),U1、U2选用高压运算放大器OPA454,输出电压可达50V。为了提高刺激源的输出精度,U3选用高精度放大器OPA2188,OPA2188具有出色的交直流性能,其输入失调电压为25μV,偏置电流为160pA。该电路的典型电流输出误差低至0.81μA,输出电流为0.5mA时,输出误差为0.162%,符合本装置需求。
2.2 控制检测模块设计
电流扰动法要求装置的控制检测模块采样精度高、响应速度快,能够在扰动变化期间迅速准确地按照指令采集多个通道的电压电流信号。在此基础上,本模块应具备较好的可扩展性及集成度。
因此,控制检测模块由精密ADC芯片和精密多路复用器组成。多路复用器将多个通道的输入信号选择性输出至ADC芯片,仅一块ADC芯片即可实现多路信号的采集。16位ADC芯片INA226同时具备电压、电流转换功能,其最大增益误差为0.1%。INA226具有16个可编程地址,极大提高了本模块的可扩展性,满足本装置设计要求。精密互补金属氧化物半导体多路复用器TMUX1104具有高达数十兆赫的频率响应,能够实现各通道信号的快速切换。TMUX1104具有极低的导通泄露电流(3pA)和导通电阻(2Ω),广泛应用于高精度的测量场合。控制检测模块框图如图4所示。
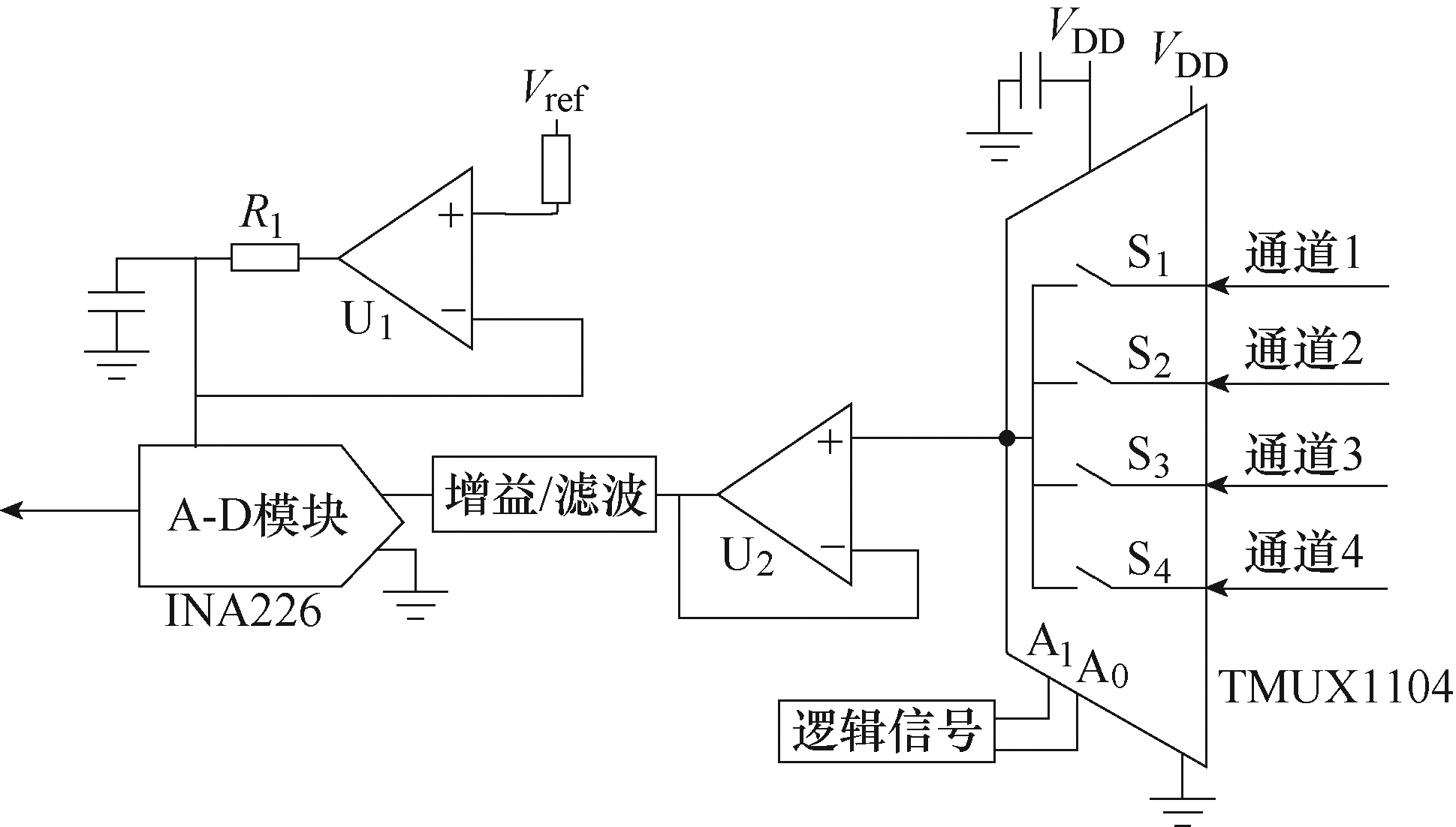
图4 控制检测模块框图
Fig.4 Block diagram of control monitoring module
2.3 软件设计
基于Labview的人机交互界面输出刺激指令至FPGA,FPGA接收Labview的刺激指令,相应地驱动刺激源输出指定刺激波形。同时,FPGA接收来自控制检测模块的电压电流数据,处理为阻抗数据后发送至Labview平台。
Labview人机交互界面如图5所示,包括刺激参数设置以及在线阻抗监测功能。刺激参数设置包括对刺激波形、输出幅值、刺激时间等参数的设置。同时,上位机实时接收来自FPGA的阻抗数据。当某通道阻抗值变化超过30%时,相应通道的指示灯报警,刺激结束。
控制器作为电刺激装置的核心,完成与上位机 通信、驱动DAC、ADC芯片的功能。考虑到本装置要求控制器处理数据能力强、易于扩展。选用FPGA芯片EP4CE6F17C8,其优势在于处理速度快、体系结构灵活。基于FPGA的刺激阶段流程如图6所示。FPGA上电后等待上位机开始指令,接着对刺激波形、幅值等刺激参数初始化,以100μA电流进行预刺激,预刺激结束后进入主刺激阶段,主刺激期间每隔一定时间间隔进行一次阻抗监测,检测到阻抗异常后,刺激结束。

图5 电刺激装置上位机
Fig.5 Electrical stimulation device host computer

图6 刺激阶段流程
Fig.6 Stimulation phase flow chart
3 实验验证
依照上述设计方案,搭建了一台8通道经颅电刺激装置样机,如图7所示。在此样机上对输出波形进行测试,通过经颅直流电刺激模式下的2×1电极拓扑阻抗监测实验,验证了电流扰动法测量电极阻抗的可行性,并完成了多种电极故障状况下的故障电极定位实验。

图7 多通道经颅电刺激装置电路实物
Fig.7 Multi-channel transcranial electrical stimulation circuit
3.1 阻抗监测实验
首先在0~2mA(步长0.5mA)输出电流范围、0~10kΩ(步长2kΩ)负载范围内对输出精度进行 多次重复测试,每个输出电流对应100组测试数据。输出精度箱线图如图8所示,输出误差随输出电流增加而略有增大,在最大输出电流时输出精度优于0.4%,满足设计需求。

图8 输出精度箱线图
Fig.8 Box plot of output accuracy
以2×1电极拓扑为例,在实验样机上采用电流扰动法进行正常工况下的阻抗监测实验。实验开始前,用生理盐水清洗皮肤,将4cm×4cm的橡胶电极用绑带固定在左前臂,PE位于两个AE中间并相距5cm,三者呈一字形排列,确保各电极下导电凝胶的均匀填充。在电刺激期间,每隔10s对各通道刺激波形逐次施加0.25s、10%的电流扰动[16],实验结果如图9a所示。
根据电流扰动法原理,对扰动前后的电压电流扰动量采集处理,得到各通道的电极阻抗数据如图9b所示,刺激期间电极阻抗呈缓慢下降趋势。

图9 正常工况阻抗监测
Fig.9 Impedance monitoring under normal conditions
3.2 故障检测实验
电极脱落、电极接触不良以及电极失效导致的电化学反应等故障发生时,电极阻抗会异常变化。 以2×1电极拓扑的接触不良为例,模拟AE、PE、AE+PE、2AE及2AE+PE电极故障,验证电流扰动法识别故障并定位故障电极的能力。
故障检测实验过程同阻抗监测实验。
在主刺激期间第90s,减小AE2接触面积50%,模拟AE2接触不良工况。实验结果如图10a所示,当对某通道施加电流扰动时,其他通道的电压也会变化,即为串扰电位。
当刺激期间AE2接触不良时,通道二电极电位明显抬升。

根据电流扰动法得到各电极阻抗如图10b所 示,AE1和PE电极阻抗基本不变,AE2电极阻抗变化约60%,电流扰动法实现了对AE故障的识别与定位。

图10 AE故障阻抗监测
Fig.10 AE fault impedance monitoring
在主刺激期间第90s,减小PE接触面积50%,模拟PE接触不良工况。PE故障阻抗监测如图11所示。
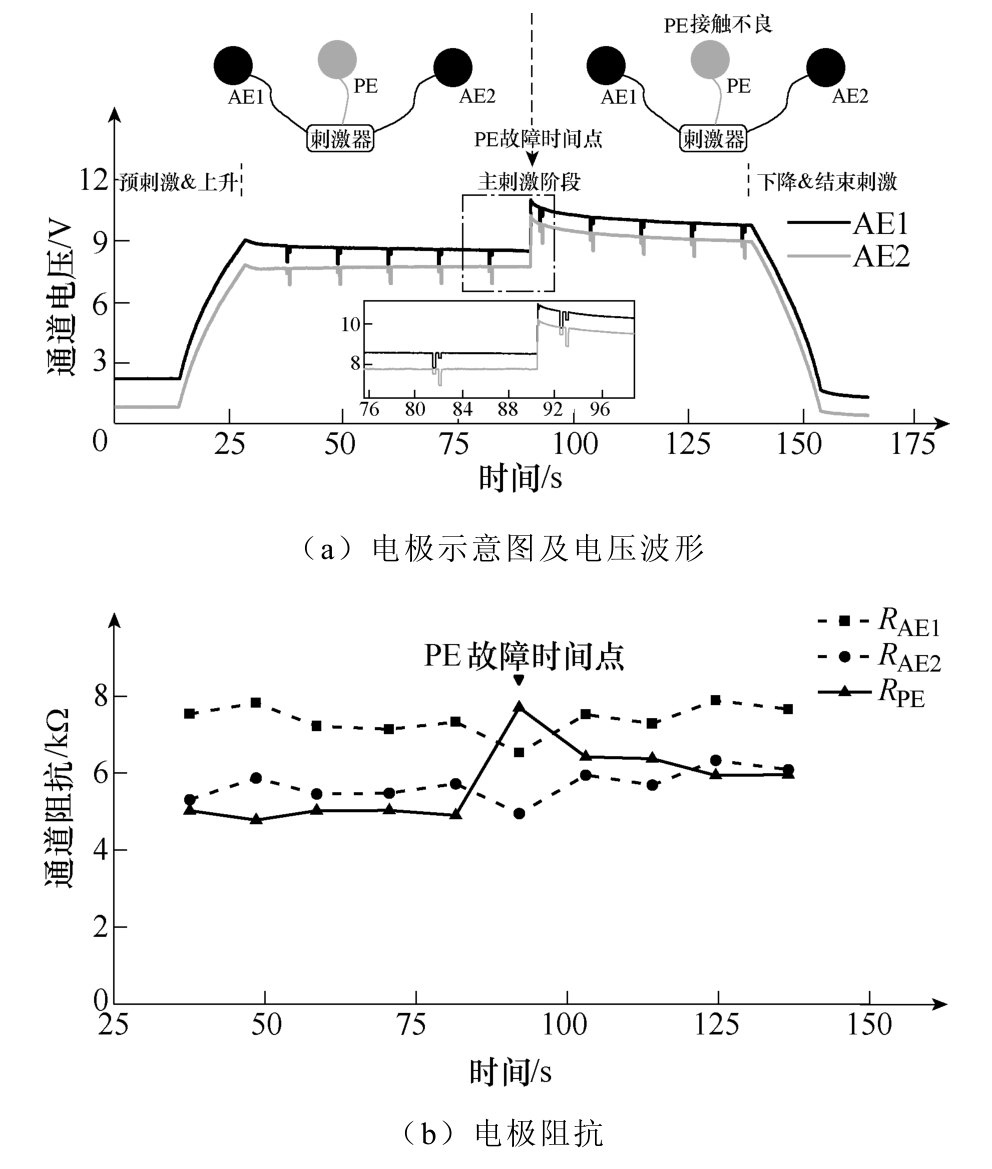
图11 PE故障阻抗监测
Fig.11 PE fault impedance monitoring
当刺激期间PE接触不良时,通道一、二电极电位明显抬升。根据电流扰动法得到各电极阻抗,AE1和AE2电极阻抗受PE故障的影响分别下降了15%和10%,PE电极阻抗变化约60%。
在主刺激期间第80s和第110s,分别减小AE1和AE2接触面积50%,模拟AE1、AE2接触不良工况。双AE故障阻抗监测如图12所示。

图12 双AE故障阻抗监测
Fig.12 Double AE fault impedance monitoring
当刺激期间AE1和AE2接触不良时,AE1和AE2电极阻抗分别变化约50%和75%。
在主刺激期间第82s和第84s,分别减小AE2和PE接触面积50%,模拟AE2、PE同时接触不良工况。AE+PE故障阻抗监测如图13所示。
当刺激期间AE2和PE接触不良时,AE2和PE的电极阻抗分别在故障时间点变化54%和47%,电流扰动法实现了对AE+PE故障的识别与定位。
在主刺激期间第70s、90s和110s,分别减小AE1、AE2和PE接触面积50%,模拟三电极接触不良工况。2AE+PE故障阻抗监测如图14所示。

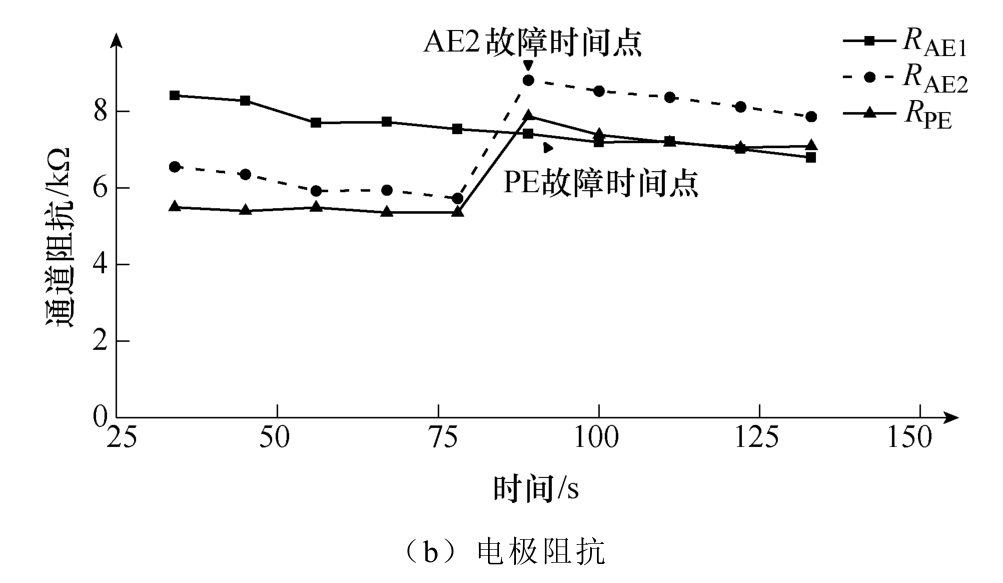
图13 AE+PE故障阻抗监测
Fig.13 AE+PE fault impedance monitoring

图14 2AE+PE故障阻抗监测
Fig.14 2AE+PE fault impedance monitoring
由图14可见,当刺激期间AE1、AE2和PE接触不良时,3个电极在各自故障时间点的电极阻抗分别变化了50%、35%和90%,电流扰动法实现了对2AE+PE故障的识别与定位。
3.3 刺激模式实验
本装置提供用于临床实验的经颅直流电刺激、经颅交流电刺激、经颅脉冲电刺激及预调制电刺激,四种电刺激波形如图15所示,四种模式的波形均符合经颅电刺激标准协议[22-23]。
各刺激通道具有独立输出刺激波形能力,用户 根据需求任意组合输出波形,直流+交流电刺激模式如图16所示,通道一输出直流电刺激,通道二输出交流电刺激。

图15 四种电刺激波形
Fig.15 Four electrical stimulation waveforms

图16 直流+交流电刺激模式
Fig.16 DC + AC electrical stimulation model
4×1(4个有源电极+1个无源电极)直流电刺激实验如图17所示,4个有源电极的刺激电流均为0.5mA,无源电极的返回电流为4路刺激电流之和2mA。

图17 4×1电极拓扑电刺激
Fig.17 4×1 electrode topology electrical stimulation
4 结论
本文针对现有阻抗监测方案测量多电极阻抗误差较大的问题,提出一种新型阻抗测量方法——电流扰动法,通过在刺激波形上叠加短时间、小幅度的电流扰动量,实现了任意多电极拓扑中的串扰解耦,分离自相关电位和串扰电位,根据扰动引起的电压电流变化量测量电极阻抗,并定位故障电极。设计了一种基于电流扰动法的多通道电刺激装置。通过多电极拓扑实验,验证电流扰动法能够分离串扰并测量电极阻抗,针对各类电极故障,均能识别和定位故障电极。为目前电刺激装置的阻抗监测提供了一种简单准确的方法。
[1] Brunoni A R, Nitsche M A, Bolognini N, et al. Clinical research with transcranial direct current stimulation (tDCS): challenges and future directions[J]. Brain Stimulation, 2012, 5(3): 175-195.
[2] 张帅, 崔琨, 史勋, 等. 经颅磁声电刺激参数对神经元放电模式的影响分析[J]. 电工技术学报, 2019, 34(18): 3741-3749.
Zhang Shuai, Cui Kun, Shi Xun, et al. Effect analysis of transcranial magneto-acousto-electrical stimulation parameters on neural firing patterns[J]. Transactions of China Electrotechnical Society, 2019, 34(18): 3741-3749.
[3] Yadollahpour A, Jalilifar M, Rashidi S. Transcranial direct current stimulation for the treatment of depression: a comprehensive review of the recent advances[J]. International Journal of Mental Health and Addiction, 2017, 15(2): 434-443.
[4] 尚莹春, 张涛. 重复经颅磁刺激对认知功能的作用及其分子机理的研究进展[J]. 电工技术学报, 2021, 36(4): 685-692.
Shang Yingchun, Zhang Tao. The role of repetitive transcranial magnetic stimulation on cognitive function and its underlying molecular mechanism[J]. Transactions of China Electrotechnical Society, 2021, 36(4): 685-692.
[5] 张帅, 高昕宇, 周振宇, 等. 基于GrC模型的经颅磁声电刺激对神经元放电活动的影响[J]. 电工技术学报, 2019, 34(17): 3572-3580.
Zhang Shuai, Gao Xinyu, Zhou Zhenyu, et al. Effect of transcranial magnetic-acoustic electrical stimu- lation on neuronal discharge activity based on GrC model[J]. Transactions of China Electrotechnical Society, 2019, 34(17): 3572-3580.
[6] 尹宁, 张家皓, 王海力, 等. 磁刺激穴位调节负性情绪的脑电溯源和脑网络研究[J]. 电工技术学报, 2021, 36(4): 756-764.
Yin Ning, Zhang Jiahao, Wang Haili, et al. Electro- encephalogram source localization and brain network of magnetic stimulation at acupoints to regulate negative emotion[J]. Transactions of China Electro- technical Society, 2021, 36(4): 756-764.
[7] Nitsche M A, Doemkes S, Karakose T, et al. Shaping the effects of transcranial direct current stimulation of the human motor cortex[J]. Journal of Neuro- physiology, 2007, 97(4): 3109-3117.
[8] Manola L, Holsheimer J, Veltink P, et al. Anodal vs cathodal stimulation of motor cortex: a modeling study[J]. Clinical Neurophysiology, 2007, 118(2): 464-474.
[9] Datta A, Bansal V, Diaz J, et al. Gyri-precise head model of transcranial direct current stimulation: improved spatial focality using a ring electrode versus conventional rectangular pad[J]. Brain Stimulation, 2009, 2(4): 201-207.
[10] Datta A, Elwassif M, Battaglia F, et al. Transcranial current stimulation focality using disc and ring electrode configurations: FEM analysis[J]. Journal of Neural Engineering, 2008, 5(2): 163-174.
[11] Park J H, Hong S B, Kim D W, et al. A novel array-type transcranial direct current stimulation (tDCS) system for accurate focusing on targeted brain areas[J]. IEEE Transactions on Magnetics, 2011, 47(5): 882-885.
[12] Turi Z, Ambrus G, Ho K A, et al. What size matters: large electrodes induce greater stimulation-related cutaneous discomfort than smaller electrodes at equivalent current density[J]. Brain Stimulation, 2014, 7(3): 460-467.
[13] Nitsche M A, Cohen L G, Wassermann E M, et al. Transcranial direct current stimulation: state of the art 2008[J]. Brain Stimulation, 2008, 1(3): 206-223.
[14] 贾鑫, 李小俚. 用于经颅直流电刺激的个性化人体阻抗检测[J]. 中国医疗设备, 2019, 34(7): 29-33.
Jia Xin, Li Xiaoli. Personalized human body impedance measurement for transcranial direct current stimulation[J]. China Medical Equipment, 2019, 34(7): 29-33.
[15] Bahareh T, Izmail B, Voicu G, et al. Impact of skin- electrode interface on electrocardiogram measure- ments using conductive textile electrodes[J]. IEEE Transactions on Instrumentation and Measurement, 2014, 63(6): 1412-1422.
[16] Xie Li, Yang Geng, Xu Linlin, et al. Characterization of dry biopotential electrodes[C]//35th Annual inter- national conference of the IEEE Engineering in Medicine and Biology Society, Osaka, Japan, 2013: 1478-1481.
[17] Khadka N, Rahman A, Sarantos C, et al. Methods for specific electrode resistance measurement during transcranial direct current stimulation[J]. Brain Stimulation, 2015, 8(1): 150-159.
[18] Hahn C, Rice J, Macuff S, et al. Methods for extra-low voltage transcranial direct current stimu- lation: current and time dependent impedance decreases[J]. Clinical Neurophysiology, 2013, 124(3): 551-556.
[19] 刘红梅, 姚陈果, 董守龙, 等. 基于测量信号的不可逆电穿孔动态过程数值模拟及分析[J]. 电工技术学报, 2019, 34(18): 3732-3740.
Liu Hongmei, Yao Chenguo, Dong Shoulong, et al. Dynamic numerical modeling and analyzing on the process of irreversible electroporation based on measurement signal[J]. Transactions of China Elec- trotechnical Society, 2019, 34(18): 3732-3740.
[20] 熊慧, 王玉领, 付浩, 等. 一种应用于经颅磁刺激脉冲宽度可调的节能型激励源[J]. 电工技术学报, 2020, 35(4): 679-686.
Xiong Hui, Wang Yuling, Fu Hao, et al. An energy efficient excitation source for transcranial magnetic stimulation with controllable pulse width[J]. Transa- ctions of China Electrotechnical Society, 2020, 35(4): 679-686.
[21] 陈笑风, 杜磊, 赵柏树. 基于Howland电流源的精密压控电流源[J]. 电子技术应用, 2012, 38(9): 71-74.
Chen Xiaofeng, Du Lei, Zhao Baishu. Precision voltage-controlled current source based on Howland current source[J]. Application of Electronic Technology, 2012, 38(9): 71-74.
[22] Bikson M, Datta A, Elwassif M. Establishing safety limits for transcranial direct current stimulation[J]. Clinical Neurophysiology Official Journal of the International Federation of Clinical Neurophysiology, 2009, 120(6): 1033-1034.
[23] Merrill D R, Bikson M, Jefferys G R. Electrical stimulation of excitable tissue: design of efficacious and safe protocols[J]. Journal of Neuroence Methods, 2005, 141(2): 171-198.