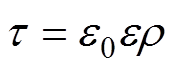 (1)
(1)摘要 纳米材料应用于临床医疗是现代医学发展的重要趋势。其中,靶向性的纳米材料在药物或基因的靶向运送等应用中前景广阔。对于磁导向性的磁性纳米颗粒,可采用磁粒子成像(MPI)技术进行体内成像,而另一类具有电导向性,该文中统称电性纳米颗粒的纳米材料,目前尚未有行之有效的体内无创成像方法。为解决这一难题,该文提出电粒子成像(EPI)方法,通过在注入电性纳米颗粒的生物体周围布置非接触电极阵列,提取电极阵列中检测电极电位与激励电极电位之间的相位差,根据电性纳米颗粒的极化性质,反演出电性纳米颗粒的浓度分布,实现生物组织内电性纳米颗粒的浓度成像。由于该方法尚处于初期探索阶段,需要首先进行可行性分析。该文借助于有限元仿真软件COMSOL,对电粒子成像方法的正问题进行建模求解。数值计算结果表明了该方法的可行性,为后期深入研究奠定理论基础。
关键词:电粒子成像 电性纳米颗粒 正问题 有限元法
纳米医学是现代医学的前沿方向,纳米技术及纳米材料的发展将给慢性疾病的诊断和治疗带来一场深刻的革命,使临床诊疗向微观化、无创化、动态化和智能化的方向发展[1]。目前临床上应用较好的一类主动靶向性纳米材料是磁性纳米颗粒(Magnetic Nanoparticles, MNPs),磁性纳米颗粒具有较强的磁导向性,可通过体外磁场进行调控,因而在磁靶向药物递送、磁性转染、磁热疗和磁纳米温度计等方面具有重要的应用价值和广泛的应用前景[2-4]。此外,还有一类应用广泛的主动靶向性纳米材料,具有较强的电导向性,可通过体外电场进行调控。本文因其在电磁特性上与MNPs对偶,将其统称为电性纳米颗粒(Electrical Nanoparticles, ENPs)。生物医学领域中应用非常广泛的金纳米颗粒(AuNPs)就是一种电性纳米颗粒,具有独特的光物理性质、良好的生物相容性及易于表面修饰等特性,使其在药物靶向递送、肿瘤光热治疗、生物免疫传感器、生物医学成像等领域具有广阔的应用前景[5-7]。
针对体内MNPs的无创成像,可以采用磁粒子成像(Magnetic Particles Imaging, MPI)技术。MPI作为一种新型层析成像技术,在2005年由德国学者B. Gleich和J. Weizenecker首次公开后[8],便受到了学术界的广泛关注。MPI具有较高的灵敏度和空间分辨率,已成功应用于捕捉小鼠心血管系统的活动情况,并生成了一系列实时图像[9]。然而针对ENPs的体内无创成像,目前临床上尚未有行之有效的方法,常见做法是采用活体取样、离体观测的方式。例如,检测生物体内金纳米颗粒的分布及残余浓度,一般需要提取活体组织样本,再借助光镜,如免疫荧光检测仪,或电镜,如电感耦合等离子体质谱仪(ICP-MS)等仪器对样本进行观测[10-12]。这种方法对实验生物体的损伤非常大,尤其是在检测器官内粒子浓度分布时,常常需要活体解剖实验对象,显然无法直接应用于临床。因此,建立一套可实现电性纳米颗粒体内无创成像的方法,具有重要的科学研究价值,其研究成果拥有巨大的临床应用潜力。为解决生物组织内电性纳米颗粒无创成像的难题,本文基于电与磁的对偶特性,提出了电粒子成像(Electric Particles Imaging, EPI)技术。
电粒子成像方法的主要检测原理是基于电介质的Maxwell-Wagner弛豫效应,即外加激励电极会引起介质中自由电荷的重新分布,在导体的近电极表面产生感应电荷,远电极表面产生相反电荷,产生极化的二次电场。被测电介质在极化的二次电场作用下,达到新的电荷分布平衡所需的时间t 称为弛豫时间。弛豫时间t 与真空介电常数e0、电介质的相对介电常数e 以及电介质的电阻率r 成正相关,即
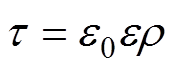 (1)
(1)式中,e0为真空介电常数;e 为电介质的相对介电常数;r 为电介质的电阻率。
则对应的弛豫频率wd为
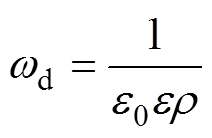 (2)
(2)电介质由于极化产生的弛豫时间将导致外加激励电场与极化电场之间存在相位差,因此可以通过测量电极之间的相位差信号来表征被测电介质的电参数信息。图1为单测量通道的等效示意图。其中,V为外加激励电场的电压,d1为被测电介质厚度,d2为被测电介质到测量电极的距离,ds为电极厚度,S为电极面积,施加激励电场的频率为w。
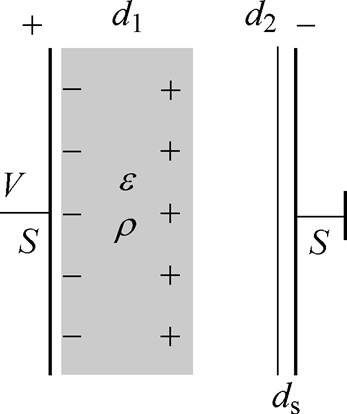
图1 单测量通道等效示意图
Fig.1 The equivalent circuit for a single measurement channel
在电介质未充满电极的情况下,测量电极的电压Vs与外电场电压V的比值为
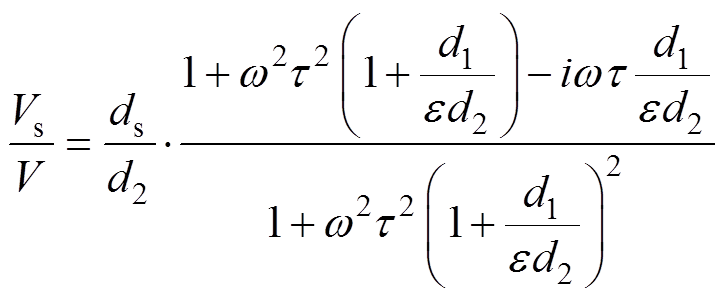 (3)
(3)由式(3)可以看出,检测电压Vs与外电场电压V之间存在相位差,相位差P包含了被测电介质的相对介电常数e 和电阻率r 的信息,且
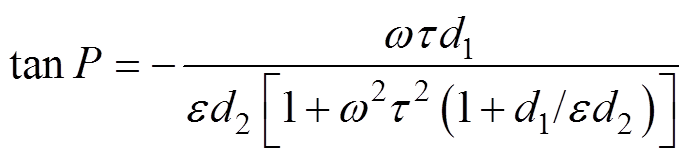 (4)
(4)
式(4)可以简化为
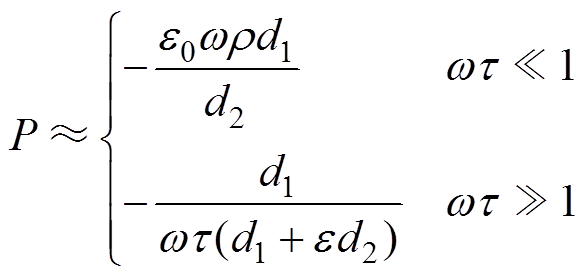 (5)
(5)根据式(4),被测电介质在无量纲系数wt =1时取得最大的相位差,且该最大相位差可近似为
 (6)
(6)
由式(5)和式(6)可知,被测电介质的电参数(电阻率r 和相对介电常数e )可以通过测量电极上的电压与外电场电压之间的相位差来表征。因此,在获得电极上由所测的电性纳米颗粒产生的测量电压Vs与外加激励电场电压V之间的相位差P后,可以通过图形反演算法重建出被测电性纳米颗粒的电参数分布。
由于被测电性纳米颗粒在激励电极施加的激励电压作用下产生极化效应,根据电性纳米颗粒的极化特性,其相对介电常数e 与极化率ce之间存在如下关系
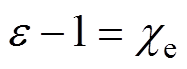 (7)
(7)根据极化粒子的Langevin-Debye公式,可以建立热平衡状态下电性纳米颗粒的极化率ce与单位体积内粒子数量N之间定量关系为
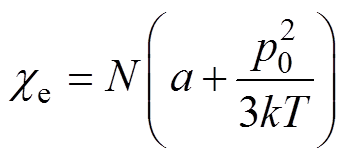 (8)
(8)
式中,p0为分子的电偶极矩;k为玻耳兹曼常数;T为热力学温度;a为感应极化系数;N为单位体积含有的粒子数量,即单位体积内的粒子浓度。
联合式(7)和式(8),可以得到电性纳米颗粒的相对介电常数e 与粒子浓度N之间的关系为
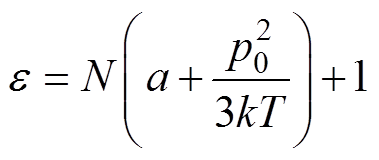 (9)
(9)由式(9)可知,电性纳米颗粒的相对介电常数e 与粒子浓度N之间存在定量转换关系。因此,根据检测电压与外电场电压之间的相位差信号P,重建出生物组织内电性纳米颗粒相对介电常数的分布图像后,可以由式(9)进一步获得电性纳米颗粒的浓度分布信息,实现对生物组织内电性纳米颗粒的浓度成像。
综合以上分析,本文提出的电粒子成像方法原理如图2所示。在注入了电性纳米颗粒的生物体周围布置一圈电极阵列,采用非接触方式在电极阵列的某一电极上施加高频电场激励,激发生物体和电性纳米颗粒的Maxwell-Wagner弛豫效应,提取电极阵列中其余检测电极的电位与激励电极电位之间的相位差,再通过相应的反演算法,可以重建出生物体内电性纳米颗粒的电参数分布。之后,根据电性纳米颗粒的极化性质,得到电性纳米颗粒相对介电常数与粒子浓度分布之间的对应关系,从而获得电性纳米颗粒的浓度分布图像,实现生物组织内电性纳米颗粒的浓度分布成像。

图2 电粒子成像方法原理
Fig.2 The schematic diagram for the electrical particles imaging method
与其他成像方法类似,对EPI方法的研究也可以分为正问题和逆问题。所谓正问题是指对于某些物理过程,若已知该物理过程的内部参数,根据系统的约束规律以及某些特定条件(如初始条件或边界条件等)来确定系统的某些可观测变量,而与之相反的过程则称为逆问题[13-21]。对正问题的研究有助于分析成像方法理论的可行性。由于本文提出的EPI方法尚处于初期探索阶段,需要对该方法的可行性进行分析。本文采用有限元分析方法(Finite Element Method, FEM),借助有限元分析软件COMSOL,通过建立仿真模型对电粒子成像方法的正问题进行建模求解,分析提出的EPI方法的可行性。
电粒子成像方法的正问题是根据系统约束和边界条件,求解检测电压与外电场电压之间的相位差信号P。由于电粒子成像方法所采用的交变电场工作频率对应的波长远大于系统尺寸,可采用电准静态近似,描述测量区域中的电场为
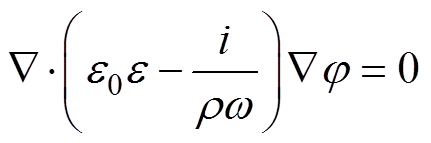 (10)
(10)式中,j 为电场的标量电位;w 为施加激励信号的角频率。
边界条件为
 (11)
(11)式中,f为在电极上施加的激励电压。
本文通过有限元仿真软件COMSOL对电粒子成像方法的正问题进行分析求解,基于以下基本假定:①多相介质流沿轴向分布是不变的,即研究在特定截面上电容值的变化是常量;②传感器管截面上无自由电荷;③模型内部不受外界磁场的干扰。
为了更直观地阐述检测电极的电压与激励电极的电压之间的相位差P随激励频率w 及被测介质电参数(即弛豫时间t )之间的联系,本文采用简化的二维平面模型,设定求解区域为方形测量区域,方形的边长为60mm。被测工质为24mm×60mm的矩形电性纳米粒子团簇,相对介电常数e =10,电阻率r =100W·m,放置在方形测量区域内。测量系统为单通道电极检测模型,测量电极和激励电极分别置于方形的上下两条对边上,激励电极上施加的激励电压幅值为1V,测量电极初始电压幅值为0V,其余两条边接地。电粒子成像数值仿真模型示意图如图3所示。

图3 电粒子成像数值仿真模型示意图
Fig.3 The numerical model diagram for the electrical particles imaging method
选定物理场为“电流”接口,通过“频域”模块研究仿真模型受到一个或多个频率的谐波激励时的响应。求解过程中采用直接求解器。
考察检测电极的电压与激励电极的电压之间的相位差P的绝对值随无量纲系数wt 的变化曲线,如图4所示。从图4可以看出,在无量纲系数wt <1时,检测电压与外电场电压之间相位差P的绝对值随wt 增大而迅速增大,在wt >1时,|P|随wt 增大而缓慢减小,|P|的最大值|Pmax|在wt =1时取得。此外,从图4得出,通过数值仿真计算得出的|Pmax|约为0.07rad,与通过式(6)获得的|Pmax|理论值|Pmax|≈ |-d1/(ed2)|=24/(10×36) rad=0.067rad非常接近。因此可以认为,通过数值仿真获得的相位差P随wt 的变化规律与第1节理论一致。
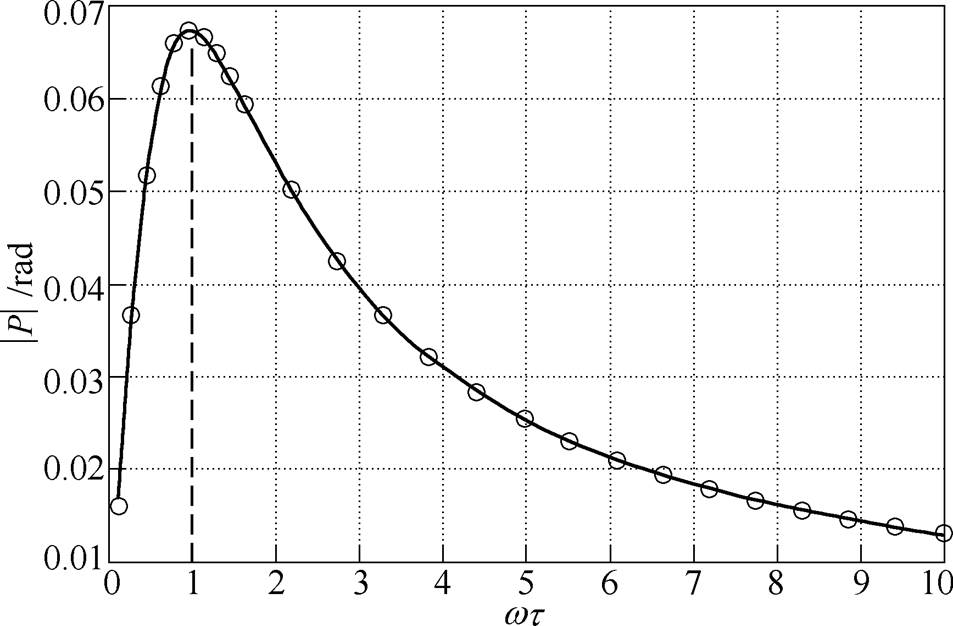
图4 测量相位差P随无量纲参数wt 的变化曲线
Fig.4 The dependence of the measured phase shift P on the dimensionless parameter wt
此外,由式(5)还可以得出,在wt <1时,检测电压与外电场电压之间相位差P与被测工质的电阻率r 成正比,因此在被测工质处于wt <1的频段范围内,保持相对介电常数e =10不变,使被测工质的电阻率r 分别为50W·m、25W·m、12.5W·m、6.25W·m时,考察检测电压与外电场电压之间的相位差的绝对值|P|随外加激励频率w 的变化曲线,如图5所示。由图5可知,在wt <1时,检测电压与外电场电压之间相位差的绝对值P随着频率的增大而增大,呈线性关系,且与被测工质的电阻率r 成正比。仿真模型计算的结果与第1节理论部分一致。
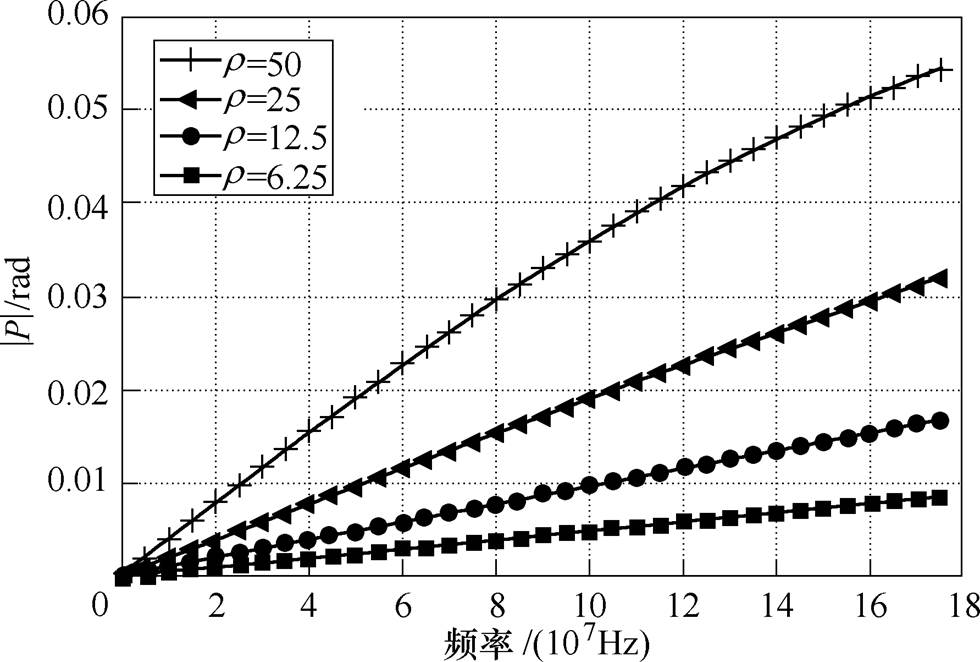
图5 不同电阻率r 的介质的测量相位差P随频率w 变化曲线
Fig.5 Curves showing the dependence of the measured phase shift P on the frequency wwith different resistivity r
根据以上仿真实验,可得出如下结论:由于被测工质的弛豫效应,测量空间电位相对于发射电极产生相位延迟,即检测电极的电压与激励电极的电压之间存在相位差P,该相位差信号P受激励频率w 以及被测介质的电参数(如弛豫时间t 或相对介电常数e 和电阻率r )的影响,因此,可以通过选择适当的激励频率w,使wt =1(即施加激励频率w 等于被测工质的弛豫频率wd),此时测量电极上获得的相位差信号P的绝对值最大。获得相位差信号P后,可以通过图像反演算法重建出被测工质的相对介电常数e 的分布,进而通过式(9)获得电性纳米颗粒的浓度分布信息,实现生物组织内电性纳米颗粒的浓度成像。仿真实验结果证明本文提出的电粒子成像方法是可行的。
本文针对电性纳米颗粒的体内无创成像,提出了电粒子成像方法,并借助于有限元仿真软件COMSOL,对电粒子成像方法的正问题进行仿真建模,分析了本文提出的电粒子成像理论的正确性及方法的可行性,为后期研究工作的开展奠定了理论基础。
参考文献
[1] 张晨阳, 谷战军, 晏亮. 纳米技术在医疗上的应用[J]. 现代物理知识, 2018, 30(5): 20-25.
Zhang Chenyang, Gu Zhanjun, Yan Liang. Appli- cation of nanotechnology in medical treatment[J]. Modern Physics, 2018, 30(5): 20-25.
[2] Mody V, Cox A, Shah S, et al. Magnetic nanoparticle drug delivery systems for targeting tumor[J]. Applied Nanoscience, 2014, 4(4): 385-392.
[3] Estelrich J, Escribano E, Queralt J, et al. Iron oxide nanoparticles for magnetically-guided and magnetically- responsive drug delivery[J]. International Journal of Molecular Sciences, 2015, 16(4): 8070-8101.
[4] Pi Shiqiang, Liu Wenzhong, Kai Wei, et al. AC magnetic nanothermometry: an investigation of the influence of size distribution of magnetic nano- particles[J]. IEEE Transactions on Magnetics, 2017, 53(3): 1-7.
[5] Ghosh P, Gang Han, De M, et al. Gold nanoparticles in delivery applications[J]. Advanced Drug Delivery Reviews, 2008, 60(11): 1307-1315.
[6] Kumar A, Ma Huili, Zhang Xu, et al. Gold nano- particles functionalized with therapeutic and targeted peptides for cancer treatment[J]. Biomaterials, 2012, 33(4): 1180-1189.
[7] Dong Shuaibing, Wang Shaochen, Gyimah E, et al. A novel electrochemical immunosensor based on catalase functionalized AuNPs-loaded self-assembled polymer nanospheres for ultrasensitive detection of tetrabro- mobisphenol a bis (2-hydroxyethyl) ether[J]. Analytica Chimica Acta, 2019, 1048: 50-57.
[8] Gleich B, Weizenecker J. Tomographic imaging using the nonlinear response of magnetic particles[J]. Nature, 2005, 435(7046): 1214-1217.
[9] Kaul M, Salamon J, Knopp T, et al. Magnetic particle imaging for in vivo blood flow velocity measure- ments in mice[J]. Physics in Medicine & Biology, 2018, 63(6): 064001.
[10] Yang Yanjing, Zhong Shian, Wang Kemin, et al. Gold nanoparticle based fluorescent oligonucleotide probes for imaging and therapy in living systems[J]. Analyst, 2019, 144(4): 1052-1072.
[11] Mahmoodzadeh F, Abbasian M, Jaymand M, et al. A novel gold-based stimuli-responsive theranostic nanomedicine for chemophotothermal therapy of solid tumors[J]. Materials Science and Engineering: C, 2018, 93: 880-889.
[12] Shi Xiaoli, Zhu Yuting, Hua Wenda, et al. An in vivo study of the biodistribution of gold nanoparticles after intervaginal space injection in the tarsal tunnel[J]. Nano Research, 2016, 9(7): 2097-2109.
[13] 张帅, 侯琬姣, 张雪莹, 等. 基于真实乳腺模型的感应式磁声成像正问题[J]. 电工技术学报, 2016, 31(24): 126-133, 149.
Zhang Shuai, Hou Wanjiao, Zhang Xueying, et al. Forward problem in magnetoacoustic tomography with magnetic induction based on real model of breast[J]. Transactions of China Electrotechnical Society, 2016, 31(24): 126-133, 149.
[14] 夏慧, 刘国强, 黄欣, 等. 注入电流式磁声成像平面模型的逆问题研究[J]. 电工技术学报, 2017, 32(4): 147-153.
Xia Hui, Liu Guoqiang, Huang Xin, et al. The inverse problem study of plane model based on magneto- acoustic tomography with current injection[J]. Transactions of China Electrotechnical Society, 2017, 32(4): 147-153.
[15] 张帅, 李子秀, 张雪莹, 等. 基于时间反演的磁动力超声成像仿真与实验[J]. 电工技术学报, 2019, 34(16): 3303-3310.
Zhang Shuai, Li Zixiu, Zhang Xueying, et al. The simulation and experiment of magneto-motive ultrasound imaging based on time reversal method[J]. Transactions of China Electrotechnical Society, 2019, 34(16): 3303-3310.
[16] 李星, 杨帆, 余晓, 等. 基于内源式电阻抗成像的接地网缺陷诊断逆问题研究[J]. 电工技术学报, 2019, 34(5): 902-909.
Li Xing, Yang Fan, Yu Xiao, et al. Research on the inverse problem of grounding grid fault diagnosis based on inner-source EIT[J]. Transactions of China Electrotechnical Society, 2019, 34(5): 902-909.
[17] 贺中华, 何为, 贺玉成, 等. 皮肤烧伤深度检测的单边核磁共振浅层成像磁体系统[J]. 电工技术学报, 2019, 34(3): 449-458.
He Zhonghua, He Wei, He Yucheng, et al. Unilateral nuclear magnetic resonance superficial imaging magnet system for skin burn depth assessme[J]. Transactions of China Electrotechnical Society, 2019, 34(3): 449-458.
[18] 金立军, 陈俊佑, 张文豪, 等. 基于图像处理技术的电力设备局部放电紫外成像检测[J]. 电力系统保护与控制, 2013, 41(8): 43-48.
Jin Lijun, Chen Junyou, Zhang Wenhao, et al. Partial discharge detection of power equipment by ultraviolet imaging based on image processing technology[J]. Power System Protection and Control, 2013, 41(8): 43-48.
[19] 周正钦, 杜振波, 王文瑞, 等. 基于分层分布的变电站带电运维智能化技术及应用[J]. 电力系统保护与控制, 2019, 47(1): 150-157.
Zhou Zhengqin, Du Zhenbo, Wang Wenrui, et al. Intelligent technology and application of live detection for substation operation and maintenance based on hierarchical distribution[J]. Power System Protection and Control, 2019, 47(1): 150-157.
[20] 漆灿, 李庆武, 郑云海, 等. 基于智能视觉物联网的变电站红外监测系统[J]. 电力系统保护与控制, 2018, 46(15): 135-141.
Qi Can, Li Qingwu, Zheng Yunhai, et al. Infrared monitoring system for substation based on intelligent visual internet of things[J]. Power System Protection and Control, 2018, 46(15): 135-141.
[21] 周德全, 石天明. 基于ANSYS的电阻层析成像传感器敏感场三维分析[J]. 电气技术, 2008, 9(3): 30-33.
Zhou Dequan, Shi Tianming. Three-dimensional analysis of electrical resistance tomography sensor fields based on ANSYS[J]. Electrical Engineering, 2008, 9(3): 30-33.
Electrical Particles Imaging Method and Numerical Study on the Forward Problem
Abstract The application of nanomaterials in clinical medicine is an important trend in modern medicine. Among them, targeted nanoparticles have broad prospects in targeting drugs or genes in vivo. So far, magnetic particles imaging (MPI) has been applied to image magnetic nanoparticles. However, the electric oriented nanoparticles, named electrical nanoparticles (ENPs) in this paper, have no effective in vivo imaging method. Therefore, this paper proposed a novel method called electrical particles imaging (EPI). In EPI, arrays of non-contact electrodes are arranged around organisms with injected electrical nanoparticles. The phase difference of the potential between the detecting electrode and the excitation electrode is extracted. According to the polarization properties of electrical nanoparticles, the concentration distribution of the electrical nanoparticles can be reconstructed through a corresponding inversion algorithm. Since the EPI method is still in the initial exploration stage, its feasibility needs to be demonstrated first. In this paper, the finite element simulation software COMSOL was employed to analyze the forward problem of the EPI method. Numerical results verified the proposed method, and laid a theoretical foundation for our future study.
keywords:Electrical particles imaging (EPI), electrical nanoparticles (ENPs), forward problem, finite element method
中图分类号:TM93
DOI: 10.19595/j.cnki.1000-6753.tces.191342
国家自然科学基金(51907191)和北京市自然科学基金(3204057)资助项目。
收稿日期2019-10-17
改稿日期 2019-12-26
刘 婧 女,1990年生,博士,助理研究员,研究方向为电磁检测与成像。E-mail: liujing@mail.iee.ac.cn
刘国强 男,1971年生,研究员,博士生导师,研究方向为生物电磁检测与多物理场耦合成像。E-mail: gqliu@mail.iee.ac.cn(通信作者)
(编辑 崔文静)