0 引言
21 世纪以来,大气压冷等离子体技术快速发展,已广泛应用于生物医学[1-3]、材料处理[4-5]、环境保护[6-7]等多个领域。以大气压冷等离子体的医学应用为例,应用于低温灭菌、皮肤美容、快速止血、组织消融的产品已通过美国食品药品监督管理局(FDA)认证[8-10],且应用于皮肤慢性溃疡治疗的产品也获得了欧洲CE 认证[11]。大气压冷等离子体及其应用已发展成为一个独具特色的研究领域,包含等离子体科学、电气工程、生物医学、材料科学等多个学科的交叉与融合[12-14]。
大气压冷等离子体的产生过程中,电子与参与放电的气体分子在高压电场的作用下发生一系列分解、电离和吸附等物理化学过程,进而产生大量的活性氧粒子(Reactive Oxygen Species,ROS)、活性氮粒子(Reactive Nitrogen Species,RNS)以及氢粒子等活性粒子[15-16]。其中,ROS 主要包括氧原子(O)、羟基自由基(OH)、单线态氧(1O2)、过氧化氢(H2O2)、臭氧(O3)、超氧阴离子( 2O−)等,RNS 主要包括一氧化氮(NO)、二氧化氮(NO2)、过氧亚硝酸(ONOOH)等,而氢粒子主要指H+离子和H 原子。这些活性粒子在冷等离子体应用中发挥着关键的作用,例如在生物医学应用中,文献报道OH 和 2O−具有极强的细胞毒性[17-19],NO 与DNA 损伤和炎症反应直接相关[20-21],ONOO-参与细胞内重要的氧化还原过程[22-23]等。研究冷等离子体产生的活性粒子具有重要意义,但过去的研究主要集中在等离子体中及其周围气体区域。在诸多冷等离子体应用中,被处理对象往往处于潮湿环境或直接淹没于水溶液中,活性粒子必须进入水溶液中才能发挥直接或关键的作用。因此,研究等离子体处理水溶液过程中产生的液相活性粒子对于提升等离子体科学的认知水平并促进相关应用的发展至关重要。
根据文献报道,冷等离子体处理水溶液时产生的常见液相活性粒子有30 余种,既包括H2O2、H+、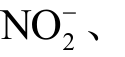
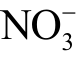 等长寿命粒子,也包括OH、
等长寿命粒子,也包括OH、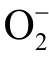 、NO、ONOOH 等短寿命粒子[24-25]。这些液相活性粒子在应用中发挥着不同的作用,以冷等离子体用于细菌灭活为例,研究发现等离子体直接处理细菌悬浮液过程中,短寿命液相活性粒子(如 2O−、OH)起到主要的杀菌作用[19, 26];然而对于等离子体处理过后的水溶液,则主要是长寿命活性粒子(如H2O2、
、NO、ONOOH 等短寿命粒子[24-25]。这些液相活性粒子在应用中发挥着不同的作用,以冷等离子体用于细菌灭活为例,研究发现等离子体直接处理细菌悬浮液过程中,短寿命液相活性粒子(如 2O−、OH)起到主要的杀菌作用[19, 26];然而对于等离子体处理过后的水溶液,则主要是长寿命活性粒子(如H2O2、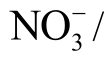
 等)起到杀菌作用[27]。此外,液相活性粒子的作用效果与其浓度(剂量)密切相关,以H2O2 粒子的生物效应为例,研究发现当液相H2O2 的浓度小于10μmol/L 时可以有效刺激细胞增殖,但浓度高于10μmol/L 时就会产生细胞毒性[28]。尽管如此,到底是哪一种活性粒子起到关键作用,不同文献有不同的说法,目前还没有统一的认知。进一步,液相活性粒子安全有效的浓度(剂量)区间是多少,也缺乏定量的认识。这两个科学问题亟待得到解答,只有这样才能有针对性地调控关键的活性粒子,实现最佳的应用效果。
等)起到杀菌作用[27]。此外,液相活性粒子的作用效果与其浓度(剂量)密切相关,以H2O2 粒子的生物效应为例,研究发现当液相H2O2 的浓度小于10μmol/L 时可以有效刺激细胞增殖,但浓度高于10μmol/L 时就会产生细胞毒性[28]。尽管如此,到底是哪一种活性粒子起到关键作用,不同文献有不同的说法,目前还没有统一的认知。进一步,液相活性粒子安全有效的浓度(剂量)区间是多少,也缺乏定量的认识。这两个科学问题亟待得到解答,只有这样才能有针对性地调控关键的活性粒子,实现最佳的应用效果。
检测确定被处理水溶液中活性粒子的成分,并量化活性粒子的浓度是解决上述科学问题的必要条件。目前冷等离子体产生的液相活性粒子的检测方法主要包括分光光度法、光化学荧光探针法、化学显色法、液相色谱法、电子自旋共振谱法和同位素标记法等。例如利用光化学探针Griess 试剂和酶标仪可以精准检测液相 2NO−粒子浓度[24]。但目前能有效检测的活性粒子种类少,特别是对于一些短寿命活性粒子,检测工作仍存在一些难点。例如利用电子自旋共振谱法测量短寿命活性粒子时,自旋捕捉剂必须提前加入到水溶液中,但这会干扰液相活性粒子原有的反应过程,使得测量获取的浓度值不是真实值。此外,多数的测量方法还存在在线检测困难、试剂特异性差等问题。尽管如此,随着科学检测手段的不断进步,越来越多的液相活性粒子检测方法将得以研发并应用,从而更好地促进冷等离子体应用的发展。
鉴于液相活性粒子检测的重要性,本文整理归纳了近些年来国内外报道的液相活性粒子检测方法,首先介绍这些检测方法的基本原理和特点,进而针对等离子体处理水溶液中常见的11 种液相活性粒子,包括羟基自由基(OH)、过氧化氢(H2O2)、臭氧(O3)、单线态氧(1O2)、超氧阴离子( 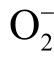 )、一氧化氮(NO)、硝酸根离子(
)、一氧化氮(NO)、硝酸根离子( )、亚硝酸根离子(
)、亚硝酸根离子(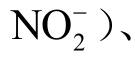 、过氧亚硝酸(ONOOH)和过氧亚硝酸根离子(ONOO-)、过氧硝酸粒子(O2NOOH)、氢原子(H),具体介绍这些方法的使用要点。最后,探讨现有检测方法的一些共性问题,并对液相活性粒子检测的未来发展进行展望。
、过氧亚硝酸(ONOOH)和过氧亚硝酸根离子(ONOO-)、过氧硝酸粒子(O2NOOH)、氢原子(H),具体介绍这些方法的使用要点。最后,探讨现有检测方法的一些共性问题,并对液相活性粒子检测的未来发展进行展望。
1 常用检测方法介绍
针对冷等离子体产生的液相活性粒子,目前常用的检测方法可以分为光化学检测法、液相色谱法、电子自旋共振谱法和同位素标记法等四大类。其中光化学检测法根据检测特性或发光特性的区别又细分为分光光度法、光化学荧光探针法和化学显色法等。
本节分别就最常用的分光光度法、光化学荧光探针法、化学显色法、液相色谱法、电子自旋共振谱法和同位素标记法的基本原理、检测特点和适用范围进行介绍。
1.1 分光光度法
分光光度法是通过测定活性粒子在特定波长处或一定波长范围内的吸光度,对该活性粒子进行定性或定量分析的方法[29-30]。不同活性粒子的分子结构不同,使得对不同波长光的吸收能力也不同,因此存在选择吸收特性的最大吸收波长,形成最大吸收峰,继而产生特有的吸收光谱。同一种活性粒子的浓度不同,对光的吸收程度也不同。如以波长(λ)为横坐标,吸光度(A)为纵坐标,就可绘出该粒子的吸收光谱曲线,通过该曲线可以对活性粒子进行定性或定量分析。
分光光度法又被称为吸收光谱法,其应用光区范围包括紫外光区、可见光区和红外光区。该方法设备仪器简单、操作快速、适用范围较广。
适用的液相活性粒子包括OH、H2O2、O3、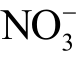 、
、 和ONOOH 等。
和ONOOH 等。
1.2 光化学荧光探针法
化学探针是指一些能与特定的靶分子发生特异性相互作用的化学试剂,光化学荧光探针法是将这种特异性相互作用产生的荧光物质利用光学方法定性或定量测量的一种方法。荧光产物吸收光辐射,价电子进入激发态,随后跃迁回基态,以光辐射形式释放能量发出荧光。待测活性粒子浓度与荧光产物的发光强度在一定条件下呈线性关系,借助酶标仪等光学仪器可以证明被测活性粒子的存在或可以准确测量其浓度[31]。
荧光产物的最大激发波长和最大荧光发射波长是定性鉴定待测活性粒子的依据,也是定量测量时最灵敏的条件。该方法特异性好、灵敏度高,可以较为精准地测量液相活性粒子的浓度。
适用的液相活性粒子包括 OH、H2O2、NO、ONOOH 等。
1.3 化学显色法
化学显色法是指选取并添加合适的化学试剂,通过化学反应将待测活性粒子转变为有色化合物后再进行测量的一种方法。常见的化学反应有氧化还原反应、配位反应等。化学显色法可以根据是否借助光学仪器等辅助测量分为两类,本文主要介绍通过肉眼或显色试纸直接定性或粗略定量液相活性粒子浓度的直接化学显色法,如滤纸显色法、滴定法等。
化学显色法操作简单、适用范围较广。但对于其中的直接化学显色法,因为只能达到定性或粗略定量检测,其局限性也非常明显。
适用的液相活性粒子包括OH、H2O2、O3 等。
1.4 液相色谱法
色谱法是一种高效能物理分离技术,流动相和固定相是其中最为关键的两种结构,当流动相为液体时,称之为液相色谱法。将待测水溶液注入流动相中,根据溶质在两相间分配系数、亲和力或吸附力等差别使待测水溶液中的不同组分实现分离。分离后的样品进入检测器,检测信号采集处理后,记录成色谱图。进而与标准谱图进行比较,根据色谱图中的保留时间定性,根据峰高或峰面积定量。
液相色谱法灵敏度高、分析速度快、操作自动化,能同时进行多种活性粒子的分离。其中的离子交换色谱法作为液相色谱法的一种,常用于检测等离子体处理水溶液产生的液相长寿命阴离子[32-33]。
适用的液相活性粒子包括 、
、 、O2NOOH等。
、O2NOOH等。
1.5 电子自旋共振谱法
电子自旋共振谱法是利用电子自旋共振谱仪(ESR)测量液相自由基的一种方法。自由基是一种结构中含有未配对的电子的强化学活性粒子。当自由基被置于磁场中时,未配对电子会产生具有方向性的磁矩,体现出顺磁性的特性。如果此时有特定剂量的、恰和未配对电子能级间隔相匹配的外界能量注入,这些电子就会发生“共振”现象,吸收这部分能量发生跃迁,从而在能量谱上体现出不同的谱线特征。通过观察谱线的分裂模式或计算谱线的双积分值,即可确定被测自由基的种类或定量计算自由基的浓度[34-35]。
此外,由于被测液相自由基的寿命很短,很难在取样过程中维持可测的浓度,因此实际操作中需要在等离子体处理之前加入特定的自旋捕捉剂。自旋捕捉剂与被测自由基反应生成同为自由基但相对稳定的自旋加和物,使得ESR 有足够时间进行有效检测。
电子自旋共振谱法制样简单、测量信号稳定,广泛应用于等离子体产生的液相短寿命活性粒子测量,但目前自旋捕捉剂的特异性较差,测量结果存在累积效应,且成本较高。
适用的液相活性粒子包括 2O−、1O2、OH、NO 等。
1.6 同位素标记法
同位素标记法是利用放射性核素或稀有稳定核素作为示踪剂对活性粒子进行标记,用于追踪被测粒子的转移和变化过程的微量分析方法,因此也被称为同位素示踪法。放射性核素本身是一种原子核不稳定且具有放射性的原子,利用放射性核素标记的化合物和普通化合物具有相同的化学性质和生物学性质,只是具备不同的核物理性质。根据放射性同位素不断释放特征射线的核物理性质,就可以利用核探测器随时追踪被标记化合物的数量、分布及其转变等过程[36]。
同位素标记法具有方法简单、灵敏度高、定位定量准确、符合生理条件等优点。在等离子体处理水溶液的研究工作中,可利用H、O、N 等原子的同位素对液相活性粒子的生成去除机制进行追根溯源[37-38]。
适用的液相活性粒子包括H、O、OH、O3 等。
2 主要液相活性粒子的检测与分析方法
冷等离子体处理水溶液时产生的常见液相活性粒子约30 余种。这些液相活性粒子可以有多种分类方式,比如根据活性粒子在水溶液中半衰期的不同可以分为短寿命活性粒子和长寿命活性粒子;根据结构中是否含有未配对电子可以分为自由基和非自由基;此外,活性粒子中含有N 原子的可以归为RNS,其余活性粒子中如含有O 原子可归为ROS 等。表1 显示了等离子体处理水溶液中部分常见的液相活性粒子,按ROS、RNS 和含H 粒子进行了分类。
表1 常见液相活性粒子分类
Tab.1 Classification of common aqueous reactive species
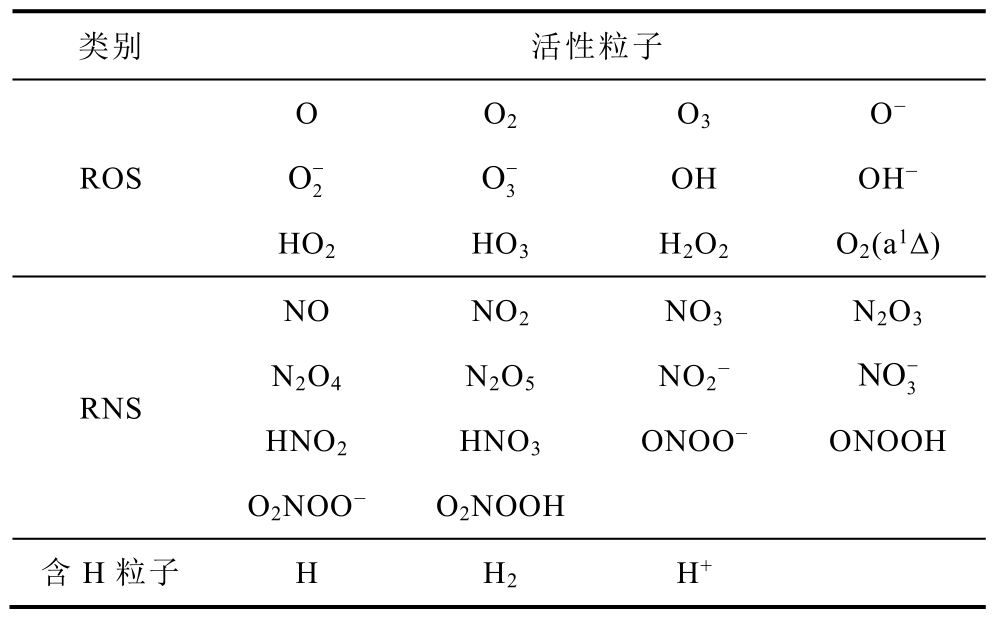
类别 活性粒子ROS O 2 O−HO2 O2 3 O−HO3 O3 OH H2O2 O−OH−O2(a1∆)RNS NO N2O4 HNO2 O2NOO−NO2 N2O5 HNO3 O2NOOH NO3 NO2−ONOO− N2O3 3 NO−ONOOH 含H 粒子 H H2 H+
现有的检测方法不能完全定性或定量地检测表1 中列举的所有活性粒子,本节针对11 种研究较多的液相ROS、RNS 和H 粒子,整理归纳了它们的检测方法,重点介绍了每种方法的特点和注意事项。
2.1 羟基自由基(OH)
在冷等离子体处理水溶液产生的众多液相活性粒子中,羟基自由基(OH)是最为关键的一个。它不仅具有极强的氧化性和细胞毒性,还可以合成液相H2O2[39],在冷等离子体生物医学应用中发挥着重要作用[17]。液相OH 自由基的寿命很短,有报道指出其半衰期仅为10-9s[40]。目前液相OH 自由基常用的检测方法有电子自旋共振谱法、光化学荧光探针法、分光光度法等。
2.1.1 电子自旋共振谱法
利用电子自旋共振谱法检测液相OH 自由基时,常用的自旋捕捉剂有DMPO、CYPMPO 等。
1)5,5-dimethyl-1-pyrrolineN-oxide(DMPO)
DMPO 是检测液相OH 自由基最常用的一种自旋捕捉剂。将适量浓度的DMPO 提前加入被处理水溶液,混合均匀后再进行等离子体处理。DMPO 与液相OH 自由基反应生成自旋加和物DMPO-OH,其反应速率大于109/(mol·L-1·s)[41]。该加和物的谱线峰高比为1:2:2:1,如图1 所示[42]。
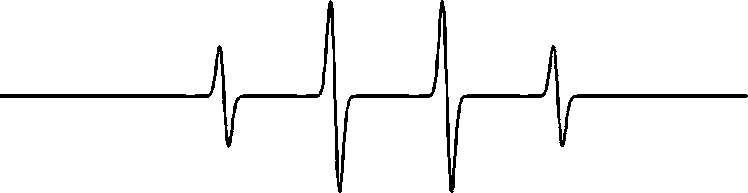
图1 DMPO-OH 的ESR 标准谱图
Fig.1 Standard spectrum of DMPO-OH in ESR
利用自旋捕捉剂DMPO 测量液相OH 自由基有以下几点需要注意:①DMPO 还可以与液相 2O−自由基反应生成自旋加和物DMPO-OOH,但反应速率低于102/(mol·L-1·s)[42]。此外,自旋加和物DMPO-OOH并不稳定,在1min 左右就会分解生成DMPO-OH。因此DMPO-OH 的最终测量结果可能会比液相OH自由基的实际浓度稍微偏大一些。②DMPO 还可以与液相H 原子和 3O−粒子分别反应生成DMPO-H 和DMPOX[43-44],但三种加和物DMPO-OH、DMPO-H和DMPOX 的ESR 谱线相差较大,可以实现谱线分离单独计算液相OH 自由基的浓度。③O16H 和O17H的ESR 谱线是不同的[45],利用同位素标记法可对等离子体产生的液相OH 自由基追本溯源。④自旋捕捉剂DMPO 会进行热分解,因此检测温度不能高于室温太多[44]。
2)5-(2,2-dimethyl-1,3-propoxy cyclophosphoryl)-5- methyl-1-pyrroline N-oxide(CYPMPO)
CYPMPO 是用于检测液相OH 自由基的另外一种自旋捕捉剂,其检测能力与DMPO 类似,但其高熔点、低吸湿性等特性更有利于实际应用[46-47]。CYPMPO 捕捉OH 形成加和物的ESR 谱图如图2所示[47]。
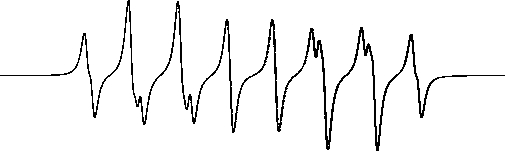
图2 CYPMPO-OH 的ESR 标准谱图
Fig.2 Standard spectrum of CYPMPO-OH in ESR
CYPMPO 与DMPO 类似,也可以捕捉到液相 自由基,从而影响液相OH 自由基的特异性测量。已有文献研究过两种加和物谱线的区别,但效果并不突出[47]。此外,CYPMPO 的价格比DMPO 昂贵得多。
自由基,从而影响液相OH 自由基的特异性测量。已有文献研究过两种加和物谱线的区别,但效果并不突出[47]。此外,CYPMPO 的价格比DMPO 昂贵得多。
2.1.2 光化学荧光探针法
利用光化学荧光探针法检测液相OH 自由基时,常用的化学试剂有对苯二甲酸及其衍生物对苯二酸二钠盐等。
1)对苯二甲酸(TA)
对苯二甲酸(TA)是检测液相OH 自由基的一种常用试剂。TA 可以与OH 自由基特异性反应生成2-羟基对苯二甲酸(HTA)。TA 分子本身无荧光,但是用UV-A 光激发时,HTA 分子会产生强荧光反射,最大激发和发射波长为315nm 和425nm[48]。
利用TA 检测液相OH 具有特异性,因为TA 不与水溶液中其他活性粒子如 2O−、O3、H2O2 等发生反应。但实际应用中的关键问题是TA 只能在碱性环境下溶解,而等离子体处理的水溶液往往呈酸性,因此需要提前向被处理水溶液中加入氢氧化钠(NaOH)或其他碱性盐,但这样会改变被处理溶液的化学体系,导致测量结果受到影响[49]。
2)对苯二酸二钠盐(NaTA)
(NaTA)同样可以与液相OH 自由基特异性反应生成HTA,反应速率为3.2×109/(mol·L-1·s)[50]。其检测方法与TA 的检测方法相同,但NaTA 可以溶解于中性溶液,在检测之前不需要添加其他的化学物质,或者只需少量添加。因此NaTA 的适用性及检测效果要优于TA。
2.1.3 分光光度法
利用分光光度法检测液相OH 自由基的常用化学试剂有多种,如亚甲蓝、二甲基亚砜、茜素紫、邻二氮菲、水杨酸、还原型细胞色素C 等[51]。但在冷等离子体处理水溶液的研究中,利用分光光度法测量液相OH 自由基的报道较少,其原因可能是等离子体处理水溶液时会产生多种RNS 和ROS,以上试剂的适用性和特异性尚未确定。因此,本文只以亚甲蓝为代表,介绍分光光度法测量液相OH 自由基的基本原理。
亚甲蓝(MB)是一种芳香杂环化合物,常被用作化学指示剂。MB 阳离子(深蓝色)与OH 自由基反应生成氢氧根离子和MB 自由基阳离子(无色),使得MB 溶液的透明度与OH 自由基的浓度成线性关系。MB 溶液在波长665nm 处有最大吸收峰。提前向被处理水溶液中加入MB 溶液,测量等离子体处理前后的吸光度变化,可以计算出OH 自由基的浓度[52]。
某些情况下在水溶液中可直接产生OH 自由基(如利用Fenton 试剂法等)[53],此外等离子体活化水(等离子体处理后的水溶液)中某些内部反应也可以生成液相OH 自由基[24]。利用MB 溶液和滤纸可以实现定性地检测液相OH 自由基的存在。将滤纸浸染在配置好的MB 溶液(通常为1mmol/L),完全干燥后可以作为OH 自由基的检测试纸。将处理后的待测溶液立即滴加在试纸上,如果试纸颜色被漂白,即可证明溶液中OH 自由基的存在[54]。
根据目前的研究结果,亚甲蓝染色测试中MB阳离子与OH 自由基的反应不会受到液相H2O2 的影响,但等离子体产生的其他ROS 和RNS 对MB阳离子的化学作用还需要进一步研究[55]。
2.2 过氧化氢(H2O2)
过氧化氢(H2O2)是冷等离子体处理水溶液中最常见的ROS[56]。液相H2O2属于长寿命活性粒子,常温下分解速率缓慢,其半衰期与温度密切相关。等离子体产生的液相H2O2 在细菌灭活、促进细胞增殖等应用中起到重要作用[27, 57]。同时在日常生活中,H2O2 水溶液也广泛应用于医用伤口消毒、环境消毒和食品消毒等[58]。目前液相H2O2 常用的检测方法有分光光度法、光化学荧光探针法、化学显色法等。
2.2.1 分光光度法
利用分光光度法检测液相H2O2 时,常用的化学试剂有硫酸氧钛、辣根过氧化物酶/邻苯二胺、偏钒酸铵等。
1)硫酸氧钛(TiOSO4)
硫酸氧钛(TiOSO4)比色法是测量液相H2O2 常用的检测方法之一。钛氧基离子在酸性条件下与液相H2O2 反应生成黄色的过氧钛(IV)络合物。该络合物稳定存在于水溶液中,其颜色强度与液相H2O2的浓度成正比,在波长407nm 处有最大吸收峰。该方法检测液相H2O2 浓度的下限为2μmol/L[59]。
使用该方法有两点需要注意:①该检测方法需要在pH 值2.0~2.5 的范围内进行,因此在测量前需要对被处理溶液用硫酸进行酸化[60];②钛氧基离子在强酸性条件下可以与液相H2O2 粒子特异性反应,但水溶液中的 粒子在酸性条件下也会与液相H2O2 粒子发生反应,因此在测量前需要添加叠氮钠来去除溶液中的
粒子在酸性条件下也会与液相H2O2 粒子发生反应,因此在测量前需要添加叠氮钠来去除溶液中的 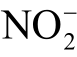 粒子,以保证测量的准确性[61]。
粒子,以保证测量的准确性[61]。
2)辣根过氧化物酶/邻苯二胺(HRP/OPD)
利用辣根过氧化物酶(HRP)催化液相H2O2 氧化邻苯二胺(OPD)来测量液相H2O2 浓度是较为常用的一种检测方法[62-63]。OPD 本身为无色,HRP 在液相H2O2 粒子存在的条件下可以将OPD 氧化为橙红色的2,3-二氨基吩嗪。反应产物的颜色强度与液相H2O2 的浓度成正比,且在波长450nm 处有最大吸收峰[64]。
该方法可以特异性检测液相H2O2 粒子浓度,但OPD 见光易变质,使用时需控制检测环境。
3)偏钒酸铵(Amonium Metavanadate)
偏钒酸铵是测量液相H2O2 粒子最常用的化学试剂之一。在酸性环境下,偏钒酸铵可以与液相H2O2 粒子反应生成红橙色的过氧钒阳离子。过氧钒阳离子稳定存在于水溶液中,且颜色强度与反应体系中H2O2 的浓度成正比,在波长450nm 处有最大吸收峰。该方法检测液相 H2O2 浓度的下限约为15μmol/L[65]。
文献表明,该方法对于水溶液中的H2O2 粒子具有较好特异性,不会受到Cl-、 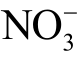 、
、 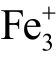 等粒子的影响,但仍不能排除液相O3 的影响[66]。
等粒子的影响,但仍不能排除液相O3 的影响[66]。
2.2.2 光化学荧光探针法
ThermoFisher 公司生产的Amplex Red 试剂盒是目前最为常用的检测液相H2O2 浓度的光化学荧光探针。
等离子体处理后,将适量Amplex Red 试剂加入被处理水溶液。该试剂在辣根过氧化物酶(HRP)的催化下与液相H2O2 发生剂量比为1:1 的反应,生成具有红色荧光的试卤灵(Resorufin),其最大激发和发射波长分别为550nm 和595nm[67-68]。Amplex Red 试剂对H2O2 有很高的灵敏度,其最低检测限可达10pmol/L。Amplex Red 与液相H2O2 反应机制如图3 所示。
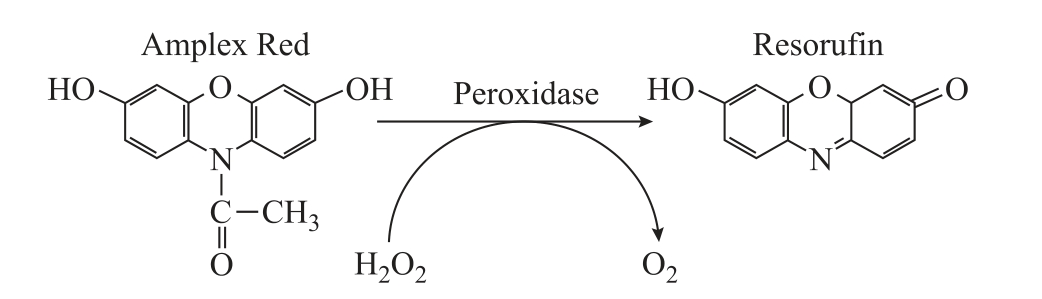
图3 Amplex Red 测量H2O2 的反应机制
Fig.3 Reaction mechanism between Amplex Red regent and aqueous H2O2
利用该方法检测液相H2O2,有几点需要注意:①该试剂与液相H2O2 特异性反应,但Amplex Red试剂对空气和pH 值都比较敏感,做实验时需控制实验条件;②该方法实时性较差,Amplex Red 试剂与被处理水溶液混合后,需避光孵育30min,保证其充分反应;③标准曲线的线性范围一般不超过30μmol/L,因此测量高浓度的H2O2溶液时需要先稀释。
2.2.3 化学显色法
WAK-H2O2(C)测定器可以通过化学显色法快速检测液相H2O2 浓度。WAK-H2O2(C)是一个高浓度液相H2O2 水质简易测定器,其内部装填有检测试剂的封闭性试管,使用时吸入待测水溶液,水溶液与检测试剂反应变色后于指定时间内比对标准色卡,判断其浓度值。同时有文献报道,待测水溶液变色后在波长525nm 处的吸光度与液相H2O2 的浓度成线性关系,因此利用分光光度法也可以定量测量水溶液中H2O2 浓度[69]。
该方法测量范围为0.1~20μmol/L,但测量过程中易受到水溶液中O3 的影响[70]。
2.3 臭氧(O3)
大气压冷等离子体产生的O3 粒子被认为在灭菌、有机物氧化等诸多应用中发挥着重要作用[71]。普遍认为液相O3 粒子来源于气相O3 粒子的溶解,且液相活性粒子浓度与参与放电的O2 浓度正相关。液相O3 的半衰期与溶液性质密切相关,通常寿命比较长,但在等离子体处理的水溶液中却可能很短[24]。目前液相O3 常用的检测方法有分光光度法、光化学荧光探针法、化学显色法等。
2.3.1 分光光度法
利用分光光度法检测液相O3 时,常用的化学试剂有硼酸—碘化钾溶液、靛蓝胭脂红等。
1)硼酸—碘化钾(KI)溶液
O3 凭借其强氧化性可以与硼酸—碘化钾溶液反应置换出游离碘。将适量无色的硼酸—碘化钾溶液和淀粉溶液加入含有液相O3 的水溶液,充分反应后生成的游离碘使溶液显蓝色。溶液颜色深度与O3粒子的浓度成线性关系,且在波长352nm 处有明显吸收峰[72]。
该方法并不能特异性检测液相O3,因为水溶液中的过氧化物、超氧化物和亚过氧化物等都会对检测结果产生影响[73]。
2)靛蓝胭脂红(Indigo Carmine)
靛蓝胭脂红是测量液相O3 粒子最常用的化学试剂之一。其本身为一种水溶性蓝色染料,最大吸收峰波长为605nm,颜色深度与吸光度正相关。液相O3 粒子的存在可以使靛蓝胭脂红的C=C 双键发生裂解,分解产物为无色,因而溶液颜色变浅[74]。利用波长605nm 处的吸光度变化,可计算得到液相O3 粒子的浓度。
靛蓝胭脂红试剂同样不能特异性检测液相O3粒子,等离子体处理水溶液中的其他ROS,如OH自由基和1O2 自由基,也可以引起双键的裂解[75]。
2.3.2 光化学荧光探针法
利用光化学荧光探针法检测液相O3 时,常用的化学试剂有Pittsburgh green probe、色氨酸-三酞菁等。
1)Pittsburgh green probe(PG)
Pittsburgh green probe(PG)是一种可以准确测量液相O3 粒子浓度的化学探针。PG 探针来源于2',7'-二氯荧光素,虽然目前尚不能商购,但其合成相对简单且产率很高,具体合成细节可参考文献[76]。PG 与液相O3 粒子发生反应,最终生成一种激发波长和发射波长分别为496nm 和520nm 的荧光产物。具体反应过程如图4 所示[76],其中PG 的化学结构如图中标记1 所示[77-78]。
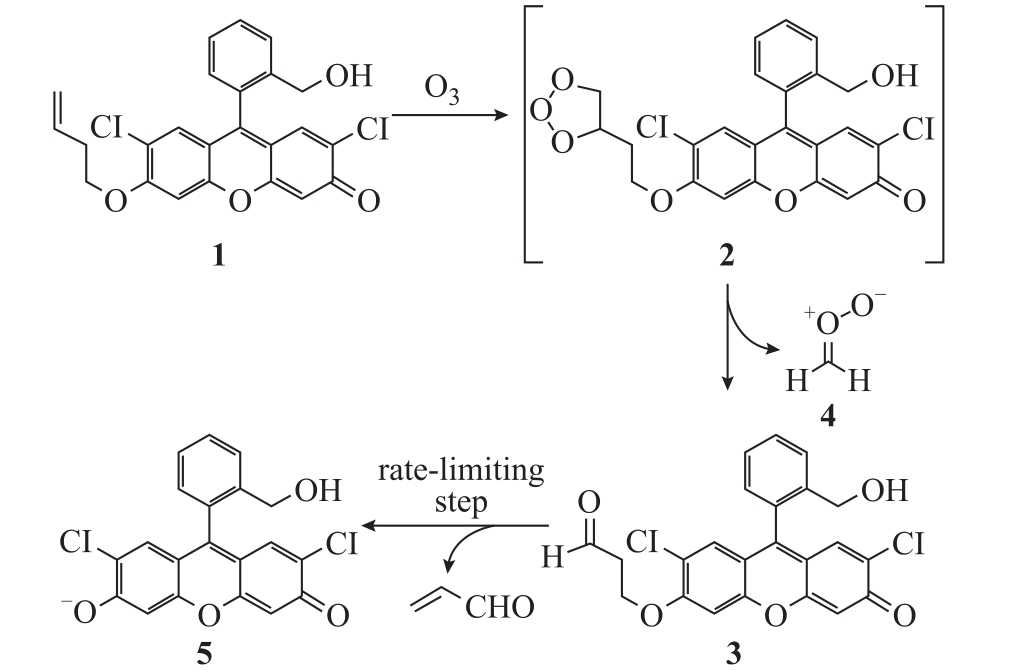
图4 O3 粒子与PG 探针的反应过程
Fig.4 Reaction process between O3 and PG probe
PG 探针与液相O3 粒子特异性反应,其他液相ROS 和RNS 对其检测结果没有影响[79]。但利用PG探针检测液相O3 粒子有以下几点需要注意:①PG探针与O3 粒子的反应过程长达几个小时,通常需要加入催化剂Pyrrolidine 缩短反应时间;②PG 探针并不能完全溶于水,已报道的工作是先将PG 探针溶于5%的甲醇水溶液或二甲基亚砜(DMSO)有机溶液,再用于被处理水溶液中的O3 检测,但有机溶液的加入会干扰水溶液自身反应体系[77];③测量过程中,需要保证PG 探针的使用量超过需求量,且优选在中性PH 缓冲溶液中进行[78]。
2)色氨酸-三酞菁(Trp-Cy)
具有高消光系数的近红外荧光染料三酞菁(Cy),结合L-色氨酸(Trp)可以合成一种新的化学探针Trp-Cy,作为液相O3 粒子指示剂。该方法首次使用于山东师范大学分子与纳米探针重点实验室,用于细胞中O3 粒子的测量[80]。Trp-Cy 最大荧光激发和发射波长分别为630nm 和770nm,荧光强度与液相O3 粒子浓度在0.05~7.0mmol/L 的范围内有良好的线性关系。
根据报道,Trp-Cy 与O3 粒子的反应具有很好的特异性,细胞内其他化学物质都不会对检测结果产生影响,包括OH 自由基、1O2 自由基、H2O2、NO等活性粒子,谷胱甘肽和抗坏血酸等生物抗氧化剂,以及K+,Ca2+和Mg2+等金属离子[81]。
2.3.3 化学显色法
液相O3 还可以通过DPD 臭氧测定试剂盒快速检测。该方法的检测原理是采用N,N-二乙基对苯二胺(DPD)——碘化钾法。在碘化钾的催化下,液相O3 与DPD 反应生成一种红色的化合物。在专用的比色管中,向待测溶液加入DPD 试剂,O3 粒子与其充分反应后通过标准比色色阶溶液确定被测溶液的O3 含量。
该方法测量范围为1.0~20.0μmol/L,但检测过程中会受到其他ROS 如液相H2O2 粒子的影响。
2.4 单线态氧(1O2)
单线态氧(1O2)是一种激发态氧分子,同时也是一种高活性的ROS[82]。1O2 在气相和液相中都不太稳定,在液相中只有几微秒。如果溶液中同时存在H2O2 粒子和次氯酸盐(OCl-),可以直接产生液相1O2粒子[83]。1O2 粒子被认为具有强细胞毒性,在等离子体生物医学应用中发挥着十分重要的作用[84]。液相1O2 粒子的检测方法有很多,如电子自旋共振谱法、光化学荧光探针法、分光光度法、磷光检测法、化学发光法等。本文结合等离子体处理水溶液的特点,重点介绍电子自旋共振谱法和光化学荧光探针法。
2.4.1 电子自旋共振谱法
利用电子自旋共振谱法检测液相 1O2 粒子时,2,2,6,6-tetra methylpiperidine(TEMP)是最为常用的自旋捕捉剂。TEMP 可以与液相1O2 粒子反应形成稳定的加和物TEMPO,反应速率为5.3×105/(mol·L-1·s)[85]。虽然 1O2 粒子不是自由基,但自旋加和物TEMPO 属于自由基,其ESR 谱图如图5 所示[86],谱线峰高比为1:1:1。
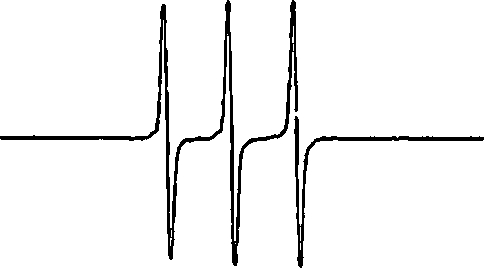
图5 TEMPO 的ESR 标准谱图
Fig.5 Standard spectrum of TEMPO in ESR
自旋捕捉剂TEMP 液相1O2 粒子特异性反应,并不会受到等离子体产生的其他短寿命活性粒子如OH 和 2O−自由基的影响。但TEMP 试剂有强烈的刺鼻性气味,且在空气中容易被氧化[87]。
2.4.2 光化学荧光探针法
利用光化学荧光探针法检测液相 1O2 时,常用的化学试剂有9,10-二苯基蒽、1,3-二苯基异苯并呋喃、Singlet Oxygen Sensor Green 等。
1)9,10-二苯基蒽(DPA)
9,10-二苯基蒽(DPA)是一种紫色荧光物质,是检测液相 1O2 粒子最常用的化学探针之一。DPA可以与 1O2 粒子快速反应生成稳定的内过氧化物,反应速率为1.3×106/(mol·L-1·s)。DPA 的最大激发和发射波长为370nm 和443nm,其荧光强度随着内过氧化物的生成而不断降低[88]。
此外,DPA 本身在波长355nm 处有强吸收峰,1O2 粒子与DPA 的反应使其吸光强度减小,因此也有报道利用分光光度计检测对应波长处的吸光度变化来计算液相1O2 粒子的浓度[89]。
DPA 可以与1O2 粒子特异性反应,其他活性粒子如液相H2O2 等对其检测没有影响。但DPA 水溶性差,只能溶解于有机溶剂,限制了该方法在等离子体处理水溶液中的应用[90]。
2)1,3-二苯基异苯并呋喃(DPBF)
1,3-二苯基异苯并呋喃(DPBF)自身也是一种荧光探针,其最大激发波长和发射波长分别为403nm 和455nm。DPBF 与液相1O2 粒子发生反应,使得荧光强度减弱[91]。
在等离子体处理水溶液体系,DPBF 可以与液相1O2 粒子和 2O−粒子同时发生反应[92]。因此特异性测量1O2粒子浓度时,需提前加入 2O−粒子的清除剂。DPBF 对空气和光敏感,同时DPBF 也只能溶解于有机溶剂。
3)Singlet Oxygen Sensor Green (SOSG)试剂
SOSG 是目前可以特异性检测液相 1O2 粒子的一种探针。SOSG 与 1O2 粒子反应生成一种内过氧化物,发出绿色荧光,最大激发波长和发射波长为504nm 和525nm[93]。
SOSG 可以与 1O2 粒子特异性反应,水溶液中的OH 自由基或者其他超氧化物并不会对检测结果产生影响[94]。但SOSG 使用时需避光,因为UV 或可见光辐射也会使得SOSG 发出绿色荧光[95]。
2.5 超氧阴离子( 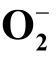 )
)
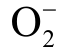 自由基是生物体内氧代谢最先生成的自由基,也是所有氧自由基的前身[96]。生理水平的
自由基是生物体内氧代谢最先生成的自由基,也是所有氧自由基的前身[96]。生理水平的 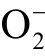 自由基具有独特功能,但过量时会产生氧化损伤,导致组织损伤而诱发多种疾病。
自由基具有独特功能,但过量时会产生氧化损伤,导致组织损伤而诱发多种疾病。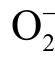 自由基在水溶液中可以接受一个 H+形成质子化的超氧自由基HOO[97]。在等离子体处理水溶液的体系中,
自由基在水溶液中可以接受一个 H+形成质子化的超氧自由基HOO[97]。在等离子体处理水溶液的体系中,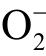 自由基被认为在细菌灭活等应用中发挥关键作用[98]。
自由基被认为在细菌灭活等应用中发挥关键作用[98]。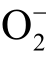 自由基在水溶液中的存活时间约为1s,在脂溶性介质中的存活时间约为1h。目前液相
自由基在水溶液中的存活时间约为1s,在脂溶性介质中的存活时间约为1h。目前液相 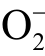 自由基常用的检测方法有电子自旋共振谱法、光化学荧光探针法等。
自由基常用的检测方法有电子自旋共振谱法、光化学荧光探针法等。
2.5.1 电子自旋共振谱法
利用电子自旋共振谱法检测液相 2O−自由基时,常用的自旋捕捉剂有 TEMPONE-H、DEPMPO、DMPO、CYPMPO 等。
1)TEMPONE-H
TEMPONE-H 是目前使用较多的测量 2O−自由基浓度的一种自旋捕捉剂。TEMPONE-H 与液相 2O−反应生成稳定的自旋加和物TEMPONE,反应速率为1.2×104/(mol·L-1·s)[99]。TEMPONE-H 同样可以捕获液相的过氧亚硝酸根离子(ONOO-),反应速率为6×109/(mol·L-1·s),但其最终产物都是TEMPONE[100]。图6 为加和物TEMPONE 的ESR 标准谱图[100]。
因此利用TEMPONE-H 检测液相 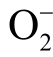 自由基浓度时,需要在相同实验条件下做两组实验。第一组单独加入适量浓度的TEMPONE-H,等离子体处理后结合标准曲线计算出水溶液中
自由基浓度时,需要在相同实验条件下做两组实验。第一组单独加入适量浓度的TEMPONE-H,等离子体处理后结合标准曲线计算出水溶液中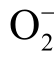 自由基和ONOO-的总浓度。第二组同时加入TEMPONE-H 和足量浓度的
自由基和ONOO-的总浓度。第二组同时加入TEMPONE-H 和足量浓度的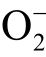 自由基清除剂,等离子体处理后计算得出ONOO-的浓度。两组实验中自旋加和物TEMPONE 浓度的减少量即为液相
自由基清除剂,等离子体处理后计算得出ONOO-的浓度。两组实验中自旋加和物TEMPONE 浓度的减少量即为液相 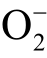 自由基的浓度[100]。
自由基的浓度[100]。

图6 TEMPONE 的ESR 标准谱图
Fig.6 Standard spectrum of TEMPONE in ESR
2)5-(Diethoxyphosphoryl)-5-methyl-1-pyrroline-N-oxide(DEPMPO)
DEPMPO 同样为液相 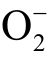 自由基常用的自旋捕捉剂之一。DEPMPO 可以与液相
自由基常用的自旋捕捉剂之一。DEPMPO 可以与液相 自由基反应生成稳定的自旋加和物 DEPMPO-OOH[101]。 然而DEPMPO 也并不能特异性检测
自由基反应生成稳定的自旋加和物 DEPMPO-OOH[101]。 然而DEPMPO 也并不能特异性检测 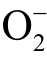 自由基,还会与液相H 自由基、OH 自由基以及C 自由基发生反应[45]。
自由基,还会与液相H 自由基、OH 自由基以及C 自由基发生反应[45]。
图7 展示了DEPMPO 与液相多种自由基反应生成的自旋加和物的ESR 谱图[45]。如果利用DEPMPO作为捕捉剂来测量液相 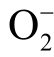 自由基的浓度,首先要将DEPMPO-OOH 的ESR 特征谱线与其他活性粒子的谱线区分出来,再利用标准曲线进一步计算被处理水溶液中
自由基的浓度,首先要将DEPMPO-OOH 的ESR 特征谱线与其他活性粒子的谱线区分出来,再利用标准曲线进一步计算被处理水溶液中 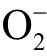 自由基的浓度。
自由基的浓度。
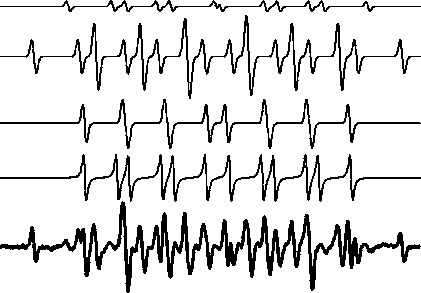
图7 DEPMPO 捕捉多种液相活性粒子的ESR 谱图Fig.7 Spectrum of DEPMPO reacting with different aqueous reactive species in ESR
3)DMPO 和CYPMPO
在液相OH 自由基的检测方法中提到,自旋捕捉剂DMPO 可以与液相 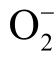 自由基发生反应,生成自旋加和物DMPO-OOH。该自旋加和物在ESR 谱图中显示为12 个连续峰。然而,捕捉剂DMPO 与液相
自由基发生反应,生成自旋加和物DMPO-OOH。该自旋加和物在ESR 谱图中显示为12 个连续峰。然而,捕捉剂DMPO 与液相 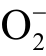 自由基的反应速率(小于102/(mol·L-1·s)远小于DMPO 与液相OH 自由基的反应速率(大于109/(mol·L-1·s))。同时,DMPO-OOH 并不稳定,会快速分解为DMPO-OH,使得通过捕捉剂DMPO 检测液相 2O−自由基比较困难[42]。DMPO 捕获 2O−自由基和OH 自由基及其转换关系如图8 所示[42]。
自由基的反应速率(小于102/(mol·L-1·s)远小于DMPO 与液相OH 自由基的反应速率(大于109/(mol·L-1·s))。同时,DMPO-OOH 并不稳定,会快速分解为DMPO-OH,使得通过捕捉剂DMPO 检测液相 2O−自由基比较困难[42]。DMPO 捕获 2O−自由基和OH 自由基及其转换关系如图8 所示[42]。
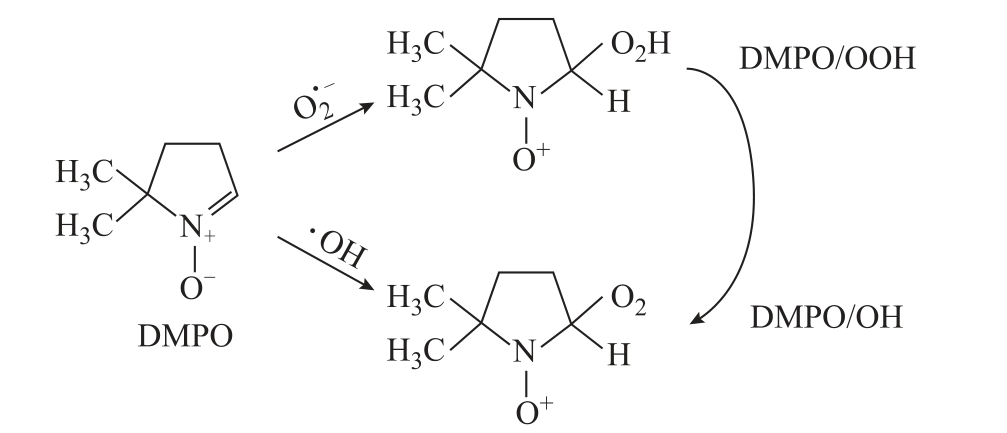
图8 DMPO 与液相 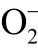 自由基和OH 自由基的反应
自由基和OH 自由基的反应
Fig.8 Reaction process between DMPO and aqueous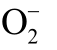 and OH
and OH
类似地,还有自旋捕捉剂CYPMPO,可以与液相 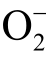 自由基和OH 自由基同时发生反应[19]。不同的是,CYPMPO 与液相
自由基和OH 自由基同时发生反应[19]。不同的是,CYPMPO 与液相 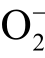 自由基反应的产物相对稳定。然而目前无法有效地将CYPMPO 与液相
自由基反应的产物相对稳定。然而目前无法有效地将CYPMPO 与液相 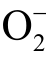 自由基和 OH 自由基反应产生的两种自旋加和物的ESR 谱线区分开,成为该方法的短板之一[102]。此外CYPMPO 试剂价格十分昂贵,也是其使用并不广泛的原因之一。
自由基和 OH 自由基反应产生的两种自旋加和物的ESR 谱线区分开,成为该方法的短板之一[102]。此外CYPMPO 试剂价格十分昂贵,也是其使用并不广泛的原因之一。
2.5.2 光化学荧光探针法
利用光化学荧光探针法检测液相 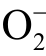 自由基时,常用的化学试剂有香草醛-8-氨基喹啉及其衍生物。
自由基时,常用的化学试剂有香草醛-8-氨基喹啉及其衍生物。
香草醛-8-氨基喹啉(VAQ)是一种人工合成的荧光探针,其最大激发和发射波长为 226nm 和307nm。VAQ 可以与液相 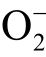 自由基发生反应,使得荧光强度减弱,利用对应波长处的荧光强度变化可以计算出液相
自由基发生反应,使得荧光强度减弱,利用对应波长处的荧光强度变化可以计算出液相  自由基的浓度变化。该荧光探针的最低检测限为20nmol/L,在液相
自由基的浓度变化。该荧光探针的最低检测限为20nmol/L,在液相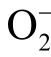 自由基的浓度不超过10μmol/L 时荧光强度与自由基浓度保持线性关系[103]。VAQ 并不能特异性检测
自由基的浓度不超过10μmol/L 时荧光强度与自由基浓度保持线性关系[103]。VAQ 并不能特异性检测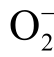 自由基,液相H2O2 粒子和OH 自由基都会对检测结果产生影响。
自由基,液相H2O2 粒子和OH 自由基都会对检测结果产生影响。
2-吡啶甲醛苯并噻唑啉是在VAQ 的基础上合成的一种新型荧光探针。该探针可以特异性与  自由基发生反应,H2O2 粒子和OH 自由基不会对检测结果产生影响。该方法也被称为
自由基发生反应,H2O2 粒子和OH 自由基不会对检测结果产生影响。该方法也被称为  自由基检测的流动注射-荧光法[104]。
自由基检测的流动注射-荧光法[104]。
2.6 一氧化氮(NO)
液相NO 自由基的化学性质十分活跃。研究发现,在生物体内存在少量NO 自由基且分布广泛,NO 自由基有扩张血管和增强记忆力的功能,也是帮助机体抵抗心血管疾病与其他疾病的信号分子,享有“明星分子”的美誉[105]。NO 自由基的半衰期约3~5s,会被迅速氧化成亚硝酸盐和硝酸盐[106]。目前液相NO 自由基常用的检测方法有电子自旋共振谱法、分光光度法、光化学荧光探针法等。
2.6.1 电子自旋共振谱法
利用电子自旋共振谱法检测液相NO 自由基时,常用的自旋捕捉剂有 DETC-Fe2+ 复合物、(MGD)2Fe2+复合物等。
1)甲苯二氨基甲酸乙酯铁复合物(DETC-Fe2+)
在等离子体处理前,将适量浓度的DETC(二乙基二硫代氨基甲酸钠)和FeSO4 溶液加入被处理水溶液,两者充分反应后生成DETC-Fe2+复合物。DETC-Fe2+可用于捕获水溶液中的NO 自由基,产生稳定的顺磁性单亚硝酰基-铁-二乙基二硫代氨基甲酸盐加合物(DETC)2-Fe2+-NO[107]。该加合物的ESR的谱线图如图9 所示[108]。
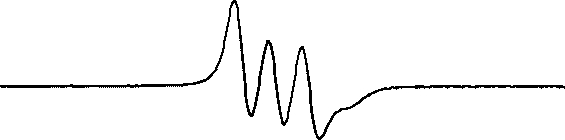
图9 络合物(DETC)2-Fe2+-NO 的ESR 谱图
Fig.9 Standard spectrum of (DETC)2-Fe2+-NO in ESR
利用DETC-Fe2+复合物检测液相NO 自由基浓度的检测限可达0.05nmol/L [108]。该方法不仅适用于水溶液,更常运用于细胞组织检测。由于细胞组织可以自身提供Fe2+粒子,测量前只需要与DETC 一起预孵育[109]。
2)N-甲基-D-葡糖胺二硫代氨基甲酸盐-亚铁(MGD)2Fe2+
在等离子体处理前,将适量浓度的MGD(高水溶性二硫代氨基甲酸酯类螯合剂)和FeSO4 溶液加入被处理液体,两者充分反应后生成复合物(MGD)2Fe2+。(MGD)2Fe2+可以与液相NO 自由基反应形成稳定的加和物 NO-Fe(MGD)2,反应速率为1.2×106/(mol·L-1·s)[45]。加和物NO-Fe(MGD)2 的ESR谱线为三线型,如图10 所示[110]。
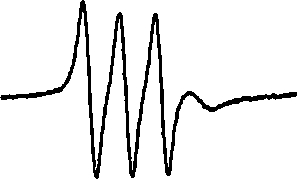
图10 NO-Fe(MGD)2 的ESR 谱线图
Fig.10 Standard spectrum of NO-Fe(MGD)2 in ESR
该方法同样适用于细胞组织等多种被处理液体检 测[111] 。 此 外 , 利 用 捕 捉 剂 DETC-Fe2+ 或(MGD)2Fe2+检测液相NO 自由基时都需要避免Fe2+被氧化。
2.6.2 分光光度法
利用分光光度法检测液相NO 自由基浓度时,N-乙酰半胱氨酸(NAC)是最常用的一种试剂。NAC与 NO 自由基反应生成硝基 N-乙酰半胱氨酸(NACNO)。NACNO 在波长334nm 处有强吸收峰,波长范围与一种稳定的荧光物质——硫酸奎宁的激发波长相重叠,两者同时存在时硫酸奎宁的荧光强度减弱。利用分光光度计检测波长334nm 处硫酸奎宁荧光强度的变化,结合标准曲线,就可以计算出液相NO 自由基的浓度变化[112]。
NAC 可以与NO 自由基特异性反应,最低检测限为10nmol/L。但需要注意的是,该反应需要在酸性条件下进行[113]。
2.6.3 光化学荧光探针法
DAF-FM 双乙酸盐是一种新型的可以定量检测NO 自由基的荧光探针。DAF-FM 本身仅有很弱的荧光,但与NO 自由基反应后产生强烈荧光,最大激发波长和发射波长分别为495nm 和515nm。
该方法检测灵敏度高,最低检测浓度可以达到3nmol/L。但该方法要求溶液的pH 较高,只能在pH高于5.5 的情况下进行测量,因此通常需要与磷酸盐缓冲液一起配合使用[114]。
2.7 亚硝酸根离子 和硝酸根离子
和硝酸根离子
液相  离子和
离子和  离子都属于长寿命活性粒子,与被处理水溶液的pH 值密切相关[115]。在等离子体的生物医学应用中,
离子都属于长寿命活性粒子,与被处理水溶液的pH 值密切相关[115]。在等离子体的生物医学应用中, 离子可以反应生成“明星分子”NO 自由基,其本身也能使血液中正常携氧的低铁血红蛋白氧化成高铁血红蛋白,失去携氧能力而引起组织缺氧[116]。
离子可以反应生成“明星分子”NO 自由基,其本身也能使血液中正常携氧的低铁血红蛋白氧化成高铁血红蛋白,失去携氧能力而引起组织缺氧[116]。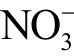 离子浓度过高则会导致人体中毒[117]。多数情况下两种离子同时存在于等离子体处理的水溶液中,且可以互相转换,因此检测通常也是同时进行。目前
离子浓度过高则会导致人体中毒[117]。多数情况下两种离子同时存在于等离子体处理的水溶液中,且可以互相转换,因此检测通常也是同时进行。目前  离子和
离子和 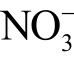 离子常用的检测方法有分光光度法、液相色谱法等。
离子常用的检测方法有分光光度法、液相色谱法等。
2.7.1 分光光度法
利用分光光度法检测液相  离子和
离子和 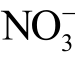 离子时,常用的化学试剂有Griess 试剂盒、盐酸萘乙二胺等。此外,根据液相
离子时,常用的化学试剂有Griess 试剂盒、盐酸萘乙二胺等。此外,根据液相  离子和
离子和 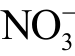 离子在波长209.8nm 处都有吸收峰,还可以利用紫外分光光度计直接检测该波长处的吸光度变化来确定活性粒子浓度。
离子在波长209.8nm 处都有吸收峰,还可以利用紫外分光光度计直接检测该波长处的吸光度变化来确定活性粒子浓度。
1)Griess 试剂盒
利用Griess 试剂盒来检测水溶液中  和
和 离子浓度是一种国标方法。Griess 试剂盒包含两种化学探针,分别为Griess R1(Sulfanilamide)和Griess R2(N-1-napthylethylenediamine dihydrochloride)。在测量液相
离子浓度是一种国标方法。Griess 试剂盒包含两种化学探针,分别为Griess R1(Sulfanilamide)和Griess R2(N-1-napthylethylenediamine dihydrochloride)。在测量液相 时,向等离子体处理后的水溶液中分别加入这两种探针,其与
时,向等离子体处理后的水溶液中分别加入这两种探针,其与 离子发生计量比1:1 的反应生成紫色的含氮化合物Azo Compound。该产物在波长为540nm 处有最大吸收峰,结合标准曲线即可计算出
离子发生计量比1:1 的反应生成紫色的含氮化合物Azo Compound。该产物在波长为540nm 处有最大吸收峰,结合标准曲线即可计算出 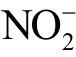 离子绝对浓度。Griess 试剂与
离子绝对浓度。Griess 试剂与 离子反应过程如图11 所示[60]。
离子反应过程如图11 所示[60]。
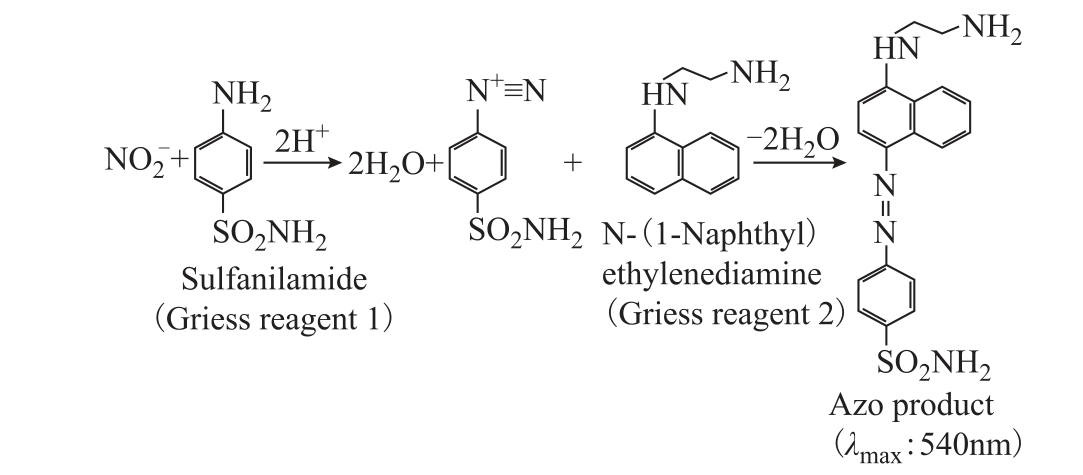
图11 Griess 试剂测量液相 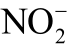 的反应过程
的反应过程
Fig.11 Reaction process between Griess regent and aqueous 
液相 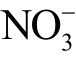 不与Griess 试剂反应,需要额外添加硝酸盐还原酶NADPH,NADPH 将液相
不与Griess 试剂反应,需要额外添加硝酸盐还原酶NADPH,NADPH 将液相 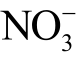 离子还原为
离子还原为 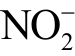 离子,然后再依次加入Griess 试剂进行检测[118]。加入还原酶后的检测结果是溶液中
离子,然后再依次加入Griess 试剂进行检测[118]。加入还原酶后的检测结果是溶液中  与
与 离子浓度之和,减去液相
离子浓度之和,减去液相 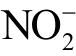 离子浓度即可得到液相
离子浓度即可得到液相 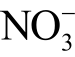 离子浓度。
离子浓度。
需要注意的是,利用Griess 试剂检测液相  离子和
离子和 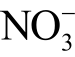 离子缺乏实时性,检测过程中需要避光孵育1h,同时检测需在酶标仪中进行。
离子缺乏实时性,检测过程中需要避光孵育1h,同时检测需在酶标仪中进行。
2)盐酸萘乙二胺(C10H7NH(CH2)2NH2·2HCl)法
盐酸萘乙二胺是检测液相 2NO−离子浓度的一种常用试剂。在检测体系中,盐酸萘乙二胺和对氨基苯磺酸(NH2C6H4SO3H)配合使用。液相 2NO−离子首先与对氨基苯磺酸反应生成重氮盐,再与盐酸萘乙二胺偶联生成红色偶氮染料。该偶氮染料在波长540nm 处有最大吸收峰,利用分光光度计测量对应波长处的吸光度变化,可计算得到溶液中 2NO−离子的浓度[119]。
利用该方法检测液相 2NO−离子时,需提前利用盐酸对待测水溶液进行酸化,使溶液pH 值在2.0 左右。该方法的检测限为8.0nmol/L [120]。此外,有文献报道也可以使用硫酸进行酸化,检测波长为525nm[121]。
3)紫外分光光度法直接检测
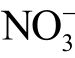 离子和
离子和 离子在紫外波段都具有较强的吸光度,文献报道在波长209.8nm 处的吸光度计算公式为该式在任意比例的 3NO−离子和 2NO−离子浓度下都成立[122]。因此可以利用紫外分光光度计直接测量被处理水溶液在波长209.8nm 处的吸光度变化,来确定 3NO−离子和 2NO−离子的总浓度。
离子在紫外波段都具有较强的吸光度,文献报道在波长209.8nm 处的吸光度计算公式为该式在任意比例的 3NO−离子和 2NO−离子浓度下都成立[122]。因此可以利用紫外分光光度计直接测量被处理水溶液在波长209.8nm 处的吸光度变化,来确定 3NO−离子和 2NO−离子的总浓度。
值得一提的是,这种方法可以在线检测等离子体处理过程中 2NO−和 3NO−的时空分布。J. S. Oh 等提出了利用该方法在线检测水溶液中的 2NO−和 3NO−,被认为是首次探究等离子体处理水溶液过程中长寿命ROS 和RNS 时空分布的工作[123]。该实验利用等离子体射流直接处理盛放于石英比色皿中的去离子水,以Beer-Lambert 定律为基础设计了一个拟合程序对UV光谱进行曲线拟合,实时检测比色皿各位置处的吸收光谱,快速测量被处理水溶液中 2NO−和 3NO−的浓度。根据J. S. Oh 等的报道,等离子体射流处理水溶液产生的液相ROS 和RNS 的吸收光谱低于300nm(在UV范围内),在可见光和近红外范围(400~900nm)内没有吸收峰[124]。此外,该方法对温度很敏感。
2.7.2 液相色谱法
水溶液中的 2NO−离子可以与 2,4-二硝基苯肼(2,4-DNPH)通过衍生化反应生成一种稳定的叠氮化合物,该化合物可以进行色谱检测。这种分析方法反应迅速,检测限为0.1nmol/L,有效的检测浓度范围为0.5~1000nmol/L [125]。
此外,被处理水溶液中 2NO−和 3NO−离子浓度还可以通过离子色谱法直接检测。待测水溶液注入淋洗液(碳酸盐-碳酸氢盐溶液)并流经分离柱(低容量强碱性阴离子树脂), 2NO−和 3NO−等阴离子因对分离柱的相对亲和力不同而彼此分开。被分离的阴离子,在流经抑制柱(强酸性阳离子树脂)时,被转换为高电导的酸型,碳酸盐-碳酸氢盐则转变为弱电导的碳酸(清除背景电导)。用电导检测器测量被转变为相应酸型的阴离子,结合标准谱图定性或定量计算活性粒子浓度[126]。
利用离子色谱法检测时,待测离子浓度差异不能太大,最好在同一数量级[127]。
2.8 过氧亚硝酸(ONOOH)和过氧亚硝酸根离子(ONOO-)
液相ONOO-离子性质活泼,氧化性强,能与许多生物分子如酯类、蛋白质、糖类反应,并且与许多人体疾病的发病机理有关,是等离子体生物医学应用中研究较多的活性粒子之一[22-23]。液相ONOO-离子可以通过NO 自由基和 2O−自由基1:1 反应形成,反应速率约为6.7×109/(mol·L-1·s)[128]。ONOO-离子比 2O−自由基、NO 自由基具有更强的反应活性和细胞毒性[129]。液相ONOO-离子还可以与H+粒子反应生成ONOOH,但ONOOH 在生理条件下的半衰期仅为1s 左右。目前等离子体处理水溶液中液相ONOOH 粒子和ONOO-离子常用的检测方法是光化学荧光探针法。
利用光化学荧光探针法检测液相 ONOO-/ONOOH 粒子浓度时,常用的化学试剂有2,7-二氢二氯荧光素、二氢罗丹明、香豆素硼酸、叶酸等。
1)2,7-二氢二氯荧光素(DCFH)
DCFH 是一种还原型的荧光素,液相ONOO-/ONOOH 粒子可以将其氧化成氧化型二氯荧光素(DCF)[130]。DCF 为强荧光物质,最大激发和发射波长分别位于498nm 和525nm。该方法的检测限度为 50nmol/L。但是该方法并不能特异性检测液相ONOO-/ONOOH 粒子,DCFH 荧光素也会与液相OH自由基等ROS 发生反应[131]。
2)二氢罗丹明(DHR)
DHR 也是检测液相ONOO-/ONOOH 粒子常用的一种荧光素。ONOO-/ONOOH 粒子可以将DHR氧化成罗丹明(RH-123)[132]。罗丹明作为一种强荧光物质,其最大激发和发射波长位于 505nm 和529nm[133]。但该方法同样不能特异性检测液相ONOO-/ONOOH 粒子,会受到水溶液中其他ROS的影响。
3)香豆素硼酸(CBA)
香豆素硼酸(CBA)也是一种荧光探针,可与ONOO-/ONOOH、H2O2 和HClO 等粒子反应。生成物是一种强荧光物质,其最大激发和发射波长分别为332nm 和420nm[134]。如果实验体系中不含有氯元素,则荧光强度只反映H2O2 和ONOO-/ONOOH粒子的浓度[135]。同时,有文献报道,CBA 与ONOO-离子的反应速率约为1.1×106/(mol·L-1·s),高出其与H2O2 反应速率约6 个数量级[136]。因此,在不含次氯酸的环境下,CBA 对ONOO-/ONOOH 粒子具有较强的特异性。
4)叶酸(Folic acid)
叶酸是一种水溶性维生素,与人体健康密切相关,同时可用于检测液相ONOO-/ONOOH 粒子。叶酸自身荧光强度很弱,但与液相ONOO-/ONOOH 粒子反应生成一种强荧光物质,其最大激发和发射波长分别为380nm 和460nm[137]。生成物荧光强度与液相ONOO-/ONOOH 浓度在粒子浓度小于5μmol/L时有良好的线性关系[138]。但叶酸的检测同样没有特异性,液相H2O2 等氧化性ROS 也会和叶酸反应。
2.9 过氧硝酸粒子(O2NOOH)
过氧硝酸(O2NOOH)是一种含有氢过氧化物基团的过酸[139]。在冷等离子体的生物医学应用中,液相O2NOOH 粒子被认为在细菌灭活过程中发挥着重要作用[98]。O2NOOH 粒子化学性质很不稳定,在水溶液中可通过一级反应分解为亚硝酸和氧气。P. A. Kenley 和 J. M. Régimbal 等研究发现液相O2NOOH 粒子分解速度与温度和pH 值密切相关,温度和pH 越低液相O2NOOH 粒子的半衰期越长。例如,在室温及pH=3.0 的情况下O2NOOH 粒子的半衰期约为30s,而在冰水混合物及pH=1.8 的情况下其半衰期约为20min[140-141]。
目前液相O2NOOH 粒子常用的检测方法是液相离子交换色谱法。文献报道针对过氧化氢与硝酸溶液混合产生的液相O2NOOH,可利用离子交换色谱法在低温和低pH 下测量其浓度[142-143]。但这种检测方法的灵敏度不高,且由于O2NOOH 粒子的不稳定性,采用该方法尚未检测到等离子体处理水溶液中的液相O2NOOH[19]。
2.10 氢原子(H)
工作气体中少量水蒸气的掺杂或者被处理水溶液的蒸发,都会使等离子体处理水溶液时产生H 原子[144]。H 原子并不能孤立存在,会迅速与其他原子结合,因此其活性极高、猝灭时间极短。在等离子体处理水溶液过程中,液相H 原子可以与O-、O3、HO2、NO2 等多个粒子反应,其反应速率均在1010/(mol·L-1·s)量级[18]。H 原子有三种同位素:氕(P)、氘(D)、氚(T),常被用于同位素标记来研究复杂体系中H 原子的来源、去向及化学反应。由于液相H 原子寿命极短,目前最常用的检测方法是电子自旋共振谱法。
2.10.1 电子自旋共振谱法
利用电子自旋共振谱法检测液相H 原子时,常用的自旋捕捉剂有PBN、DMPO 等。
1)N-tert-butyl-α-phenylnitrone (PBN)
PBN 是检测液相H 原子最常用的自旋捕捉剂之一,它可以特异性地与H 原子反应生成自旋加和物PBN-H,避免了液相OH 自由基等活性粒子的影响。PBN-H 的ESR 图谱如图12 所示[45]。
图12 PBN-H 的ESR 标准谱图
Fig.12 Standard spectrum of PBN-H in ESR
利用PBN 检测液相H 原子浓度有两点需要注意:①虽然捕捉剂PBN 可以与H 原子特异性反应,但生成的加和物PBN-H 并不太稳定,在等离子体的处理下会发生衰减。因此在测量时要确保捕捉剂PBN 的浓度足够大(通常使用100mmol/L)[145];②对于H 原子的不同同位素,加和物PBN-H 和PBN-D 的ESR 谱线是不同的,利用同位素标记法可对等离子体产生的液相H 原子追本溯源[45]。
2)5,5-dimethyl-1-pyrrolineN-oxide(DMPO)
在液相OH 自由基的检测方法中提到,自旋捕捉剂DMPO 可以与液相H 原子反应生成稳定的自旋加和物DMPO-H[146]。因此在等离子体处理水溶液体系,自旋捕捉剂DMPO 的检测结果通常是两种自旋加和物DMPO-H 和DMPO-OH 的谱线叠加,如图13 所示[45]。需要先将两种特征谱线分离,再利用标准曲线计算H 原子的绝对浓度。
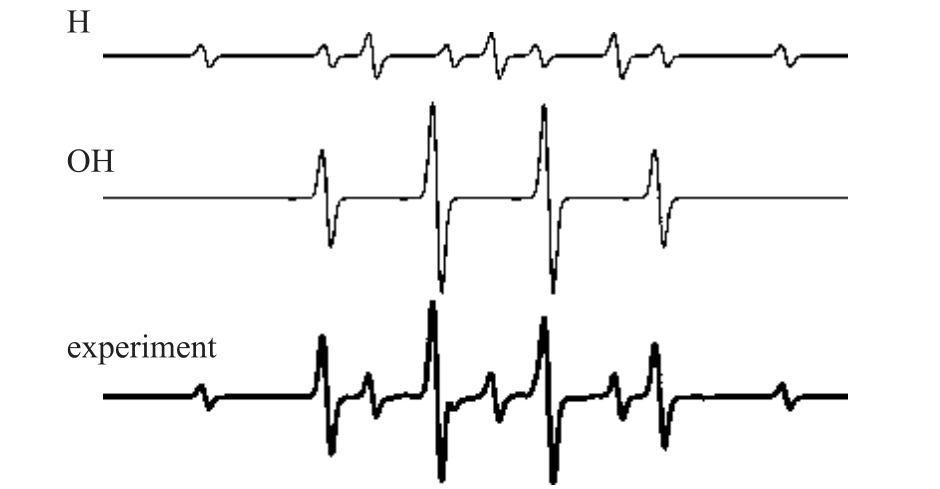
图13 DMPO-H 与DMPO-OH 的ESR 标准谱图
Fig.13 Standard spectrum of DMPO-H and DMPO-OH in ESR
2.10.2 同位素标记法
由于H 原子三种同位素的存在,利用核磁共振氢谱(1H-NMR)可以探究等离子体处理水溶液时液相H 原子的来源、分布及化学反应。如Y. Gorbanev等通过将重水(D2O)蒸汽掺杂进He 等离子体射流中来处理水(H2O),或者将水蒸气掺杂进He 等离子体射流中处理重水,来探究等离子体射流处理水溶液的过程中液相H 原子的来源[147]。
3 检测方法的共性问题
针对大气压冷等离子体处理水溶液,第2 节综述了11 种液相活性粒子的检测方法,这些检测方法及其注意事项归纳到表2 中,便于读者查阅。其中,由于硝酸根( 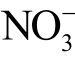 )和亚硝酸根(
)和亚硝酸根(  )离子的检测方法接近,且这两种离子在等离子体处理水溶液中共生,所以在表中合并到一起介绍。整体来说,目前的液相活性粒子检测方法存在如下几点共性问题:
)离子的检测方法接近,且这两种离子在等离子体处理水溶液中共生,所以在表中合并到一起介绍。整体来说,目前的液相活性粒子检测方法存在如下几点共性问题:
1)可测粒子少。根据文献报道,等离子体处理水溶液产生的常见液相活性粒子大约有30 余种,但有明确检测方法的大约只有10 余种。例如液相O原子被认为在等离子体化学应用中发挥着重要作用[148],但目前仍缺乏有效的检测手段。
2)特异性差。目前能特异性测量某种液相活性粒子浓度的方法很少,特别是短寿命活性粒子的测量。例如,自旋捕捉剂DMPO 常用于检测等离子体产生的液相OH 自由基的浓度,但DMPO 并不能特异性地与液相OH 自由基反应,水溶液中的其他活性粒子,如OH 自由基、H 原子、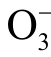 粒子都会干扰实验结果。
粒子都会干扰实验结果。
3)精准定量困难。无论是向被处理水溶液加入光化学探针还是自旋捕捉剂,都会或多或少影响液相活性粒子自身的化学反应体系,影响活性粒子浓度的精准定量。某些检测试剂需要在特定pH 值范围内发挥作用,甚至难溶于水,如对苯二甲酸试剂只能在碱性环境下溶解检测液相 OH 自由基的浓度、荧光探针DPA 只能溶解于有机溶剂后再检测液相 1O2 自由基的浓度,而测量环境的变化都会影响测量结果的准确性。此外,利用电子自旋共振谱法检测液相短寿命活性粒子浓度时,提前加入自旋捕捉剂还会出现累积效应,使得测量结果甚至比实际值高出几个数量级。
4)在线检测困难。目前液相活性粒子检测方法多属于离线检测,实现在线检测比较困难。虽然有报道利用分光光度法在线检测H2O2、 和
和 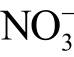 三种液相长寿命活性粒子的浓度变化,但处理只能在特定的石英比色皿中进行,局限性较大[123]。此外,如何实现液相短寿命活性粒子的在线检测也是未来需要解决的关键问题。
三种液相长寿命活性粒子的浓度变化,但处理只能在特定的石英比色皿中进行,局限性较大[123]。此外,如何实现液相短寿命活性粒子的在线检测也是未来需要解决的关键问题。
5)空间分辨困难。目前的检测技术还多是停留在被处理水溶液中液相活性粒子种类的定性分析以及其平均浓度的定量测量,很难实现活性粒子浓度的空间分辨测量,这就使得应用中需要的某些关键参数缺乏,例如:活性粒子对水溶液的渗透深度。
表2 液相活性粒子及其检测方法归纳
Tab.2 Classification of detection methods for aqueous reactive species

?
4 结论
近年来,大气压冷等离子体凭借在生物医学、材料处理、环境保护等领域展现出的良好应用潜力,受到了广泛关注。研究结果表明,冷等离子体产生的液相活性粒子在诸多应用中发挥着关键作用。液相活性粒子的测量是研究活性粒子生成去除机制、实现活性粒子有效调控的基础。本文整理归纳了近年来国内外检测液相活性粒子的常用实验方法,并对11 种主要的活性氧、活性氮粒子以及氢粒子的检测方法做了详细介绍。
大气压冷等离子体与被处理水溶液相互作用的研究处于攻坚阶段,众多液相活性粒子的检测方法尚不完善,很难实现特异性精准测量。不过随着科学技术的进步,越来越多先进的液相分析手段得以应用,液相活性粒子的检测研究工作呈现出从宏观到微观、从离线到在线、从定性到定量再到空间分辨的发展趋势。更多特异性强、准确度高、适应性强的检测试剂和检测方法应运而生,相信能有效地促进大气压冷等离子体技术的应用发展。
[1] Guo Li, Li Heping, Wang Liyan, et al . Genetic effects of radio-frequency, atmospheric-pressure glow discharges with helium[J]. Applied Physics Letters,2008, 92(22): 221504.
[2] Kong M G, Kroesen G, Morfill G, et al. Plasma medicine: an introductory review[J]. New Journal of Physics, 2009, 11(11): 115012.
[3] 熊紫兰, 卢新培, 曹颖光. 等离子体医学[J]. 中国科学, 2011, 41(10): 1279-1298.Xiong Zilan, Lu Xinpei, Cao Yingguang. Plasma medicine[J]. Scientia Sinica(Technological), 2011,41(10): 1279-1298.
[4] 丁正方, 方志, 许靖. 四氟化碳含量对大气压Ar 等离子体射流放电特性的影响[J]. 电工技术学报,2016, 31(7): 159-165.Ding Zhengfang, Fang Zhi, Xu Jing. Influences of CF4 content on discharge characteristics of argon plasma jet under atmospheric pressure[J]. Transactions of China Electrotechnical Society, 2016, 31(7): 159-165.
[5] 张凯, 王瑞雪, 韩伟, 等. 等离子体重油加工技术研究进展[J]. 电工技术学报, 2016, 31(24): 1-15.Zhang Kai, Wang Ruixue, Han Wei, et al. Progress of heavy oil processing by plasma technology[J].Transactions of China Electrotechnical Society, 2016,31(24): 1-15.
[6] 张晓星, 肖焓艳, 黄杨珏. 低温等离子体处理 SF6废气综述[J]. 电工技术学报, 2016, 31(24): 16-24.Zhang Xiaoxing, Xiao Hanyan, Huang Yangjue. A review of degradation of SF6 waste by low temperature plasma[J]. Transactions of China Electrotechnical Society, 2016, 31(24): 16-24.
[7] 肖雄, 王建国, 吴照国, 等. 等离子体作用后硅橡胶憎水性恢复及憎水迁移特性研究[J]. 电工技术学报, 2019, 34(增刊1): 433-439.Xiao Xiong, Wu Jianguo, Wu Zhaoguo, et al. Study on hydrophobicity recovery and hydrophobicity transfer of plasma treated silicone rubber[J]. Transactions of China Electrotechnical Society, 2019, 34(S1): 433-439.
[8] Bogle M A, Arndt K A, Dover J S. Evaluation of plasma skin regeneration technology in low-energy full-facial rejuvenation[J]. Archives of Dermatology,2007, 143(2): 168-174.
[9] von Woedtke T, Reuter S, Masur K, et al. Plasmas for medicine[J]. Physics Report, 2013, 530: 291-320.
[10] Portrait(R) plasma receives clearance from the FDA to treat acne scars, http://www.medicalnewstoday.com/articles/102627.php.
[11] Terraplasma medical gets CE mark approval for European market, https://www.space-of-innovation.com/category/news/.
[12] 李和平, 于达仁, 孙文延, 等. 大气压放电等离子体研究进展综述[J]. 高电压技术, 2016, 42(12):3697-3727.Li Heping, Yu Daren, Sun Wenyan, et al. State-of-theart of atmospheric discharge plasmas[J]. High Voltage Engineering, 2016, 42(12): 3697-3727.
[13] 任富强, 汲胜昌, 祝令瑜, 等. 基于同轴直管和倒置锥形管的氩大气压等离子体射流放电形态的实验和仿真[J] 电工技术学报, 2017, 32(8): 95-102.Ren Fuqiang, Ji Shengchang, Zhu Lingyu, et al.Experiment and simulation on the discharge modality of atmospheric pressure plasma jets in argon based on coaxial straight tube and inverted tapered tube[J].Transactions of China Electrotechnical Society, 2017,32(8): 95-102.
[14] 戴栋, 宁文军, 邵涛. 大气压低温等离子体的研究现状与发展趋势[J]. 电工技术学报, 2017, 30(20): 1-9.Dai Dong, Ni Wenjun, Shao Tao. A review on the state of art and future trends of atmospheric pressure low temperature plasmas[J]. Transactions of China Electrotechnical Society, 2017, 30(20): 1-9.
[15] 章程, 邵涛, 龙凯华, 等. 大气压空气中纳秒脉冲介质阻挡放电均匀性的研究[J]. 电工技术学报,2010, 25(1): 30-36.Zhang Cheng, Shao Tao, Long Kaihua, et al. Uniform of unipolar nanosecond pulse DBD in atmospheric air[J]. Transactions of China Electrotechnical Society,2010, 25(1): 30-36.
[16] 荣命哲, 刘定新, 李美, 等. 非平衡态等离子体的仿真研究现状与新进展[J]. 电工技术学报, 2014,29(6): 271-282.Rong Mingzhe, Liu Dingxin, Li Mei, et al. Research status and new progress on the numerical simulation of non-equilibrium plasmas[J]. Transactions of China Electrotechnical Society, 2014, 29(6): 271-282.
[17] Nathan C, Ding A. Nonresolving inflammation[J].Cell, 2010, 140(6):871-882.
[18] Xu Dehui, Liu Dingxin, Wang Biqing, et al. In situ OH generation from O2− and H2O2 plays a critical role in plasma-induced cell death[J]. Plos One, 2015, 10(6):e0128205.
[19] Ikawa S, Tani A, Nakashima Y, et al. Physicochemical properties of bactericidal plasma-treated water[J].Journal of Physics D: Applied Physics, 2016, 49(42):425401.
[20] Dedon P C, Tannenbaum S R. Reactive nitrogen species in the chemical biology of inflammation[J].Archives of Biochemistry and Biophysics, 2004,423(1): 12-22.
[21] Pacher P, Beckman J S, Liaudet L. Nitric oxide and peroxynitrite in health and disease[J]. Physiological Reviews, 2007, 87(1): 315-424.
[22] 方允中, 郑荣梁, 沈文梅. 自由基生命科学进展[M]. 北京: 原子能出版社, 1994.
[23] Ischiropoulos H. Biological tyrosine nitration: A pathophysiological function of nitric oxide and reactive oxygen species[J]. Archives of Biochemistry and Biophysics, 1998, 356(1): 1-11.
[24] Liu Z C, Liu D X, Chen C, et al. Physicochemical processes in the indirect interaction between surface air plasma and deionized water[J]. Journal of Physics D: Applied Physics, 2015, 48(49): 495201.
[25] Sakiyama Y, Graves D B, Chang H W, et al. Plasma chemistry model of surface microdischarge in humid air and dynamics of reactive neutral species[J].Journal of Physics D: Applied Physics, 2012, 45(42):425201.
[26] Sun Yi, Yu Shuang, Sun Peng, et al. Inactivation of candida biofilms by non-thermal plasma and its enhancement for fungistatic effect of antifungal drugs[J]. Plos One, 2012, 7(7): e40629.
[27] Traylor M J, Pavlovich M J, Karim S, et al. Long-term antibacterial efficacy of air plasma activated water[J].Journal of Physics D: Applied Physics, 2011, 44(47):472001.
[28] Halliwell B, Gutteridge J M C. Free radicals in biology and medicine[M]. New York: Oxford University Press,2007.
[29] Atkins P, Paula J D. Physical chemistry for the life sciences[M]. New York: Oxford University Press,2006.
[30] 彭崇慧, 冯建章, 张锡瑜. 定量化学分析简明教程[M].北京: 北京大学出版社, 1985.
[31] Yue Y F, Mohades S, Laroussi M, et al. Measurements of plasma-generated hydroxyl and hydrogen peroxide concentrations for plasma medicine applications[J].IEEE Transactions on Plasma Science, 2016, 44(11):2754-2758.
[32] 金朝晖. 环境检测[M]. 天津: 天津大学出版社,2007.
[33] Ninfa A J, David P B, Marilee B. Fundamental laboratory approaches for biochemistry and biotechnology[M]. Hoboken, NJ: John Wiley, 2009.
[34] 赵保路. 电子自旋共振(ESR)技术在生物和医学中的应用[J]. 波谱学杂志, 2010, 27(1): 51-67.Zhao Baolu. Application of electron spin resonance(ESR) technology in biology and medicine[J]. Journal of Spectroscopy, 2010, 27(1): 51-67.
[35] Fernandez M J F, Sato H. Solvent effect on (2,2,6,6-tetramethy lpiperidine-1-yl)oxyl (TEMPO): a RISMSCF-SEDD study[J]. Theoretical Chemistry Account,2011, 130(2-3): 299-304.
[36] Swarzenski P W, Reich C, et al. Ra and Rn isotopes as natural tracers of submarine groundwater discharge in Tampa Bay, Florida[J]. Marine Chemistry, 2007,104(1-2): 69-84.
[37] Marsh K L, Sims G K, Mulvaney R L. Availability of urea to autotrophic ammonia-oxidizing bacteria as related to the fate of 14C- and 15N-labeled urea added to soil[J]. Biology and Fertility of Soils, 2005, 42:137-145.
[38] Schiorlin M, Marotta E, et al. Determination of atomic oxygen in atmospheric plasma from oxygen isotope exchange[J]. Plasma Process and Polym, 2011, 8(9):859-866.
[39] Gołkowski M, Gołkowski C, Leszczynski J, et al.Hydrogen peroxide enhanced nonthermal plasma effluent for biomedical applications[J]. IEEE Transactions on Plasma Science, 2012, 40(8): 1984-1991.
[40] Sies H. Strategies of antioxidant defense[J]. European Journal of Biochemistry, 1993, 215(2): 213-219.
[41] Yoo D H, Han S K, Lee M J, et al. J. Spin trapping EPR method for simultaneous monitoring of Hydroxyl radicals and Hydrogen atoms in γ-irradiation process[J]. Journal of Industrial and Engineering Chemistry, 2005, 11(2): 215-221.
[42] Tresp H, Hammer M U, Winter J, et al. Quantitative detection of plasma-generated free radicals in liquids by electron paramagnetic resonance spectroscopy[J].Journal of Physics D: Applied Physics, 2013, 46(43):435401.
[43] Teda M, Kohno M, Kasai S, et al. Generation mechanism of radical species by tyrosine-tyrosinase reaction[J]. Journal of Clinical Biochemistry and Nutrition, 2010, 47(2): 162-166.
[44] Horikosh S, Wada Y, Watanabe N, et al. Nearquantitative mineralization of two refractory triazines under hydrothermal-supercritical aqueous conditions assisted by ozone and UV/ozone[J]. New Journal of Chemistry, 2003, 8: 1216-1223.
[45] Gorbanev Y, Connell D O, Chechik V. Non-thermal plasma in contact with water: the origin of species[J].Chemistry, 2016, 22(10): 3496-3505.
[46] Tani A, Ono Y, Fukui S, et al. Free radicals induced in aqueous solution by non-contact atmosphericpressure cold plasma[J]. Applied Physics Letters,2012, 100(25): 254103.
[47] Kamibayashi M, Oowada S, Kameda H, et al.Synthesis and characterization of a practically better DEPMPO-type spin trap, 5-(2,2-dimethyl-1,3-propoxy cyclophosphoryl)-5-methyl-1-pyrroline N-oxide (CYPMPO)[J]. Free Radical Research, 2006,40(11): 1166-1172.
[48] Shiraki D, Ishibashi N, Takeuchi N. Quantitative estimation of OH radicals reacting in liquid using a chemical probe for plasma in contact with liquid[J].IEEE Transactions on Plasma Science, 2016, 44(12):3158-3163.
[49] Li S, Timoshkin I V, Maclean M, et al. Fluorescence detection of hydroxyl radicals in water produced by atmospheric pulsed discharges[J]. IEEE Transaction on Dielectrics and Electrical Insulation, 2015, 22(4):1856-1865.
[50] Takeuchi N. Generation mechanism of hydrogen peroxide in DC plasma with a liquid electrode[J].Plasma Sources Science and Technology, 2018, 27(4):45010.
[51] 任瑞妮, 付柯, 冯巩, 等. 分光光度法测定羟基自由基捕获剂的研究进展[J]. 安徽化工, 2014, 40(3):19-21.Ren Ruini, Fu Ke, Feng Gong, et al. Research progress of spectrophotometric method to determine the hydroxyl free radical scavenger[J]. Anhui Chemical Industry, 2014, 40(3): 19-21.
[52] Satoh A Y, Trosko J E, Masten S J. Methylene blue dyetest for rapid qualitative detection of hydroxyl radicals formed in a Fenton’s reaction aqueous solution[J]. Environmental Science & Technology,2007, 41(8): 2881-2887.
[53] 王金刚, 王西奎, 国伟林, 等. 亚甲蓝光度法测定羟自由基[J]. 理化检验-化学分册, 2007, 43(6): 495-497.Wang Jingang, Wang Xikui, Guo Weilin, et al.Photometric determination of hydroxyl free radical by its reaction with methylene blue[J]. Phgsical and Chemical Examination-Chemical Section, 2007, 43(6):495-497.
[54] Lee H W, Lee H W, Kang S K, et al. Synergistic sterilization effect of microwave-excited nonthermal Ar plasma, H2O2, H2O and TiO2, and a global modeling of the interactions[J]. Plasma Sources Science and Technology, 2013, 22(5): 055008.
[55] Kishore K, Guha S N, Mahadevan J, et al. Redox reactions of methylene blue: a pulse radiolysis study[J].International Journal of Radiation Applications and Instrumentation, Part C: Radiation Physics and Chemistry, 1989, 34(4): 721-727.
[56] Chen Chen, Liu Dinxin, Yang Aijun, et al. Aqueous reactive oxygen species induced by He+O2 plasmas:chemistry pathways and dosage control approaches[J].Plasma Chemistry and Plasma Processing, 2018, 38(1):89-105.
[57] Zhang Qian, Liang Yongdong, Feng Hongqing, et al.A study of oxidative stress induced by non-thermal plasma-activated water for bacterial damage[J].Applied Physics Letters, 2013, 102: 203701.
[58] Falagas M E, Thomaidis P C, Kotsantis I K, et al.Airborne hydrogen peroxide for disinfection of the hospital environment and infection control: a systematic review[J]. Journal of Hospital Infection,2011, 78(3): 171-177.
[59] Lukes P, Dolezalova E, Sisrova I, et al. Aqueousphase chemistry and bactericidal effects from an air discharge plasma in contact with water: evidence for the formation of peroxynitrite through a pseudosecond-order post-discharge reaction of H2O2 and HNO2[J]. Plasma Sources Science and Technology,2014, 23(1): 015019.
[60] Oehmigen K, Winter J, Hahnel M, et al. Estimation of possible mechanisms of escherichia coli inactivation by plasma treated sodium chloride solution[J]. Plasma Processes and Polymers, 2011, 8(10): 904-913.
[61] Jablonowski H, Hänsch M A C, Dünnbier M, et al.Plasma jet’s shielding gas impact on bacterial inactivation[J]. Biointerphases, 2015, 10(2): 29506.
[62] 刘海英, 俎爱忠, 陈建保, 等. HRP-H2O2-OPDA 化学发光酶联免疫分析检测马铃薯重花叶病毒[J].食品安全导刊, 2017, 09X: 149-150.Liu Haiying, Yan Aizhong, Chen Jianbao, et al.Detection of potato heavy mosaic virus by HRP-H2O2-OPDA chemiluminescence enzyme-linked immunosorbent assay[J]. Food Safety Guide, 2017, 09X: 149-150.
[63] Bystryak S M, Mekler V M. Photochemical amplification for horseradish peroxidase-mediated immunosorbent assay[J]. Analytical Biochemistry,1992, 202(2): 390-393.
[64] Szili E J, Bradley J W, Short R D. A ‘tissue model’ to study the plasma delivery of reactive oxygen species[J]. Journal of Physics D: Applied Physics,2014, 47(15): 152002.
[65] Nogueira R F P, Oliveira M C, Paterlini W C. Simple and fast spectrophotometric determination of H2O2 in photo-Fenton reactions using metavanadate[J].Talanta, 2005, 66(1): 86-91.
[66] Vasko C A, Liu D X, Van Veldhuizen E M, et al.Hydrogen peroxide production in an atmospheric pressure RF glow discharge: comparison of models and experiments[J]. Plasma Chemistry and Plasma Processing, 2014, 34(5): 1081-1099.
[67] Liu Dingxin, Liu Z C, Chen C, et al. Aqueous reactive species induced by a surface air discharge:heterogeneous mass transfer and liquid chemistry pathways[J]. Scientific Reports, 2016, 6: 23737.
[68] Winter J, Ttesp H, Hammer H U, et al. Tracking plasma generated H2O2 from gas into liquid phase and revealing its dominant impact on human skin cells[J].Journal of Physics D: Applied Physics, 2014, 47(28):285401.
[69] Saeki R, Yasuoka K. Generation of hydrogen peroxide in gas bubbles using pulsed plasma for advanced oxidation process[J]. IEEE Transactions on Plasma Science, 2015, 43(10): 3440-3444.
[70] Takeuchi N, Ishii Y, Yasuoka K. Modelling chemical reactions in DC plasma inside oxygen bubbles in water[J]. Plasma Sources Science and Technology,2012, 21(1): 015006.
[71] Rumbach P, Go D B. Perspectives on plasmas in contact with liquids for chemical processing and materials synthesis[J]. Topics in Catalysis, 2017,60(12-14), 799-811.
[72] He Zhengguang, Liu Junshen, Cai Weimin. The important role of the hydroxy ion in phenol removal using pulsed corona discharge[J]. Journal of Electrostatics, 2005, 63(5): 371-386.
[73] Grinevich V I. Kinetics of ozone formation in the gas and liquid phases in a barrier-discharge plasma[J].Theoretical Foundations of Chemical Engineering,2004, 38(1): 56-60.
[74] Bader H, Hoigne J. Determination of ozone in water by the indigo method[J]. Water Research, 1981, 15(4):449-456.
[75] Pavlovich M J, Chang H W, Sakiyama Y, et al. Ozone correlates with antibacterial effects from indirect air dielectric barrier discharge treatment of water[J].Journal of Physics D: Applied Physics, 2013, 46(14):145202.
[76] Leslie A K, Li D, Koide K. Amine-promoted βelimination of a β-aryloxy aldehyde for fluorogenic chemodosimeters[J]. The Journal of Organic Chemistry, 2011, 76(16): 6860-6865.
[77] Wright A, Fuster J, Shaw A, et al. Quantification of the ozone dose delivered into a liquid by indirect plasma treatments: method and calibration of the Pittsburgh Green fluorescence probe[J]. Plasma Chemistry and Plasma Processing, 2018, 38(6): 1169-1179.
[78] Garner A L, St Croix C M, Pitt B R, et al. Specific fluorogenic probes for ozone in biological and atmospheric samples[J]. Nature Chemistry, 2009, 1(4):316-321.
[79] Beltrán C C, Palmer E A, Buckley B R, et al. Virtues and limitations of Pittsburgh green for ozone detection[J]. Chemical Communications, 2015, 51(9):1579-1582.
[80] Xu Kehua, Sun Shuxia, Li Jing, et al. A near-infrared fluorescent probe for monitoring ozone and imaging in living cells[J]. Chemical Communication, 2012, 48:684-686.
[81] Xu Kehua, Wang Lulu, Qiang Mingming, et al. A selective near-infrared fluorescent probe for singlet oxygen in living cells[J]. Chemical Communication,2011, 47: 7386-7388.
[82] Wayne R P. Singlet molecular oxygen[M]. New York:John Wiley & Sons Inc., 1969.
[83] Jablonowski H, Santos S J, Weltmann K D, et al.Quantification of the ozone and singlet delta oxygen produced in gas and liquid phases by a non-thermal atmospheric plasma with relevance for medical treatment[J]. Scientific Reports, 2018, 8(1): 12195.
[84] Goldstein B D, Harber L C. Erythropoietic protoporphyria: lipid peroxidation and red cell membrane damage associated with photohemolysis[J].The Journal of Clinical Investigation, 1972, 51: 892-902.
[85] Sun Peng, Wu Haiyan, Bai Na, et al. Inactivation of Bacillus subtilis spores in water by a direct-current,cold atmospheric-pressure air plasma microjet[J].Plasma Processes and Polymers, 2012, 9(2): 157-164.
[86] Wu Haiyan, Sun Peng, Feng Hongqing, et al. Reactive oxygen species in a non-thermal plasma microjet and water system: generation, conversion, and contributions to bacteria inactivation-an analysis by electron spin resonance spectroscopy[J]. Plasma Processes and Polymers, 2012, 9(4): 417-424.
[87] Davies M J. Singlet oxygen-mediated damage to proteins and its consequences[J]. Biochemical and Biophysical Research Communications, 2003, 305(3):761-770.
[88] Aprile C, Martin R, Alvaro M, et al. Functional macromolecules from single-walled carbon nanotubes:synthesis and photophysical properties of short single—walled carbon nanotubes functionalized with 9,10-diphenylanthracene[J]. Chemistry—a European Journal, 2008, 14(16): 5030-5038.
[89] Steinbeck M J, Khan A U, Karnovsky M J.Intracellular singlet oxygen generation by phagocytosing neutrophils in response to particles coated with a chemical trap[J]. Journal of Biological Chemistry, 1992, 267: 13425-13433.
[90] Steinbeck M J, Khan A U, Karnovsky M J.Extracellular production of singlet oxygen by stimulated macrophages quantified using 9,10-diphenylanthracene and perylene in a polystyrene film[J]. Journal of Biological Chemistry, 1993, 268:15649-15654.
[91] Racine P, Auffray B. Quenching of singlet molecular oxygen by commiphora myrrha extracts and menthofuran[J]. Fitoterapia, 2005, 76(3-4): 316-323.
[92] Ohyashiki T, Nunomura M, et al. Detection of superoxide anion radical in phospholipid liposomal membrane by fluorescence quenching method using 1,3-diphenylisobenzofuran[J]. Biochimica et Biophysica Acta (BBA) - Biomembranes, 1999, 1421(1): 131-139.
[93] Ragàs X, Jiménez-Banzo A, Sánchez-García D, et al.Singlet oxygen photosensitisation by the fluorescent probe Singlet Oxygen Sensor Green®[J]. Chemical Communications, 2009, 20: 2920-2922.
[94] Lopez C, Pons M N, Morgenroth E. Endogenous processes during long-term starvation in activated sludge performing enhanced biological phosphorus removal[J]. Water Research, 2006, 40(8): 1519-1530.
[95] Hideg E. A comparative study of fluorescent singlet oxygen probes in plant leaves[J]. Central European Journal of Biology, 2008, 3: 273-284.
[96] Hayyan M, Hashim M A, AlNashef I M. Superoxide ion: generation and chemical implications[J].Chemical Reviews, 2016, 116(5): 3029-3085.
[97] Ikawa S, Kitano K, Hamaguchi S. Effects of pH on bacterial inactivation in aqueous solutions due to lowtemperature atmospheric pressure plasma application[J].Plasma Processes and Polymers, 2010, 7: 33-42.
[98] Valko M, Leibfritz D, Moncol J, et al. Free radicals and antioxidants in normal physiological functions and human disease[J]. International Journal of Biochemistry & Cell Biology, 2007, 39(1): 44-84.
[99] Dikalov S, Skatchkov M, Bassenge E. Spin trapping of superoxide radicals and peroxynitrite by 1-hydroxy-3-carboxy-pyrrolidine and 1-hydroxy-2,2,6,6-tetramethyl-4-oxo-piperidine and the stability of corresponding nitroxyl radicals towards biological reductants[J]. Biochemical and Biophysical Research Communication, 1997, 231(3): 701-704.
[100] Chen Chen, Li Fanying, Chen Hailan, et al. Aqueous reactive species induced by a PCB surface microdischarge air plasma device: a quantitative study[J].Journal of Physics D: Applied Physics, 2017, 50(44):445208.
[101] Maillard B, Ingold K U, Scaiano J C. Rate constants for the reactions of free radicals with oxygen in solution[J]. Journal of the American Chemical Society,1983, 105(15): 5095-5099.
[102] Tani A, Fukui S, Ikawa S, et al. Diagnosis of superoxide anion radical induced in liquids by atmospheric-pressure plasma using superoxide dismutase[J]. Japanese Journal of Applied Physics,2015, 54(1S): 01AF01.
[103] Tang Bo, Zhang Li, Geng Yu. Determination of the antioxidant capacity of different food natural products wim a new developed flow injection spetrofluorimetry detection hydroxyl radicals[J]. Talanta, 2005, 65(3);769-775.
[104] Tang Bo, Zhang Li, Hu Jixi, et al. Indirect determination of superoxide anion radical in the plant of red sage based on vanillin-8-aminoquinoline with fluorescence[J]. Analytical Chimica Acta, 2004,502(1): 125-131.
[105] Culotta E, Koshland D E, et al. NO news is good news[J]. Science, 1992, 258(5090): 1862-1864.
[106] 陈晓霞, 易洪潮, 王颖, 等. 一氧化氮电化学传感器及其在生物医学中的应用[J]. 现代科学仪器,2006, 16: 17-20.Chen Xiaoxia, Yi Hongchao, Wang Ying, et al. Nitric oxide electrochemical sensor and its application in biomedicine[J]. Modern Scientific Instruments, 2006,16: 17-20.
[107] Zhang Qian, Sun Peng, Feng Hongqing, et al.Assessment of the roles of various inactivation agents in an argon-based direct current atmospheric pressure cold plasma jet[J]. Journal of Applied Physics, 2012,111(12): 123305.
[108] Mulsch A, Mordvintcev P, Vanin A. Quantification of nitric oxide in biological samples by electron spin resonance spectroscopy[J]. Neuroprotocols, 1992,1(2): 165-173.
[109] Andriambeloson E, Kleschyov A L, Muller B, et al.Nitric oxide production and endothelium-dependent vasorelaxation induced by wine polyphenols in rat aorta[J]. Birtish Pharmacological Society, 1997,120(6): 1053-1058.
[110] Komarov A M, Lai C S. Detection of nitric oxide production in mice by spin-trapping electron paramagnetic resonance spectroscopy[J]. Biochimica et Biophysica Acta, 1995, 1272: 29-36.
[111] Komarov A, Mattson D, Jones M M, et al. In vivo spin trapping of nitric oxide mice[J]. Biochemical and Biophysical Research Communications, 1993, 195(3):1191-1198.
[112] Efrati S, Dishy V, Averbukh M, et al. The effect of N-acetylcysteine on renal function, nitric oxide, and oxidative stress after angiography[J]. Kidney International, 2003, 64(6): 2182-2187.
[113] Wang D, Yu X, Cohen R A, et al. Distinct effects of N-acetylcysteine and nitric oxide on angiotensin II-induced epidermal growth factor receptor phosphorylation and intracellular Ca2+ levels[J].Journal of Biological Chemistry, 2000, 275(16):12223-12230.
[114] Shen Jie, Zhang Hao, Xu Zimu, et al. Preferential production of reactive species and bactericidal efficacy of gas-liquid plasma discharge[J]. Chemical Engineering Journal, 2019, 362: 402-412.
[115] Claros J, Jiménez E, Aguado D, et al. Effect of pH and HNO2 concentration on the activity of ammoniaoxidizing bacteria in a partial nitritation reactor[J].Water Science and Technology, 2013, 67(11): 2587-2594.
[116] 徐专红. 食物中的硝酸盐和亚硝酸盐与人体健康[J].食品科技, 1999(4): 53-55.Xu Zhuhong. Nitrate and nitrite in food and human health[J]. Food Science and Technology, 1999(4): 53-55.
[117] Addiscott T M, Benjamin N. Nitrate and human health[J]. Soil Use and Management, 2004, 20(2): 98-104.
[118] Green L C, Wagner D A, Glogowski J, et al. Analysis of nitrate, nitrite, and [15N]nitrate in biological fluids[J]. Analytical Biochemistry, 1982, 126(1): 131-138.
[119] 魏敬, 党文玲. 亚硝酸盐测定方法的比较与分析[J].肉类工业, 2004(7): 37-38.Wei Jing, Dang Wenling. Comparison and analysis of determination methods of nitrite[J]. Meat Industry,2004(7): 37-38.
[120] 赵萍. 流动注射分光光度法测定亚硝酸根氮[J]. 分析试验室, 2006, 25(10): 29-31.Zhao Ping. Determination of nitrite nitrogen by flow injection spectrophotometry[J]. Laboratory of Analysis, 2006, 25(10): 29-31
[121] von Woedtke T, Oehmigen K, Brandenburg R, et al.Plasma-liquid interactions: chemistry and antimicrobial effects[J]. NATO Science for Peace and Security Series A-Chemistry and Biology, 2012, DOI:10.1007/978-94-007-2852-3-6.
[122] Oh J S, Szili E J, Ogawa K, et al. UV-vis spectroscopy study of plasma-activated water: dependence of the chemical composition on plasma exposure time and treatment distance[J]. Japanese Journal of Applied Physics, 2018, 57(1): 0102B9.
[123] Oh J S, Szili E J, Gaur N, et al. How to assess the plasma delivery of RONS into tissue fluid and tissue[J]. Journal of Physics D: Applied Physics, 2016,49(30): 304005.
[124] Szili E J, Oh J S, Hong S H, et al. Probing the transport of plasma-generated RONS in an agarose target as surrogate for real tissue: dependency on time, distance and material composition[J]. Journal of Physics D:Applied Physics, 2015, 48(20): 202001.
[125] Keiber R J, Seaton P J. Determination of subnanomolar concentrations of nitrite in natural waters[J]. Analytical Chemistry, 1995, 67(18): 3261-3264.
[126] Machala Z, Tarabova B, Hensel K, et al. Formation of ROS and RNS in water electro-sprayed through transient spark discharge in air and their bactericidal effects[J]. Plasma Processes and Polymers, 2013,10(7): 649-659.
[127] 袁友明, 姚晶晶, 路磊, 等. 离子色谱法测定农田灌溉水中亚硝酸盐[J]. 湖北农业科学, 2009, 48(9):2237-2239.Yuan Youming, Yao Jingjing, Lu Lei, et al.Determination of nitrite in farmland irrigation water by ion chromatography[J]. Hubei Agricultural Sciences, 2009, 48(9): 2237-2239.
[128] Pacher P, Beckman J S, Liaudet L. Nitric oxide and peroxynitrite in health and disease[J]. Physiological Reviews, 2007, 87(1): 315-424.
[129] Szabó C, Ischiropoulos H, Radi R. Peroxynitrite:biochemistry, pathophysiology and development of therapeutics[J]. Nature Reviews Drug Discovery,2007, 6(8): 662-680.
[130] Hempel S L, Buettner G R, O’Malley Y Q.Dihydrofluorescein diacetate is superior for detecting intracellular oxidants: comparison with 2′,7′-dichlorodihydrofluorescein diacetate, 5(and 6)-carboxy-2′,7′-dichlorodihydrofluorescein diacetate,and dihydrorhodamine 123[J]. Free Radical Biology and Medicine, 1999, 27(1-2): 146-159.
[131] Kooy N W, Royall J A, Ischiropoulos H. Oxidation of 2′,7′-dichlorofluorescin by peroxynitrite[J]. Free Radical Research, 1997, 27: 245-254.
[132] Kooy N W, Royall J A, Ischiropoulos H, Beckman J S.Peroxynitrite-mediated oxidation of dihydrorhodamine 123[J]. Free Radical Biology Medicine, 1994, 16(2):149-156.
[133] Crow J P. Dichlorodihydrofluorescein and Dihydrorhodamine 123 are sensitive indicators of Peroxynitrite in vitro: implications for intracellular measurement of reactive nitrogen and oxygen species[J]. Nitric Oxide,1997, 1(2): 145-157.
[134] Zielonka J, Sikora A, Joseph J, Kalyanarama B.Peroxynitrite is the major species formed from different flux ratios of co-generated nitric oxide and superoxide: direct reaction with boronate-based fluorescent probe[J]. Journal of Biological Chemistry,2010, 285(19): 14210-14216.
[135] Zielonka J, Zielonka M, Sikora A, et al. Global profiling of reactive oxygen and nitrogen species in biological systems: high-throughput real-time analyses[J]. Journal of Biological Chemistry, 2012,287(5): 2984-2995.
[136] Zielonka J, Sikora A, Hardy M, Joseph J, et al.Boronate probes as diagnostic tools for real time monitoring of peroxynitrite and hydroperoxides[J].Chemical Research in Toxicology, 2012, 25(9): 1793-1799.
[137] Zhou Renwu, Zhou Rusen, Prasad Karthika, et al. Cold atmospheric plasma activated water as a prospective disinfectant: the crucial role of peroxynitrite[J]. Green Chemistry, 2018, 20: 5276.
[138] Huang Junchao, Li Dejia, Diao Junchen, et al. A novel fluorescent method for determination of peroxynitrite using folic acid as a probe[J]. Talanta, 2007, 72: 1283-1287.
[139] Cox R A, Derwent R G, Hutton A J L. Significance of peroxynitric acid inatmospheric chemistry of nitrogen oxides[J]. Nature, 1997, 270: 328-329.
[140] Kenley R A, Trevor P L, Lan B Y. Preparation and thermal decomposition ofpernitric acid (HOONO2) in aqueous media[J]. Journal of the American Chemical Society, 1981, 103(9): 2203-2206.
[141] Régimbal J M, Mozurkewich M. Peroxynitric acid decay mechanisms andkinetics at low pH[J]. The Journal of Physical Chemical A, 1997, 101: 8822-8829.
[142] Gierczak T, Jiménez E, Riffault V, et al. Thermal decomposition of HO2NO2(peroxynitric acid, PNA):rate coefficient anddetermination of the enthalpy of formation[J]. The Journal of Physical Chemistry A,2005, 109(4): 586-596.
[143] Nakashima Y, Ikawa S, Tani A, et al. Ion-exchange chromatographic analysis of peroxynitric acid[J].Journal of Chromatography A, 2016, 1431: 89-93.
[144] Hidefumi Uchiyama, Zhao Qingli, Mariame Ali Hassan, et al. EPR-spin trapping and flow cytometric studies of free radicals generated using cold atmospheric argon plasma and X-ray irradiation in aqueous solutions and intracellular milieu[J]. Plos One, 2015, 10(8): 1-19.
[145] Gorbanev Y, Stehling N, O’Connell D, et al. Reactions of nitroxide radicals in aqueous solutions exposed to non-thermal plasma: limitations of spin trapping of the plasma induced species[J]. Plasma Sources Science and Technology, 2016, 25(5): 055017.
[146] Guo Qiong, QianSteven Y, Ronald P Mason, et al.Separation and identification of DMPO adducts of oxygen-centered radicals formed from organic hydroperoxides by HPLC-ESR, ESI-MS and MS/MS[J]. Journal of the American Society for Mass Spectrometry, 2003, 14(8): 862-871.
[147] Gorbanev Y, Verlackt C C W, Verlackt S, et al.Combining experimental and modelling approaches to study the sources of reactive species induced in water by the COST RF plasma jet[J]. Physical Chemistry Chemical Physics, 2018, 20: 2797-2808.
[148] Suga Y, Sekiguchi H. Epoxidation of carbon double bond using atmospheric non-equilibrium oxygen plasma[J]. Thin Solid Films, 2006, 506-507: 427-431.