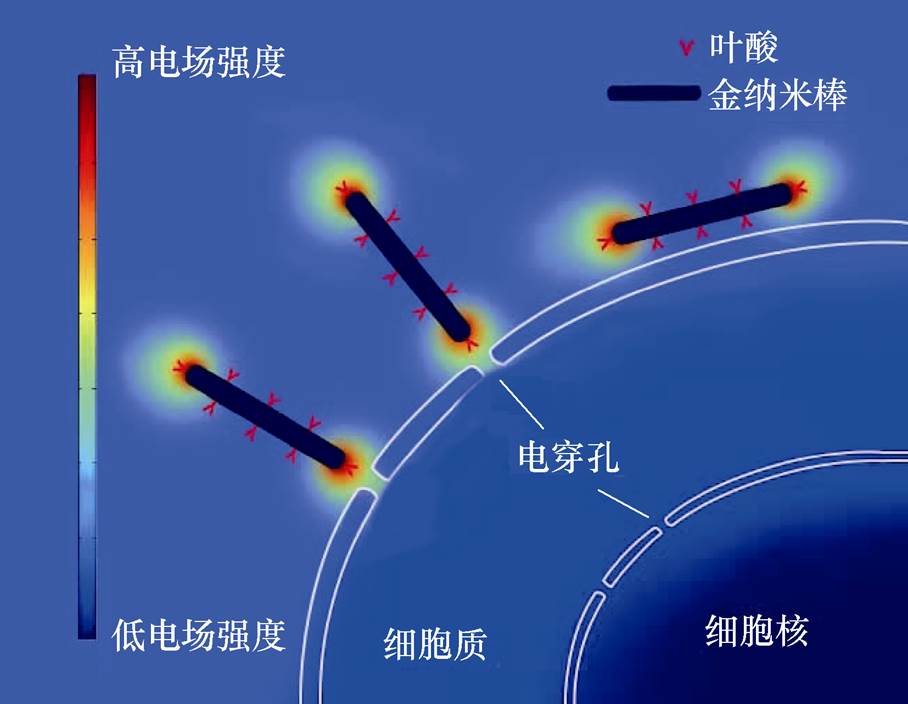
图1 金纳米棒增强nsPEFs对肿瘤细胞电穿孔效应的示意图
Fig.1 Schematic of GNR-PEG-FA enhances the electroporation effect of nsPEFs on tumor cells
摘要 为了改善纳秒脉冲电场(nsPEFs)在治疗肿瘤过程中存在的电气安全性问题,该文首次研究低强度nsPEFs联合叶酸修饰的金纳米棒对A375黑色素瘤细胞杀伤效果的影响。首先对聚乙二醇-金纳米棒(GNR-PEG)的表面进行叶酸(FA)的修饰,从而实现对A375黑色素瘤细胞的靶向作用;然后用暗场显微镜观察其结合效果。该文在确定了GNR-PEG和GNR-PEG-FA安全质量分数后,通过改变电场强度(2~8kV/cm)和脉冲个数(15~260个)来研究该联合方法对细胞活性和凋亡的影响。结果发现,GNR-PEG-FA与低强度nsPEFs联合显示出最佳的抗肿瘤效果,在较低的电场强度和较少的脉冲个数作用下,实现了更低比例的细胞的活性和更高比例的细胞凋亡。该联合方法增强了nsPEFs对A375黑色素瘤细胞杀伤效果,改善了nsPEFs治疗中的电气安全性问题。
关键词:金纳米棒 纳秒脉冲电场 细胞活性 凋亡 叶酸 A375黑色素瘤细胞
纳秒脉冲电场(nanosecond Pulsed Electric Fields, nsPEFs)作为一种新兴的肿瘤物理治疗方法,在国内外已经得到了广泛的研究与应用。这一新型的物理治疗方法避免了化疗药物的参与[1],而且在治疗过程中能够有效地减轻热损伤[2]、炎症和溃疡等副作用[3],具有良好的应用前景。由于nsPEFs的脉宽较窄,这使得nsPEFs在治疗过程中需要较高的电场强度才能有效地杀伤肿瘤细胞[4],而在过高的电场强度作用下,肿瘤组织作为一种介质可能会出现局部放电[5],同时患者会出现强烈的肌肉收缩,这些潜在的隐患造成nsPEFs在治疗肿瘤的过程中存在一定的电气安全性问题。
近年来,国外一些学者已经发现具有优良电学性能和良好生物相容性的金纳米粒子能够增强脉冲电场的生物电效应,这为改善nsPEFs治疗肿瘤所存在的电气安全性问题提供了潜在的可能。Qiu Hao等通过二维有限元仿真研究了高电导率金纳米粒子与nsPEFs联合(电场强度为50kV/cm,脉宽为4ns,脉冲个数为1)对球型细胞电穿孔的影响,仿真发现金纳米粒子的加入能够有效地提高细胞跨膜电位,细胞膜表面的电穿孔密度也提高了4倍[6]。该研究从仿真的角度证明了金纳米粒子能够有效地增强细胞的电穿孔效应。除此之外,A. Rolong等同样通过有限元仿真研究了高电导率纳米粒子与微秒脉冲电场(电场强度分别为1.5kV/cm、1.875kV/cm和2.25kV/cm,脉宽100μs,频率1Hz,脉冲个数80)对肿瘤组织的影响[7]。仿真结果表明,与单独使用微秒脉冲电场相比,高电导率纳米粒子的加入使得肿瘤组织消融面积扩大了10.4%,有效地提高了微秒脉冲电场治疗肿瘤的效果。Huang等将球型金纳米粒子表面通过化学的方法来携带DNA质粒或小干扰RNA分子,然后配合毫秒脉冲电场(电场强度625V/cm,脉宽10ms,脉冲个数1)来研究其分别对NIH/3T3和K562细胞的电转染效率,实验发现,金纳米粒子加入后的电转染效率提高了1.5~2倍,从实验的角度证明了金纳米粒子能够有效地增强生物电效应[8]。综上所述,金纳米粒子的加入能够显著地提高脉冲电场对细胞产生的电穿孔效应。除此之外,金纳米棒(Gold Nanorods, GNRs)作为一种具有一定长径比的金纳米粒子,不仅具有高电导率的特性,还能够在其尖端造成局部的电场增强,使其能够更有效地增强细胞的电穿孔效应。P. K. Tiwari等通过有限元模拟研究了交变电场(电场强度1.25MV/cm,频率13.56MHz)联合不同长宽比的GNRs对电转染效率的影响。仿真结果显示,GNRs能够改变细胞中的电场矢量分布,提高了电穿孔效应,从而增加了基因传递的效率[9]。然而,在上述研究当中,GNRs与细胞的结合具有偶然性,这说明仍然存在大量的GNRs,并没有在细胞周围发挥其增强电场的作用,GNRs的利用效率较低。因此,为了更加高效地利用金纳米棒局部增强电场的特性,本文将对金纳米棒进行靶向配体的修饰,使得修饰后的金纳米棒主动的聚集在细胞周围,更好地发挥其增强电场的作用,从而更有效地增强nsPEFs对肿瘤细胞产生的电穿孔效应,提高肿瘤治疗的效果。
叶酸(Folic Acid, FA)作为一种常用的靶向配体将被用于修饰聚乙二醇-金纳米棒(Polyethylene Glycol-Gold Nanorods, GNR-PEG)的表面。因为黑色素瘤细胞细胞膜表面存在大量的叶酸受体,这使得FA修饰后的GNR-PEG(Folic Acid-Polyethylene Glycol-Gold Nanorods, GNR-PEG-FA)能够特殊地识别黑色素瘤细胞[10-11]。基于GNR-PEG-FA对黑色素瘤细胞的主动靶向作用,本文首次提出了具有靶向作用的金纳米棒与低强度nsPEFs联合这一新型联合物理治疗方法,其目的是为进一步提高nsPEFs对肿瘤细胞的电穿孔效应,从而提高nsPEFs对肿瘤的治疗效果,金纳米棒增强nsPEFs对肿瘤细胞电穿孔效应的示意图如图1所示。为了验证这一方法的可行性,本文首先分别确定了GNR-PEG和GNR-PEG- FA的安全质量分数。在确定了安全质量分数的前提下,研究了该联合方法在不同脉冲电场强度(2~8kV/cm)和不同脉冲个数(15~260个)分别作用下对细胞活性和凋亡的影响,比较并分析了单独nsPEFs处理组、GNR-PEG处理组和GNR-PEG-FA处理组三组之间细胞活性和凋亡的结果。最后,本文分析了GNRs增强细胞电穿孔效应的电学机制以及生物学机制,旨在为nsPEFs治疗黑色素瘤或其他肿瘤提供一种更有效、更安全的治疗方法。

图1 金纳米棒增强nsPEFs对肿瘤细胞电穿孔效应的示意图
Fig.1 Schematic of GNR-PEG-FA enhances the electroporation effect of nsPEFs on tumor cells
将人的黑色素瘤A375细胞系(获自第三军医大学基础医学研究院)于含有高糖Dulbecco改良的Eagle培养基(Dulbecco’s Modified Eagle’s Medium, DMEM)(其中含有10%的血清和1%抗生素的青霉素-链霉素)的培养瓶中培养,并在CO2体积分数为5%和温度为37℃的加湿培养箱中孵育。当细胞生长汇合至80%左右时,将细胞进行传代或者实验。
GNR-PEG溶液和GNR-PEG-FA溶液均购置于西安瑞禧生物科技有限公司,使用TECNAI G2 F20 S-TWIN透射电镜(FEI, USA)对金纳米棒进行观察,并通过Cary60紫外-可见光分光光度计(Agilent, USA)测定GNR-PEG和GNR-PEG-FA溶液的吸收光谱。
在进行暗场观察之前,将细胞单层从培养瓶中消化下来,重新接种于含有18mm的玻璃盖玻片的12孔板中,置于孵箱中继续培养24h待其完全贴壁。之后将12孔板中的培养基吸出,用磷酸缓冲盐溶液(Phosphate Buffer Saline, PBS)轻轻冲洗,然后分别加入预先配置好的安全质量分数的GNR-PEG溶液、GNR-PEG-FA溶液继续孵育15min,孵育完成后加入PBS洗去残余未结合的金纳米棒,使用多聚甲醛进行固定,甘油包被,并用另一个盖玻片密封后等待观察。金纳米棒暗场成像通过配有暗场聚光镜(U-DCW, 1.2-1.4)的BX51光学显微镜(Olympus, Japan)来实现。来自金纳米棒和细胞的散射光经过100X的物镜到达DP72单芯片真彩色CCD相机(Olympus, Japan),然后由该相机拍摄暗场照片对金纳米棒和细胞进行观察。
使用CCK-8(Dojindo, Japan)试剂对金纳米棒的细胞毒性进行测定。将不同体积的GNR-PEG和GNR-PEG-FA溶液分别与已配置好的新鲜培养基混合,将GNR-PEG和GNR-PEG-FA的质量分数均调整为0mg/mL、0.01mg/mL、0.05mg/mL、0.1mg/mL、0.2mg/mL和0.4mg/mL。将处于对数生长期的A375黑色素瘤细胞用0.25%的胰酶消化后离心5min(800r/min),弃去上清液,用上述含有不同质量分数的GNR-PEG和GNR-PEG-FA的培养基分别重悬A375细胞,然后将A375细胞接种于96孔板中,并于孵箱中继续培养8h后进行检测,具体检测方法如1.5节(细胞活性的检测)所述,其中对照组为仅含新鲜培养基的细胞悬液。
本研究采用实验室自制的以模块化多电平变换器为基础的高压纳秒脉冲发生器[12]。实验脉冲参数如下:①当改变电场强度时:脉冲重复频率为1Hz,脉冲个数为100,脉冲宽度为300ns,电场强度分别为2kV/cm,4kV/cm,5kV/cm,6kV/cm和8kV/cm;②当改变脉冲个数时:电场强度为5kV/cm,脉冲重复频率为1Hz,脉冲宽度为300ns,脉冲个数分别为15,50,100,170和260。在nsPEFs处理之前,将细胞悬浮液分成以下三组:单独的nsPEFs组(没有GNRs的细胞悬液)、GNR-PEG组(与含有安全质量分数GNR-PEG的培养基混合的细胞)和GNR- PEG-FA组(与含有安全质量分数GNR-PEG-FA的培养基混合的细胞)。然后,将这三组细胞悬液分别放入2mm间隙的电击杯(Bio-Rad, Hercules, USA)中,施加相应的脉冲电场进行处理,每次实验至少重复3次。
本实验选用泰克公司生产的MDO3024型号的示波器,配合高压探头(PPE5KV, Teledyne Lecroy)和皮尔森线圈(2877, Pearson electronics)来测试电阻负载两端的电压和电流,波形如图2所示。
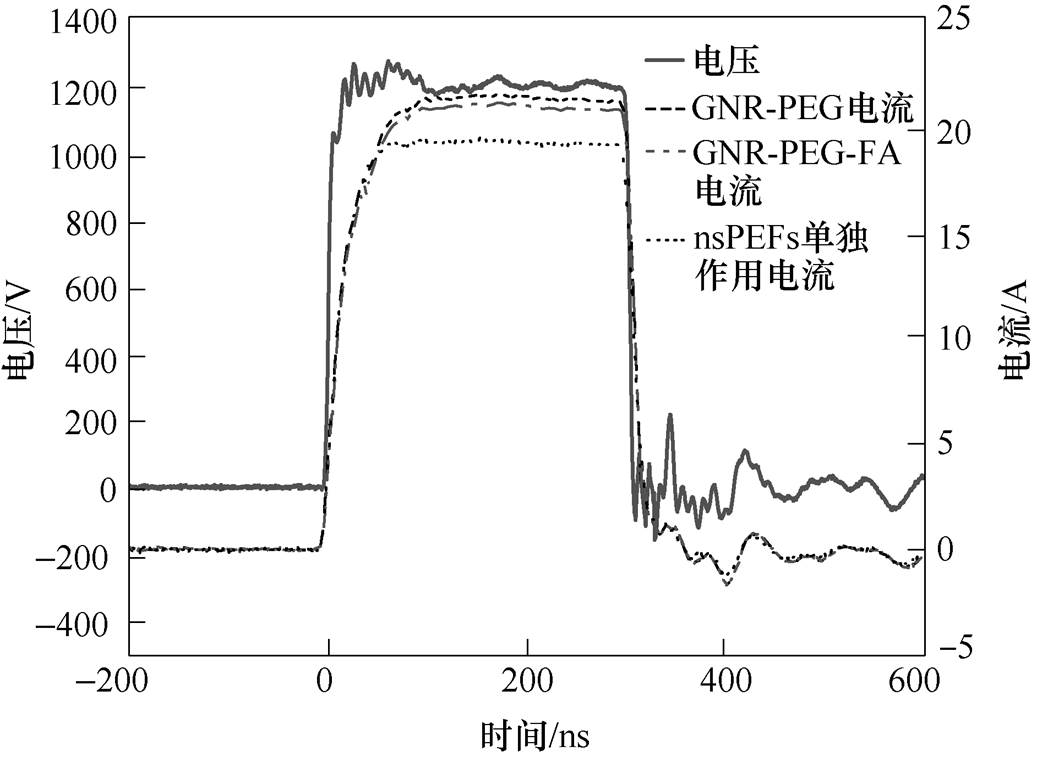
图2 负载两端的脉冲电压和脉冲电流波形
Fig.2 Waveforms of pulsed voltage and pulsed current on the load
使用CCK-8试剂对脉冲处理后的细胞进行增值活性的测定,金纳米棒在使用前进行超声分散处理30min。在nsPEFs处理之前,将处于对数生长期的A375黑色素瘤细胞消化并离心(800r/min),分别与含有安全质量分数的GNR-PEG和GNR-PEG- FA的培养基溶液混合,然后置于2mm间隙的电击杯中施加脉冲处理。脉冲作用结束后将细胞悬液从电击杯中取出,离心后去除多余金纳米棒,然后重悬于新鲜培养基中,以1×104cells/孔接种于96孔板中并恢复培养。细胞继续培养8h后将96孔板从孵箱中取出,利用移液枪缓慢吸掉上清液,用PBS缓冲液轻轻清洗两遍,在避光条件下重新加入110mL培养基与CCK-8的混合溶液(培养基与CCK-8试剂的比例为10 1),然后继续置于孵箱中培养1.5h。最后在避光条件下利用酶标仪(EPOCH2, Biotek)在450nm波长处测量每组实验的吸光度。
1),然后继续置于孵箱中培养1.5h。最后在避光条件下利用酶标仪(EPOCH2, Biotek)在450nm波长处测量每组实验的吸光度。
细胞活性=(实验组吸光值-空白组吸光值)/(对照组吸光值-空白组吸光值)×100%,其中,空白组为不含细胞的混合培养液。
通过Annexin V-FITC凋亡检测试剂盒(BMS500FI, ThermoFisher)来评估细胞的凋亡。在施加nsPEFs处理之后,从电极杯中取出细胞悬液并计数,将细胞重新接种于6孔板中并于孵箱中进行培养。培养3h后,用不含EDTA的胰蛋白酶从6孔板中重新收获细胞,并根据制造商的说明书,采用FITC-Annexin V和PI(propidium iodide)对细胞进行染色,然后通过ACCURI-C6-T100流式细胞仪(BD, UK)进行分析。
采用OriginPro软件对数据进行绘图和统计学分析,数据均用x(均值)±s(标准差)表示,利用单因素方差分析评估实验数据的显著性差异。
实验所用的GNR-PEG和GNR-PEG-FA长度均约为60nm,外径约为15nm,GNRs的透射电镜(Trans- mission Electron Microscope, TEM)图如图3所示。GNRs具有横向等离子体共振和纵向等离子体共振两种模式。较强的纵向等离子体共振使得GNR-PEG和GNR-PEG-FA分别在约820nm和830nm处具有较大的吸收峰,较弱的横向等离子体共振使得两者在520nm处具有较小的吸收峰,GNR-PEG和GNR- PEG-FA的紫外-可见光光谱图如图4所示。由于GNR-PEG-FA表面进行了叶酸的修饰,所以使得其纵向等离子体共振峰较GNR-PEG红移了约10nm。
暗场显微镜中的一束窄的白光斜射向被观测的物体,通过其反射或者散射出一定波长的光来实现对物体的观察。GNRs由于其具有强烈的等离子体共振,使得GNRs在暗场显微镜下观察的优势尤为突出。图5为暗场显微镜下对三组细胞进行观察的结果,其中实验所用的这种GNRs在暗场显微镜显示为偏黄色的亮点。通过对比三组细胞可以发现通过叶酸修饰过后的GNR-PEG-FA能够更有效地与A375黑色素瘤结合,证明了其对A375黑色素瘤细胞具有靶向识别作用。

图3 GNRs的透射电镜图
Fig.3 Transmission electron microscope micrograph of GNRs
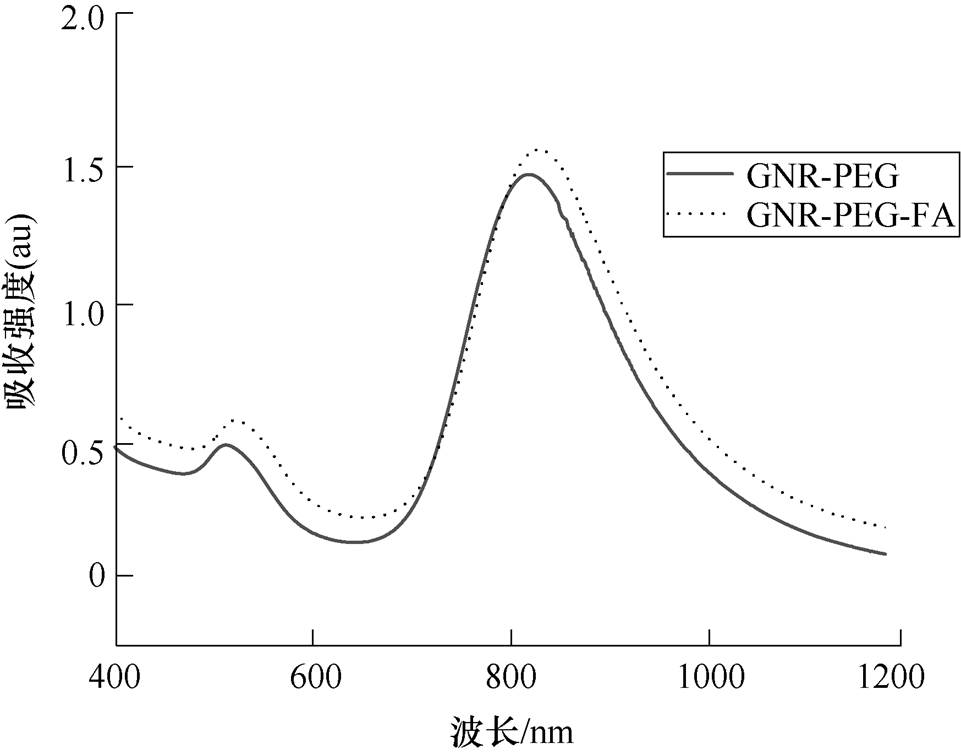
图4 GNR-PEG和GNR-PEG-FA的紫外-可见光光谱图
Fig.4 UV-Vis spectrum of GNR-PEG and GNR-PEG-FA
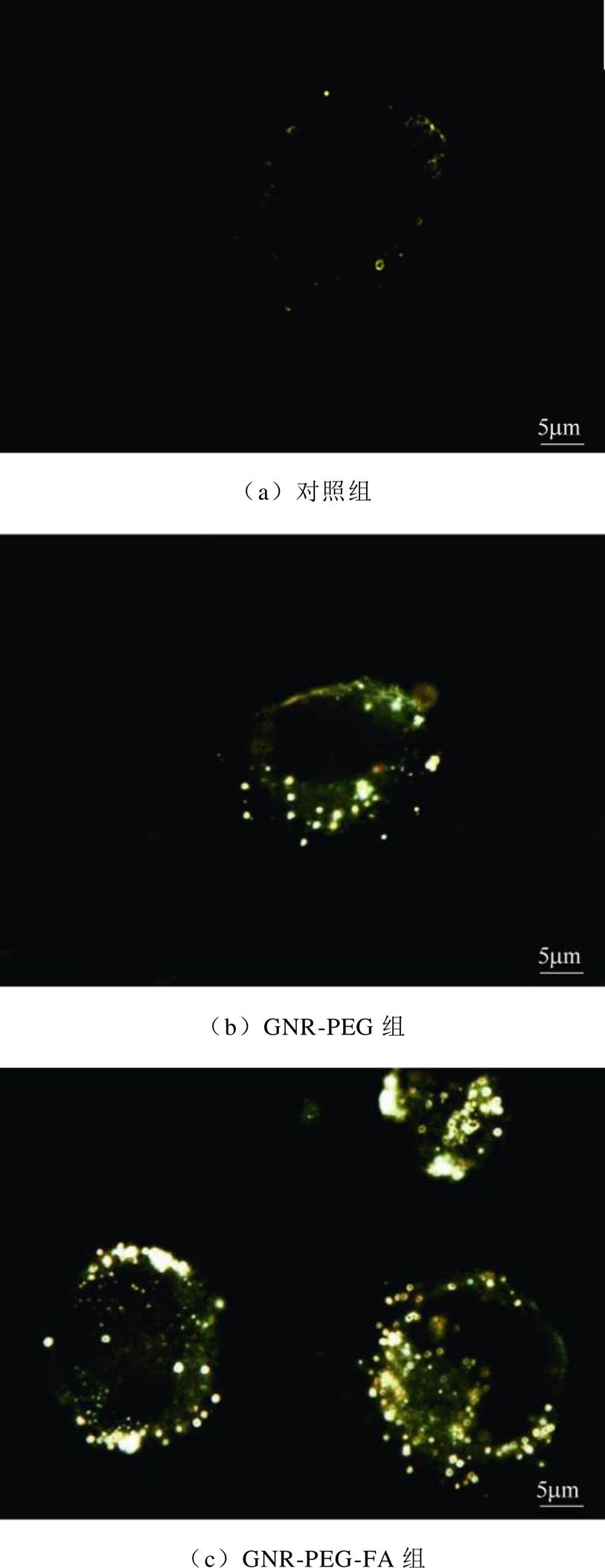
图5 金纳米棒与A375细胞的暗场成像图
Fig.5 Dark field imaging of GNR-PEG and GNR-PEG-FA after incubation with A375 melanoma cells
由于本文的重点是研究GNRs的加入能否增强nsPEFs对肿瘤细胞的杀伤效果,所以首先需要确定GNRs的安全质量分数以排除其本身毒性对肿瘤细胞的影响。实验通过将A375黑色素瘤细胞与含有不同质量分数的GNR-PEG和GNR-PEG-FA培养基分别培养8h,然后利用CCK-8试剂来分别检测细胞的活性,从而确定安全质量分数。不同质量分数的GNR-PEG和GNR-PEG-FA对A375细胞活性的影响如图6所示。图中,*表示p<0.05,为实验数据之间具有显著性差异,**表示p<0.01,为实验数据之间具有极显著性差异。在较低的质量分数如0.01mg/mL和0.05mg/mL时,加入GNR-PEG的细胞活性与对照组几乎没有差别,而加入GNR-PEG- FA的细胞活性反而较对照组而言升高了(p<0.05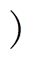 。当质量分数达到0.2mg/mL时,GNR-PEG和GNR-PEG-FA对细胞的毒性开始显现,其毒性与GNR-PEG和GNR-PEG-FA的质量分数呈正相关。当GNR-PEG和GNR-PEG-FA的质量分数为0.2mg/mL时,GNR-PEG组和GNR-PEG-FA组的细胞活性分别为93.77%和92.99%(p<0.05
。当质量分数达到0.2mg/mL时,GNR-PEG和GNR-PEG-FA对细胞的毒性开始显现,其毒性与GNR-PEG和GNR-PEG-FA的质量分数呈正相关。当GNR-PEG和GNR-PEG-FA的质量分数为0.2mg/mL时,GNR-PEG组和GNR-PEG-FA组的细胞活性分别为93.77%和92.99%(p<0.05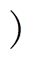 ,较对照组活性相比有了一定的下降。尤其当质量分数上升至0.4mg/mL时,加入了GNR-PEG的细胞活性约86%,加入了GNR-PEG-FA的细胞活性仅约为74%,毒性明显上升。然而,实验发现当GNR-PEG和GNR- PEG-FA的质量分数均为0.1mg/mL时,两者的细胞活性与对照组均无统计学上的显著性差异(p>0.05
,较对照组活性相比有了一定的下降。尤其当质量分数上升至0.4mg/mL时,加入了GNR-PEG的细胞活性约86%,加入了GNR-PEG-FA的细胞活性仅约为74%,毒性明显上升。然而,实验发现当GNR-PEG和GNR- PEG-FA的质量分数均为0.1mg/mL时,两者的细胞活性与对照组均无统计学上的显著性差异(p>0.05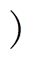 。此实验目的为了证明后续实验对肿瘤细胞杀伤效果的增强是nsPEFs和GNRs联合所导致的,所以需要排除GNR-PEG和GNR-PEG-FA本身毒性对细胞活性的影响。因此,本实验的安全质量分数取0.1mg/mL,并用于后续nsPEFs处理实验。
。此实验目的为了证明后续实验对肿瘤细胞杀伤效果的增强是nsPEFs和GNRs联合所导致的,所以需要排除GNR-PEG和GNR-PEG-FA本身毒性对细胞活性的影响。因此,本实验的安全质量分数取0.1mg/mL,并用于后续nsPEFs处理实验。
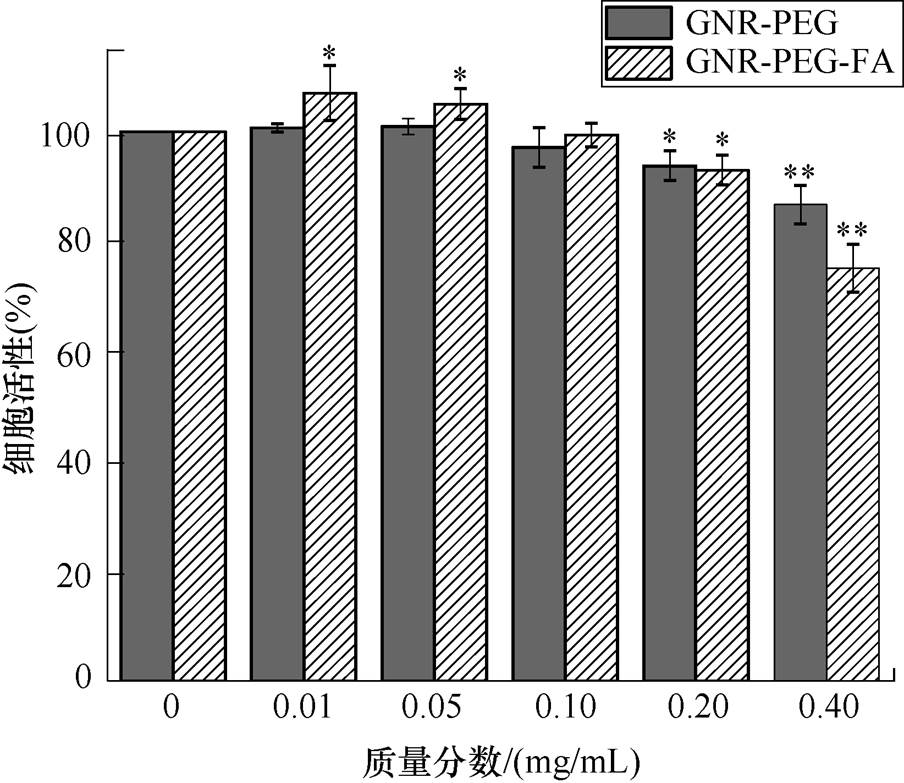
图6 不同质量分数的GNR-PEG和GNR-PEG-FA对A375细胞活性的影响
Fig.6 The influence of different concentrations of GNR- PEG and GNR-PEG-FA on cell viability of A375 cells
通过CCK-8试剂检测A375黑色素瘤细胞在nsPEFs处理8h后的细胞活性,不同电场强度和脉冲个数作用下A375细胞的活性变化如图7所示。图7a显示随着脉冲电场强度的增加,整体的细胞活性呈现明显的下降趋势,当电场强度作为变量从2kV/cm增加到8kV/cm时,nsPEF单独作用组、GNR- PEG组和GNR-PEG-FA组的细胞活性分别从97.05%、94.20%和84.93%降低到5.33%、4.65%和2.08%。尤其在电场强度为5kV/cm和6kV/cm时,nsPEFs单独处理组的细胞活性分别为57.20%和28.06%,GNR-PEG组的细胞活性分别为40.63%和15.56%,而GNR-PEG-FA组的细胞活性仅分别为26.51%和10.19%,由此可见GNR-PEG-FA的加入使得nsPEFs对黑色素瘤细胞的抑制效果得到了明显的增强。同时,通过比较实验结果,nsPEF单独作用组在电场强度为5kV/cm和6kV/cm时的细胞活性,分别与GNR- PEG-FA组在4kV/cm和5kV/cm时的细胞活性基本持平,这也意味着达到相同的杀伤效果,GNR-PEG- FA的加入较nsPEF单独作用时所需的外加电场强度分别降低约20%和16.7%,在一定程度上改善了nsPEF的电气安全性。
图7b显示随着脉冲个数的增加,整体的细胞活性呈现明显的下降趋势。当脉冲个数作为变量从15增加到260时,nsPEF单独作用组、GNR-PEG组和GNR-PEG-FA组的细胞活性分别从99.44%、91.37%和75.88%降低到8.475%、4.22%和2.14%。当脉冲个数为100和170时,nsPEFs单独处理组的细胞活性分别为40.63和12.46%,而GNR-PEG-FA组的细胞活性仅分别为23%和6%,同样可见GNR-PEG- 性分别为57.20%和27.02%,GNR-PEG组的细胞活FA的加入较nsPEFs单独使用时,黑色素瘤细胞的抑制效果得到了明显的增强,极大地增强了对A375黑色素瘤细胞增值活性的抑制效果。除此之外,实验发现GNR-PEG组仅在一定的脉冲参数下与nsPEFs单独处理组有显著性差异(p<0.05 ,增强效果不稳定,而GNR-PEG-FA组则在实验所用的任意电场强度或者脉冲个数作用下,均表现了显著性的增强(p<0.05
,增强效果不稳定,而GNR-PEG-FA组则在实验所用的任意电场强度或者脉冲个数作用下,均表现了显著性的增强(p<0.05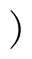 ,更高效、更稳定地抑制了黑色素瘤细胞的存活率。
,更高效、更稳定地抑制了黑色素瘤细胞的存活率。
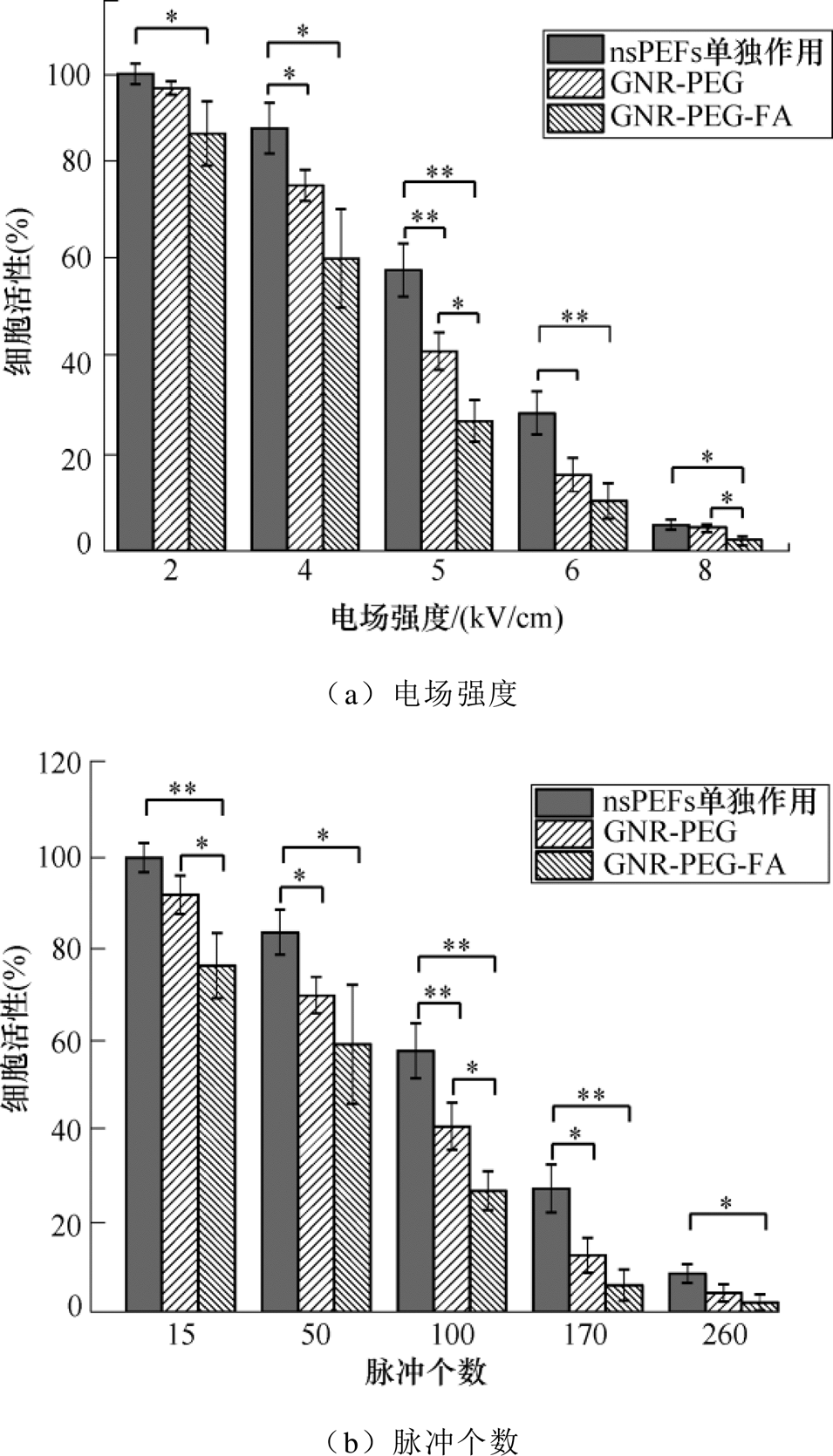
图7 不同电场强度和脉冲个数作用下A375细胞的活性变化
Fig.7 Viability of A375 cells under different electric field strengthsand pulse numbers
在nsPEFs处理A375黑色素瘤细胞3h后,利用FITC-Annexin V/PI双染法测定细胞的凋亡,实验结果如图8所示,由于实验所用的GNR-PEG和GNR-PEG-FA的质量分数均为毒性实验所获得的安全质量分数,因此在未施加nsPEFs的情况下,GNR- PEG组、GNR-PEG-FA组分别与对照组比较,凋亡率无显著性差异(p>0.05 。实验结果表明,随着电场强度的增加或脉冲个数的增加,细胞的凋亡率呈现明显上升的趋势。当电场强度作为变量从2kV/cm增加到8kV/cm时,nsPEF单独作用、GNR-PEG组和GNR-PEG-FA组的细胞凋亡率分别从4.13%、5.58%和6.43%增加到了39.92%、55.69%和59.64%。当脉冲个数作为变量从15增加到260时,nsPEF单独作用、GNR-PEG组和GNR-PEG-FA组的细胞凋亡率分别从2.81%、6.10%和8.03%增加到了48.76%、54.20%和59.47%。由此可见,GNR-PEG-FA的加入能够实现更高的细胞凋亡率,从而更有效地杀伤黑色素瘤细胞。更重要的是,实验发现只是在特定的一些参数下GNR-PEG与nsPEFs单独作用相比,具有显著性差异,增强效果不稳定,而GNR-PEG-FA组在任意实验所用的电场强度或者脉冲个数作用下,均存在显著性差异(p<0.05
。实验结果表明,随着电场强度的增加或脉冲个数的增加,细胞的凋亡率呈现明显上升的趋势。当电场强度作为变量从2kV/cm增加到8kV/cm时,nsPEF单独作用、GNR-PEG组和GNR-PEG-FA组的细胞凋亡率分别从4.13%、5.58%和6.43%增加到了39.92%、55.69%和59.64%。当脉冲个数作为变量从15增加到260时,nsPEF单独作用、GNR-PEG组和GNR-PEG-FA组的细胞凋亡率分别从2.81%、6.10%和8.03%增加到了48.76%、54.20%和59.47%。由此可见,GNR-PEG-FA的加入能够实现更高的细胞凋亡率,从而更有效地杀伤黑色素瘤细胞。更重要的是,实验发现只是在特定的一些参数下GNR-PEG与nsPEFs单独作用相比,具有显著性差异,增强效果不稳定,而GNR-PEG-FA组在任意实验所用的电场强度或者脉冲个数作用下,均存在显著性差异(p<0.05 ,进一步验证了GNR-PEG-FA的加入能够使nsPEFs更加稳定、有效地抑制了黑色素瘤细胞的存活率。
,进一步验证了GNR-PEG-FA的加入能够使nsPEFs更加稳定、有效地抑制了黑色素瘤细胞的存活率。

图8 不同电场强度和脉冲个数作用下A375细胞的凋亡率变化
Fig.8 Apoptosis of A375 cells under different electric field strengths and pulse numbers
金纳米棒的毒性实验表明GNR-PEG和GNR- PEG-FA对A375黑色素瘤细胞的毒性具有质量分数赖性,如图6所示。相关研究表明,金纳米棒的细胞毒性主要受到其表面化学稳定剂的影响,而这种化学稳定剂的作用是提高金纳米棒的稳定性和分散性,随着金纳米棒质量分数的增加,这些化学稳定剂的质量分数也随着增加,当化学稳定剂达到一定质量分数后,就会对细胞产生一定的毒副作用[13]。然而,这些化学稳定剂在金纳米棒的制备过程是必不可少的,目前也只能通过将这些稳定剂置换成其他更具有生物相容性的试剂来减小其毒性,但是仍然无法完全消除化学试剂对细胞的毒副作用。
当金纳米棒的尺寸和质量分数不同时,细胞对其摄取的能力也不同,毒性也会随之发生改变[14];当金纳米棒的质量分数过大时,细胞会摄取过量的金纳米棒,这将会严重的影响细胞正常的代谢,进而导致其细胞毒性增强,这与毒性实验结果也相吻合。当质量分数增加到0.4mg/mL时,实验发现GNR- PEG-FA的细胞毒性明显高于GNR-PEG,这可能是由于GNR-PEG-FA与细胞的结合效率更高,通过细胞膜表面叶酸受体介导的内吞作用,摄入了大量的金纳米棒,从而扰乱了细胞的正常代谢,使得细胞活性明显下降[15]。
本文此处的毒性研究主要是为了排除GNR-PEG和GNR-PEG-FA本身对细胞存活的影响,从而证明是由于nsPEF和GNRs联合才导致其对肿瘤细胞杀伤效果的增强。除此之外,相关学者已经通过动物在体实验具体地研究了GNRs的生物毒性。Kopwitthaya等将不同质量分数的GNRs注射到Balb/c小鼠体内,然后分别通过对小鼠体重、肝肾功能检查、重要器官组织切片等手段来研究GNRs的毒性[16]。在体实验结果同样表明,当GNRs质量分数低于一定阈值时,未观察到任何病理性的变化,即在一定质量分数下GNRs是具有良好的生物相容性的,而该结论所描述的规律也与本文的体外细胞实验结果相类似,为今后本研究的体内实验提供了重要参考。
通过GNR-PEG和GNR-PEG-FA的紫外-可见光吸收光谱可以发现,两者最强的吸收峰均位于可见光波长之外(约820nm和830nm处),如图4所示。通过暗场显微镜对金纳米棒进行暗场成像后,金纳米棒散射出强度较强的可见光波长,其将位于横向等离子体共振峰(约520nm,绿光)左右以及纵向等离子体共振峰的前沿(约745nm,红光),两者强度相当。众所周知,当绿光和红光混合进入人眼时,人眼所识别到的则是黄色,这也就是实验所用的金纳米棒在暗场下大多呈现黄色的原因。由于黑色素瘤细胞表面叶酸受体的大量表达[10-11],使得叶酸对黑色素瘤细胞具有优秀的特异性靶向识别功能。因此,本研究选择叶酸修饰后的金纳米棒来实现其对A375黑色素瘤细胞的靶向识别作用。由于叶酸对A375黑色素瘤细胞的特异性识别作用,图5显示GNR- PEG-FA组具有更多的金纳米棒,聚集在肿瘤细胞的周围。与此同时,少量GNR-PEG也与细胞发生了结合,这是由于细胞膜本身具有负的静息电位,而聚乙二醇修饰后的金纳米棒表面带正电荷[17],两者之间存在静电作用从而导致一定量的结合,而且细胞本身对于这种纳米级别的异物也会进行胞吞,但是通过叶酸修饰过后的GNR-PEG-FA明显与A375黑色素瘤细胞具有更高的结合效率。
完整的细胞膜是一种主要由磷脂双分子层构成的半透性膜,其功能是防止细胞外的物质随意进出细胞和维持细胞内外离子质量分数的平衡。当脉冲电压作用在细胞上时,细胞膜就像电容充电一样,使得膜两端的正负电荷发生积累,导致细胞膜两端的电压上升。跨膜电压上升到一定阈值时[18-19],细胞膜将会发生穿孔,即电穿孔。当细胞膜上产生的电穿孔发展为不可逆时,失去了完整细胞膜的细胞将会死亡。而对于一个球型细胞而言,细胞跨膜电位在电场作用下的大小可以描述[20]为
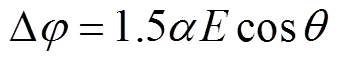 (1)
(1)式中,Dj 为电穿孔跨膜电压阈值;a 为球形细胞的直径;q 为细胞膜目标位置的法向方向与该位置受到电场E的方向之间的夹角,通常认为跨膜电压达到1V发生电穿孔[20]。
本文首先研究了nsPEFs联合GNRs棒对A375黑色素瘤细胞活性的影响,结果表明通过GNR- PEG-FA的引入,对nsPEFs杀伤A375黑色素瘤细胞具有极大的增强作用,而不具备靶向功能的GNR-PEG增强效果相对不明显。金纳米棒具有独特的棒状结构,由于“避雷针效应”,使得其处于电场当中时会在尖端产生的局部电场强度增强[21],即
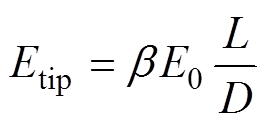 (2)
(2)式中,Etip、E0分别为尖端电场强度和外加均匀电场强度;L、D分别为金纳米棒的长度和外径;b 为 常数。
式(1)显示,对某一特定的细胞而言,影响细胞膜某一点的跨膜电位的主要因素是该位置所受到的电场强度的大小,即在其他脉冲参数不变的情况下,肿瘤细胞承受的电场强度越大,膜上承受的跨膜电压也就越高,越容易发生电穿孔。当膜上发生了不可逆电穿孔时,最终会引发一系列生物反应从而导致肿瘤细胞走向死亡[18-19]。
式(2)的“避雷针效应”则表明金纳米棒的尖端可以局部地增强电场强度,因此如果让更多的金纳米棒靠近肿瘤细胞周围或者进入肿瘤细胞内部,那么就会有更大的概率去增强肿瘤细胞内外膜的电场强度,从而提高对肿瘤细胞的杀伤效果。由于“避雷针效应”所增强的电场范围仅在金纳米棒两端的一定范围内有效,具有距离依赖性,所以为了更高效地利用金纳米棒的“避雷针效应”,本文通过将叶酸修饰到金纳米棒表面,使得修饰后的GNRs能够主动的聚集在细胞周围,提高了金纳米棒“避雷针效应”作用于细胞的概率,从而增强了nsPEFs对肿瘤细胞的电穿孔效应,提高了治疗效果。除此之外,由式(2)可知“避雷针效应”与金纳米棒的尺寸息息相关。金纳米棒的长径比越大,其尖端的电场强度越高,对电穿孔效应的增强效果也越好。同时,如果金纳米棒的尺寸差异过大会导致其增强效果的不确定性增加,进而影响了整体的治疗效果,因此在比较不同尺寸的金纳米棒的抗黑色素瘤功效以及如何进一步提高金纳米棒尺寸的一致性会是未来研究工作的重点之一。
除此之外,由于细胞膜可以等效成一个电容,其充电时间常数[22]为
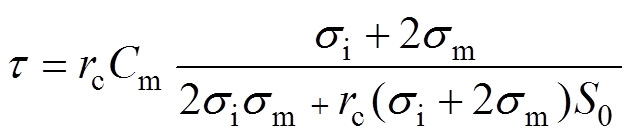 (3)
(3)式中,rc为细胞直径;Cm为膜表面电容;S0为细胞膜表面电导率;si和sm分别为细胞膜内部和细胞膜外部的电导率。
由图2所测得的电压、电流波形可知,金纳米棒的加入导致细胞周围环境的电导率升高。通过比较相同电压(1 200V)下的电流波形可以发现,加入了GNR-PEG和GNR-PEG-FA的电导率较nsPEFs单独处理组相比各增加了5%和4.7%。由式(3)可知,细胞外部电导率的升高会降低细胞膜的充电时间常数,即在相同的脉冲电压作用下,与金纳米棒混合的细胞能够在更短的时间内充电完成,也就是说细胞能够更快地发生电穿孔,从而减小了脉冲持续期间细胞发生穿孔所需的时间,进而提高了细胞膜发生电穿孔后的维持时间,细胞内外平衡失调的时间也更长,更容易引起细胞死亡。
众所周知,黑色素瘤细胞对其本身的细胞凋亡以及诱导肿瘤细胞凋亡的化疗药物都具有较强的抗性[23]。研究表明,当脉冲电场的宽度达到亚微秒级或纳秒级时,细胞膜对电场的屏蔽作用被极大削弱,脉冲电场能够透过细胞膜作用在细胞内部[24]。当线粒体、细胞核等细胞器受到足够强的脉冲电场作用时,细胞内部会发生钙离子的释放、DNA片段化等一系列细胞内部反应[25-26],同时也会激活细胞内部的一些与细胞凋亡密切相关的信号通路[24],从而诱导肿瘤细胞发生凋亡。凋亡的产生同样也归结于电穿孔效应[27],细胞内膜所受的脉冲电场强度越大,对细胞内膜造成的电穿孔效应越强[28-29],诱导细胞凋亡的比例也随之上升。从图5c可以看出,GNR- PEG-FA会进入到细胞内部,也就是说细胞内部的电场强度同样会增强,从而增强了细胞内膜的电穿孔效果,提高了细胞的凋亡率。正是由于大量的细胞发生凋亡,最终导致细胞活性明显下降,这与实验结果也相吻合,如图7和图8所示。
这项研究通过体外细胞实验证明了这种联合治疗方法的可行性。为了进一步将该方法扩展到临床应用,体内实验是必不可少的。因此,此处将为未来的体内研究添加一个设想。首先,Kopwitthaya等通过静脉注射研究了GNRs在荷瘤裸鼠体内的生物分布,发现GNRs本身具有在肿瘤当中聚集的趋势[16],而这可能是由于肿瘤附近血管更加丰富所导致的。其次,基于目前的暗场成像的结果,靶向修饰后的GNR-PEG-FA可以有效地靶向A375黑色素瘤细胞,因此可以推测GNR-PEG-FA在黑色素瘤组织中聚集的可能性很高。除此之外,根据电化学疗法中化疗药物的注射方法[30],通过瘤内注射而非静脉注射将GNR-PEG-FA注射入黑色素瘤组织中,可以进一步提高GNR-PEG-FA在肿瘤组织的聚集程度,以便更好地发挥其局部的电场增强效果。在GNR-PEG-FA能够成功聚集在目标肿瘤组织中的基础上,本文计划使用平板电极或针电极来进行脉冲的施加,并比较两种电极的疗效是否有所不同,从而为后续进一步临床实验打下基础。
总之,由于金纳米棒的“避雷针效应”和叶酸的靶向识别作用,使得一部分GNR-PEG-FA通过叶酸受体与细胞膜表面结合,另一部分GNR-PEG-FA通过叶酸所介导的胞吞作用进入细胞内部,从而分别有效地增强了细胞内膜和外膜承受的电场强度,提高了细胞内膜和外膜的电穿孔效应,进而诱导了更高百分比的凋亡,最终有效地抑制了肿瘤细胞的活性,增强了nsPEFs抗肿瘤的功效。但是,体外肿瘤细胞的研究无法准确地指导体内肿瘤的治疗,如何将nsPEFs联合靶向金纳米棒这一物理治疗方法应用到体内肿瘤的治疗仍旧会是以后研究的重点。
本文首次将具有靶向作用的GNR-PEG-FA与nsPEFs联合来杀伤肿瘤细胞,目的是为了改善nsPEFs在治疗过程中存在的电气安全性问题。在确定了GNR-PEG和GNR-PEG-FA安全质量分数的基础上,将nsPEFs分别与GNR-PEG和GNR-PEG-FA联合来处理A375细胞,然后通过检测处理后的细胞活性和凋亡来评估这一联合治疗方法的可行性。研究表明,具有靶向作用的GNR-PEG-FA与nsPEFs联合表现出最佳的抗黑色素瘤细胞效果,在较低的电场强度和较少的脉冲个数下,能够更加显著地提高肿瘤细胞的凋亡率,进而更有效地抑制肿瘤细胞的活性。通过离体细胞实验初步验证了这一联合治疗方法的可行性,为后续体内治疗的研究提供了依据,此物理联合治疗方法有望成为一种更安全、更高效的肿瘤治疗方法。
参考文献
[1] Beebe S J, Fox P M, Rec L J, et al. Nanosecond pulsed electric field (nsPEF) effects on cells and tissues: apoptosis induction and tumor growth inhibition[J]. IEEE Transactions on Plasma Science, 2002, 30(1): 286-292.
[2] 米彦, 彭文成, 芮少琴, 等. 高频纳秒脉冲串作用下皮肤肿瘤热效应的多参数有限元仿真与实验[J]. 电工技术学报, 2017, 32(22): 264-274.
Mi Yan, Peng Wencheng, Rui Shaoqin, et al. Thermal effects in skin tumor exposed to high-frequency nanosecond pulse bursts: multi-parametric finite element simulation and experiment[J]. Transactions of China Electrotechnical Society, 2017, 32(22): 264- 274.
[3] Zhu Shijin, Kisiel W, Lu Yangjing, et al. Tumor angiogenesis therapy using targeted delivery of paclitaxel to the vasculature of breast cancer metastases[J]. Journal of Drug Delivery, 2014(1): 1-12.
[4] Buescher E S, Schoenbach K H. Effects of submi- crosecond, high intensity pulsed electric fields on living cells-intracellular electromanipulation[J]. IEEE Transactions on Dielectrics and Electrical Insulation, 2003, 10(5): 788-794.
[5] 吴子剑, 王晨, 张明艳, 等. 环氧树脂纳米复合材料界面及其对电性能影响分析[J]. 电工技术学报, 2018, 33(16): 3897-3905.
Wu Zijian, Wang Chen, Zhang Mingyan, et al. Interface of epoey resin composites, and its influence on electrical performance[J]. Transactions of China Electrotechnical Society, 2018, 33(16): 3897-3905.
[6] Qiu Hao, Joshi R P, Pradhan A. Simulation of nanoparticle based enhancement of cellular electro- poration for biomedical applications[J]. Journal of Applied Physics, 2014, 116(18): 184701.
[7] Rolong A, Prokop K J, Davalos R V. Impact of the use of nanoparticles on electric field distribution during irreversible electroporation treatments: can the lesion be enhanced beyond IRE margin[C]//6th European Conference of the International Federation for Medical and Biological Engineering, Dubrovnik, 2015: 44-54.
[8] Huang Shuyang, Deshmukh H, Rajagopalan K K, et al. Gold nanoparticles electroporation enhanced poly- plex delivery to mammalian cells[J]. Electrophoresis, 2014, 35(12-13): 1837-1845.
[9] Tiwari P K, Soo Lee Y. Gene delivery in conjunction with gold nanoparticle and tumor treating electric field[J]. Journal of Applied Physics, 2013, 114(5): 054902.
[10] Aitziber B. Molecular mechanism implicated in pemetrexed-induced apoptosis in human melanoma cells[J]. Molecular Cancer, 2012, 11(1): 25-40.
[11] Luis S, Montenegro M F, Cabezas H J, et al. The critical role of alpha-folate receptor in the resistance of melanoma to methotrexate[J]. Pigment Cell & Melanoma Research, 2009, 22(5): 588-600.
[12] Mi Yan, Wan Hui, Bian Changhao, et al. An MMC- based modular unipolar/bipolar high-voltage nanose- cond pulse generator with adjustable rise/fall time[J]. IEEE Transactions on Dielectrics and Electrical Insulation, 2019, 26(2): 515-522.
[13] Niidome T, Yamagata M, Okamoto Y, et al. PEG- modified gold nanorods with a stealth character for in vivo applications[J]. Journal of Controlled Release, 2006, 114(3): 343-347.
[14] Li Zhibin, Tang Siying, Wang Beike, et al. Metabo- lizable small gold nanorods: size-dependent cytotoxi- city, cell uptake and in vivo biodistribution[J]. ACS Biomaterials Science & Engineering, 2016, 2(5): 789-797.
[15] Selvaraj K, Prasad R, Agawane S, et al. In vivo examination of folic acid-conjugated gold-silica nanohybrids as contrast agents for localized tumor diagnosis and bio-distribution[J]. Bioconjugate Chemi- stry, 2018, 29(1): 4012-4019.
[16] Kopwitthaya A, Yong K T, Hu Rui, et al. Biocom- patible pegylated gold nanorods as colored contrast agents for targeted in vivo cancer applications[J]. Nanotechnology, 2010, 21(31): 315101.
[17] Arnida, Malugin A, Ghandehari H. Cellular uptake and toxicity of gold nanoparticles in prostate cancer cells: a comparative study of rods and spheres[J]. Journal of Applied Toxicology, 2010, 30(3): 212- 217.
[18] Freeman S A, Wang M A, Weaver J C. Theory of electroporation of planar bilayer membranes: predi- ctions of the aqueous area, change in capacitance and pore-pore separation[J]. Biophysical Journal, 1994, 67(1): 42-56.
[19] 姚陈果, 吕彦鹏, 赵亚军, 等. 基于能量概率与微孔力模型的脉冲电场对细胞电穿孔动态过程的仿真分析[J]. 电工技术学报, 2016, 31(23): 141-149.
Yao Chenguo, Lü Yanpeng, Zhao Yajun, et al. Simulation analysis on dynamic process of elec- troporation by the model based on energy probability and pore force in cell exposed to pulsed electric field[J]. Transactions of China Electrotechnical Society, 2016, 31(23): 141-149.
[20] Debruin K A, Krassowska W. Modeling electro- poration in a single cell effects of field strength and rest potential[J]. Biophysical Journal, 1999, 77(3): 1213-24.
[21] Rojas C, Jose A, Correa D M A, et al. Enhanced introduction of gold nanoparticles into vital acido- thiobacillus ferrooxidans by carbon nanotube-based microwave electroporation[J]. Nano Letters, 2004, 4(5): 985-988.
[22] Aude S, Isebelle L, Michael L, et al. Cell membrane permeabilization by 12-ns electric pulses: not a purely dielectric, but a charge-dependent pheno- menon[J]. Bioelectrochemistry, 2015, 106: 369-378.
[23] Alexander V A, Alexander N S, Igor V M, et al. Activity of 2-aryl-2-(3-indolyl) acetohydroxamates against drug-resistant cancer cells[J]. Journal of Medicinal Chemistry, 2015, 58(5): 2206-2220.
[24] Schoenbach K H, Hargrave B, Joshi R P, et al. Bioelectric effects of intense nanosecond pulses[J]. IEEE Transactions on Dielectrics and Electrical Insulation, 2007, 14(5): 1088-1109.
[25] Schoenbach K H, Beebe S J, Buescher E S. Intracellular effect of ultrashort electrical pulses[J]. Bioelectromagnetics, 2010, 22(6): 440-448.
[26] Sundararajan R. Nanosecond electroporation: another look[J]. Molecular Biotechnology, 2009, 41(1): 69-82.
[27] 刘红梅, 姚陈果, 董守龙, 等. 基于测量信号的不可逆电穿孔动态过程数值模拟及分析[J]. 电工技术学报, 2019, 34(18): 3732-3740.
Liu Hongmei, Yao Chenguo, Dong Shoulong, et al. Dynamic numerical modeling and analyzing on the process of irreversible electroparation based on measurement signal[J]. Transactions of China Electrotechnical Society, 2019, 34(18): 3732-3740.
[28] 米彦, 徐进, 刘洪亮, 等. 基于网格传输网络模型的高频纳秒脉冲串作用下单细胞穿孔特性仿真[J]. 电工技术学报, 2018, 33(18): 4217-4230.
Mi Yan, Xu Jin, Liu Hongliang, et al. Simulation of performance features in a single-cell system exposed to high-frequency nanosecond pulsed bursts based on mesh transport network model[J]. Transactions of China Electrotechnical Society, 2018, 33(18): 4217- 4230.
[29] 米彦, 李盼, 刘权, 等. 纳秒脉冲电场联合多壁碳纳米管对皮肤癌细胞活性的剂量效应研究[J]. 电工技术学报, 2019, 34(22): 4849-4857.
Mi Yan, Li Pan, Liu Quan, et al. Dose effect of the activity of skin cancer cells treated by nanosecond pulsed electric field combined with multi-walled carbon nanotubes[J]. Transactions of China Electro- technical Society, 2019, 34(22): 4849-4857.
[30] Janja D, Janja V, SanCar J, et al. Connecting the in vitro and in vivo experiments in electrochemotherapy- a feasibility study modeling cisplatin transport in mouse melanoma using the dual-porosity model[J]. Journal of Controlled Release, 2018, 286: 33-45.
Study of Killing Effects of A375 Melanoma Cells Treated by Low Intensity Nanosecond Pulsed Electric Fields Combined with Targeted Gold Nanorods
Abstract To improve the electrical safety associated with nanosecond pulsed electric fields (nsPEFs) in tumor treatment, for the first time, the killing effects of low-intensity nsPEFs combined with folic acid (FA) modified gold nanorods on A375 melanoma cells were investigated. The surface of polyethylene glycol-gold nanorods (GNR-PEG) was modified by folic acid (GNR-PEG-FA) to target A375 melanoma cells, and the binding efficacy was observed by dark field microscopy. After determining the safe concentrations of GNR-PEG and GNR-PEG-FA, the effects of the combined treatment on cell viability and apoptosis were studied by changing electric field strengths (2~8kV/cm) and pulse numbers (15~260). It is found that the combination of low-intensity nsPEFs and GNR-PEG-FA shows the best antitumor efficacy, resulting in lower percentages of viable cells and higher percentages of apoptosis at lower electric field strengths and fewer pulses. This combined treatment enhances the killing effects of A375 melanoma cells and improves the electrical safety of nsPEFs treatment.
keywords:Gold nanorods, nanosecond pulsed electric fields, cell viability, apoptosis, folic acid, A375 melanoma cells
中图分类号:TM836; Q64
DOI: 10.19595/j.cnki.1000-6753.tces.190584
国家自然科学基金(51477022)、中央高校基本科研业务费(2019CDXYDQ0010)和重庆市科委自然科学基金(cstc2016jcyjA0500)资助项目。
收稿日期 2019-05-14
改稿日期 2019-12-24
米 彦 男,1978年生,教授,博士生导师,研究方向为高电压新技术。E-mail: miyan@cqu.edu.cn(通信作者)
刘 权 男,1995年生,硕士研究生,研究方向为高电压新技术。E-mail: 20171102050t@cqu.edu.cn
(编辑 陈 诚)