0 引言
随着生物电磁学的不断发展,脉冲电场的非热生物医学效应得到研究学者的广泛关注。依据脉冲电场对细胞内外膜独特的调控功能[1-2],微秒脉冲诱导的不可逆电穿孔技术[3]以及纳秒脉冲诱导细胞凋亡效应[4]逐渐应用到肿瘤治疗领域,并以微创、选择性、无毒性、可控性等优势展现出良好的发展前景与临床应用价值。
微秒脉冲电场(Mirosecond Pulses Electric Field,μsPEF)(0.5 ~3kV/cm)具有靶向作用于细胞膜的特点,当其作用在细胞外膜时,可以诱导博来霉素及顺铂等细胞毒性物质进入细胞内部,从而实现相对安全的靶向消融肿瘤[5-8]。同时,微秒脉冲电场作用到细胞膜后,能使得质粒DNA转染成功,且能诱导外源性蛋白进入细胞内部[9-12]。重庆大学课题组在国内外最早对微秒脉冲诱导 IRE(irreversible electroporation)在肿瘤治疗领域的应用进行了相关的研究[13-15],不可逆电穿孔通过破坏细胞膜结构使细胞坏死[16-19],其主要采用电极针或者平板电极将电场传递到靶区。IRE具有无热损伤[19]、正常组织无伤害、治愈无疤痕等优点。当脉冲宽度降低至ns级,电场强度在10~100kV/cm的高压脉冲时(Nanosecond Pulses Electric Field, nsPEF),由于脉冲宽度较窄,频率含量高[20],可透过细胞膜的屏蔽作用,使电场作用到细胞胞内,靶向作用于胞内细胞器,将会诱导与微秒脉冲截然不同的生物电效应[21],如:内部颗粒的通透性;内源性液泡[22]、细胞的收缩及肿胀[23];细胞核的DNA受损;细胞坏死或凋亡[24]。基于微/纳秒脉冲电场截然不同的作用机理,当微/纳秒脉冲电场作用在不同类别的肿瘤时,由于细胞本身具有的物理特性及电特性的差异,将会引起细胞内外膜的电穿孔效应差异。
目前,国内外对脉冲电场作用于不同的肿瘤细胞所体现出的电敏感性差异(脉冲电场作用后,细胞的内外膜响应)进行了相关的研究,不同类别的肿瘤细胞具有不同的细胞特性,例如,细胞的大小、细胞核大小、细胞的几何形状、细胞的胞内细胞器的几何形态等存在明显差异,因此脉冲电场作用在不同类别的细胞上所诱导的电穿孔效果也存在差异。在2007年,E. A. Weber等提出细胞所处的实验条件以及细胞的特性(形状和大小)会影响细胞的活性和电穿孔效果[25]。细胞尺寸越大,其在毫秒脉冲电场作用下细胞膜更容易具有通透性,且细胞的存活率会下降。在2010年,A. G. Pakhomov等发现当脉宽取1.8μs或 9μs时,细胞的杀伤效果较脉宽取 10ns或300ns更好,且纳秒脉冲作用到 jurket细胞和 U937细胞时会表现出选择性,而微秒脉冲作用时不能体现出选择性[26]。2015年,J. W. Ivey等通过开展凝胶实验,发现高频双极性脉冲作用在相同尺寸的肿瘤细胞时,因不同肿瘤细胞对应的恶性程度不同(细胞核越大,细胞的恶性程度越大),电场作用后所体现出的电敏感性不同,细胞的恶性程度越大,脉冲电场作用时其对应的穿孔阈值电场强度越小[27]。同时,当脉宽为1μs的高频双极性脉冲与脉宽为100μs的单极性脉冲作用在两种不同尺寸的细胞时,单极性脉冲作用后两种细胞膜上的跨膜电位会存在明显的差异,而高频双极性脉冲作用后两种细胞膜上跨膜电位几乎相同[27]。这些研究均表明细胞的几何形态特征差异会使脉冲作用的效果也存在差异。
然而,上述 J. W. Ivey等的研究主要聚焦于细胞形态差异对 HFIRE(~1μs)的生物电效应影响。E.A. Weber等的研究则主要以基因转染为应用背景,从实验角度发现不同尺寸的细胞在典型 DNA转染的脉冲电场(毫秒脉冲)下诱导细胞外膜电穿孔响应的差异,但对其差异的机理尚未阐述。同理,A.G. Pakhomov等也仅从实验角度说明了纳秒脉冲作用于 jurket细胞和 U937细胞会诱导不同的杀伤效果。综上可知,以上研究内容更多的是从细胞杀伤、基因转染效率等宏观效果来分析脉冲电场作用于不同细胞的电敏感性差异,而缺乏从理论角度以及单细胞层面作用来阐释其内在原因。因此,针对微/纳秒脉冲电场独特的靶区作用生物效应,通过电穿孔数值模型[28]、等效电路模型[29]等研究其在作用于不同尺寸细胞的电响应特性及实验机理是对前人研究的深入与完善,同时,在临床应用中,面对不同类别的肿瘤细胞时,如何根据细胞的几何特性择优选取最适合的脉冲治疗方式具有重要意义。
因此,本文首次结合理论与实验研究,基于细胞的五层介电模型及细胞内外膜的电穿孔数值模型,对比分析了微/纳秒脉冲电场下诱导细胞膜以及细胞核膜的电穿孔效应,发现了两种脉冲电场对细胞尺寸存在选择性,并首次开展了微/纳秒脉冲电场诱导不同的细胞内外膜电穿孔效应差异研究,验证了微/纳秒脉冲电场对不同尺寸的细胞以及细胞核的电穿孔效应差异。
1 模型建立与实验设计
1.1 数值模型与仿真建立
1.1.1 微/纳秒脉冲电场下细胞内外膜电穿孔模型建立
本文利用COMSOL Multiphysics软件建立了五层介电模型,如图1所示。图1为考虑胞内细胞器(细胞核)球形单细胞多层介电模型,利用电流模块进行瞬态分析,作用在细胞上的电场强度是由两个铜电极板施加,两个电极的间距是 0.2cm,其中一个电极接地,另一个电极接脉冲信号。细胞所在的所有区域的边界均设置为电绝缘,以此来保证电极间的电场是一个均匀电场。本文仿真模型的剖分网格为三角形,剖分单元为6 245域单元。仿真中使用偏微分模块(PDE模块)中系数型边界偏微分方程,通过此方程建立动态的电穿孔数值模型[30-33],对其靶向细胞内外膜的电穿孔效应,包括跨膜电位、孔密度及穿孔区域进行了分析。
上述使用偏微分方程建立的电穿孔数值模型思路如下:

图1 球形单细胞五层介电模型
Fig.1 Spherical single cell five-layer dielectric model
当细胞膜以及核膜对应的跨膜电势到达穿孔阈值(1V)[34]后,就会使内外膜的孔密度增加,导致膜的电导率以及通透性的增加,此时有更多的电流从形成的微孔中流过,从而跨膜电流密度J(t)增加,可用JEP(t)表征J(t)的增量。
式中,σmem0为未穿孔前细胞膜的电导率;ε0为真空介电常数;εm为细胞膜的相对介电常数;dmem为细胞膜的厚度; ψi为细胞膜内侧电位;ψo为细胞膜外侧电位。
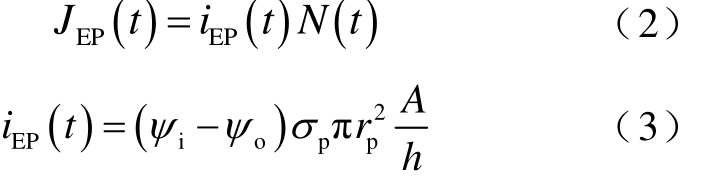
式中,iEP(t)为流过单个孔的电流;N(t)为膜的穿孔密度;σp为空隙电导率;rp为穿孔孔半径。N(t)可通过式(4)求解。

将式(3)和式(4)代入式(2)得
式中,σmem(t)为细胞膜穿孔后的电导率,![]()
![]()
1.1.2 微/纳秒脉冲靶向不同尺寸细胞的穿孔效应仿真建立
为了研究微/纳秒脉冲参数作用下,细胞尺寸对细胞内外膜电穿孔效应的影响,本文建立了上述几何模型以及电穿孔数值模型,通过仿真对比分析不同尺寸的细胞及细胞核在微秒脉冲电场(1.5kV/cm,100μs)及纳秒脉冲(15kV/cm,400ns)下的电穿孔效应。仿真使用的细胞几何参数如下:细胞半径Rc为 10μm、7.5μm、6μm;细胞尺寸大小保持不变(Rc=7.5μm),细胞核半径 Rn为 5.5μm、4μm。利用参数扫描的方式研究在细胞膜及细胞核膜的极点A1、B1处跨膜电位分布以及脉冲作用的最后时刻,不同尺寸的细胞外膜及细胞核膜形成的孔密度,根据其孔密度大小的分布确定其穿孔区域。
1.2 实验材料与方法
1.2.1 细胞培养
实验用的人肺癌细胞A549细胞及顺铂(2μg/mL)耐药的肺癌细胞A549(简称为ant-A549)由第三军医大学新桥医院全军呼吸内科研究所惠赠。A375及B16细胞,A549及 ant-A549在内含联合双抗(100μg/mL青霉素和 100μg/mL链霉素,Gibco)和10%的灭活胎牛血清(Fetal Bovine Serum, Qualified,Australia Origin)的 F-12K培养基(Ham's F-12K(Kaighn's) Medium, Gibco,美国)中,置于37℃、5%CO2的饱和湿度培养箱常规培养。A375及B16细胞在内含联合双抗(100μg/mL青霉素和100μg/mL链霉素,Gibco)和10%的灭活胎牛血清(Fetal Bovine Serum,Qualified, Australia Origin)的 DMEM(Dulbecco's modified eagle medium)培养基中,置于37℃、5%CO2的饱和湿度培养箱常规培养。
1.2.2 细胞的几何形态成像
本文通过荧光显微镜观察获取A375、A549、B16细胞的形态如图2所示。由图2所示特征发现,三种细胞尺寸存在明显差异(见图2a),其中B16细胞直径最大,约为20μm;A375细胞直径最小,约为12μm;A549细胞直径约为 15μm。同时也观察获取了两种同源细胞A549和耐药A549的形态特征发现,A549与耐药A549两种细胞,细胞尺寸无差异,但细胞核大小存在显著差异(见图 2b),A549细胞核直径约为8μm,而耐药A549细胞核直径约为10μm。

图2 细胞几何形态成像
Fig.2 Cell geometry imaging
1.2.3 细胞膜及细胞核膜的荧光染色实验
本文选取细胞膜红色荧光探针 DIL与 hoechst 33442两种荧光分子探针,其分别针对细胞外膜及细胞核膜进行染色,可通过荧光消散程度表征脉冲电场对细胞外膜及细胞核膜的破坏程度[35-36],因此仿真结果得出内外膜上形成的孔密度分布及穿孔区域大小可在一定程度上定性地解释荧光消散程度。实验中取对数生长期的A375、A549、B16、Ant-A549四种细胞,用体积分数为0.25%的胰蛋白酶(0.25%Trypsin-EDTA, Phenol Red, Gibco,美国)消化后离心,其中A375、A549、B16三种细胞中加入1ml的DIL染色;A549、ant-A549两种细胞中加入1mL的hoechst33442(bisBenzimide H 33342)染料对其细胞核膜进行染色。并将离心管放入孵箱中静待20~30min,染色完成后,使用磷酸缓冲盐溶液(Phosphate Buffer Saline,PBS)缓冲液清洗 2~3次。对悬液进行染色处理后,重新加入2mL新鲜培养基,放入微电极(长35mm×宽5.4mm×厚1.6mm,中心电极长5mm×厚1.6mm,电极间距2mm),采用2mm间距的板电极施加表1所示的脉冲电场。通过荧光显微镜(Leica DMi8,德国)的时间序列功能实时进行观察,获取细胞外膜在80s内荧光消散动态过程且记录每间隔20s对应的荧光强度值;同时,获取细胞核膜在60s内荧光消散动态过程且记录每间隔15s对应的荧光强度值;每组实验重复三次。
表1 实验脉冲参数
Tab.1 Experimental pulse parameter

序列 幅值/ V 电场强度/( kV/cm) 脉宽/ns 数量1 300 1.5 100 000 90 2 3 000 15 400 80
2 结果与分析
2.1 微/纳秒脉冲电场靶向不同尺寸细胞的电穿孔效应
本文使用脉宽100μs、电场强度1.5kV/cm的微秒脉冲及脉宽为400ns、电场强度15kV/cm的纳秒脉冲研究因细胞尺寸不同引起的电穿孔效应差异。图3所示为微秒脉冲参数下细胞外膜的孔密度及跨膜电位的分布。根据仿真结果知:在极点A1处,随着细胞尺寸增大,其孔密度增加,且跨膜电位更快地达到稳定值,且稳定值更小(见图3a),主要因经历穿孔后细胞外膜上微孔密度增大,此时流经微孔的总电流也增加,因此跨膜电位的稳定值变小;同时,分析整个细胞外膜表面的孔密度分布可知,其穿孔区域随着细胞尺寸的增加而增加(见图3b),当细胞尺寸由 6μm 增加至 7.5μm、10μm 时,其穿孔区域由 0°~60°变为 0°~64°、0°~70°,由此可知,细胞的电响应明显增强且具有显著性差异。对于纳秒脉冲,其可同时诱导胞内细胞器膜及细胞外膜的穿孔效应,但细胞尺寸增大,其孔密度几乎不变,且跨膜电位降为稳定值的速率及稳定值几乎无差异(图 4a),同时,细胞外膜表面对应的穿孔区域几乎不变(图4b)。因此,纳秒脉冲作用下,不同尺寸的细胞外膜电响应速度及强度无显著性差异。
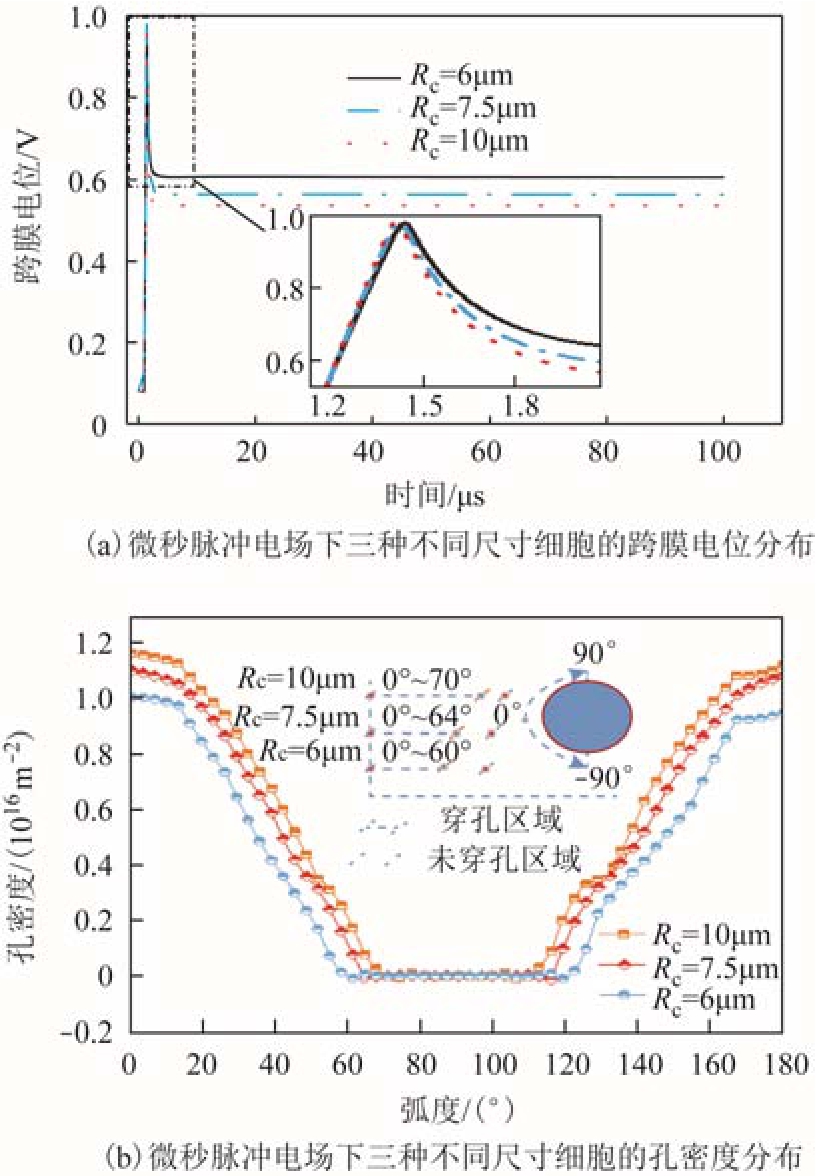
图3 微秒脉冲电场作用下三种不同尺寸细胞的电响应
Fig.3 Electrical response of three different size cells under microsecond pulsed electric field


图4 纳秒脉冲电场作用下三种不同尺寸细胞的电响应
Fig.4 Electrical response of three different size cells under nanosecond pulsed electric field

图5 两种脉冲电场作用下三种细胞的荧光消散情况
Fig.5 Fluorescence dissipation of three cells under two pulsed electric fields
同时,图5分析对比了A375、A549、B16三种不同尺寸的细胞在上述两种脉冲电场作用下细胞外膜荧光消散的动态变化过程。由图6a可知,该微秒脉冲电场对三种尺寸不同的细胞外膜电穿孔效果具有显著性差异。根据在90s内细胞膜荧光强度值的变化可知,0~90s中,随着脉冲的施加,B16细胞(20μm)荧光强度值下降86.24%,而 A549(15μm)与A375(12μm)细胞的荧光强度值分别下降 74.02%、66.67%。由此可知,在微秒脉冲作用下,细胞尺寸越大,所体现出的电敏感性越强,即电穿孔效果更好。由图6b可知,该纳秒脉冲电场对三种尺寸不同的细胞膜电穿孔效果无显著性差异,根据在90s内细胞膜荧光强度值的变化可知,在t=0s和t=80s时,B16细胞荧光强度值下降了 67.55%,而 A549与A375细胞的荧光强度值分别下降了 67.34%、64.31%。由此可知,在纳秒脉冲作用下,不同尺寸的细胞其电敏感性无显著差异。

图6 两种脉冲电场下三种细胞对应的荧光强度值
Fig 6 The fluorescence intensity of three cells under two pulsed electric fields
2.2 微/纳秒脉冲电场靶向不同尺寸细胞核的电穿孔效应
本文使用脉宽100μs、电场强度1.5kV/cm的微秒脉冲及脉宽为400ns、电场强度15kV/cm的纳秒脉冲研究因细胞核尺寸不同引起的电穿孔效应差异,两种不同尺寸的细胞核的电响应如图 7所示。由于细胞核膜的充电时间很短,所以当微秒脉冲作用在细胞核膜上时,细胞核膜电响应较弱。而对于纳秒脉冲,其可靶向作用于细胞核膜,由仿真结果可知:在极点B1处,随着细胞核尺寸增大,其穿孔后孔密度增加,且跨膜电位更快地降为稳定值,其稳定值更小(见图7a),主要是因为经历电穿孔过程后在细胞外膜上形成的孔密度较大,导致流过孔的总电流也较大,因此跨膜电位下降的程度也随之增大;同时,分析在整个细胞核膜表面的孔密度分布,可知其穿孔区域随着细胞核尺寸的增加而增加,当细胞核尺寸由 4μm 增加至 5.5μm,其穿孔区域由0°~38°变为 0°~65°(见图 7b)。由此可知,纳秒脉冲靶向作用于不同尺寸的细胞核时,其电响应强度具有显著性差异。

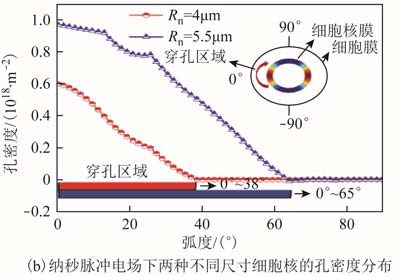
图7 纳秒脉冲电场作用下两种不同尺寸的细胞核的电响应
Fig.7 Electrical response of two different sizes of nuclei under ns pulsed electric field
同时,分析对比两种细胞尺寸相同而细胞核尺寸不同的 A549与耐药 A549在上述两种脉冲电场作用下细胞核膜荧光消散的动态变化过程,如图 8所示。由图8可知,在该纳秒脉冲电场作用下,两种细胞核膜的电穿孔效果有差异性。图9为纳秒脉冲电场下两种细胞对应的荧光强度值。根据两种细胞核膜荧光强度值的变化可知,在t=0s和t=80s时,耐药型 A549细胞的荧光强度值下降 92.13%,而A549细胞荧光强度值下降了 84.59%。由此可知,耐药型 A549体现出的电敏感性更强。根据 80s内两种细胞核膜荧光强度值的变化可知,在0~80s中,耐药型A549细胞荧光强度值下降了3.56%,而A549细胞荧光强度值下降了3.18%。因此当微秒脉冲作用在细胞核膜上时,其穿孔效应较弱。

图8 两种脉冲电场作用下两种细胞的荧光消散情况
Fig.8 Fluorescence dissipation of two cells under two pulsed electric fields

图9 纳秒脉冲电场下两种细胞对应的荧光强度值
Fig.9 The fluorescence intensity values of two cells under two ns pulsed electric fields
3 讨论
当微秒脉冲与纳秒脉冲同时作用在三种尺寸不同的细胞对应的细胞膜上时,其产生的电穿孔效果有明显的差异。当微秒脉冲电场作用时,由于细胞尺寸不同,三种细胞的电穿孔效果具有显著性差异,细胞尺寸越大,电穿孔效果越好,主要原因为细胞半径越大,细胞膜上形成的跨膜电位越大,更容易达到穿孔的阈值,所以细胞体现出的电敏感性越强。本文通过仿真发现,细胞尺寸越大,其在细胞膜上产生的孔密度以及穿孔区域更大(图3a),与实验结果得出的结论相符。纳秒脉冲电场同样能作用在细胞膜上,但无法体现出因尺寸不同引起的电穿孔效果的差异。通过仿真发现,纳秒脉冲电场作用下,细胞膜的孔密度及穿孔区域几乎不存在差异(图3b),推测是当电场强度足够大时,细胞尺寸的差异引起的跨膜电位以及孔密度在整个细胞外膜上的分布差异较小,且在该参数下细胞核的电响应可能影响纳秒脉冲电场在细胞外膜产生的效果。当纳秒脉冲作用在细胞膜上时,三种细胞对应的荧光强度值的减弱程度较微秒脉冲电场作用时低。由此可知,微秒脉冲电场作用时的靶区主要为细胞外膜,对其破坏更大。本文中的纳秒脉冲电场参数,由于脉宽为亚微秒级,其宽度小于细胞膜的充电时间常数(~1μs),此时较强能量作用于细胞核膜且产生纳米孔,所以纳秒脉冲电场更多的是通过高频透膜效应而靶向作用于胞内细胞器膜。
当微秒脉冲与纳秒脉冲同时作用在两种尺寸不同的细胞核对应的细胞核膜上时,其产生的电穿孔效果有显著性差异。当微秒脉冲作用时,对比t=0s与t=80s,细胞核膜上荧光强度值几乎不变。由于细胞核膜充电时间很短,当脉宽为100μs时,在短时间内细胞核膜无法充电完成,而细胞膜充电完成后,对细胞核有屏蔽作用,即在整个脉冲作用期间,细胞核膜上几乎没有电响应。但纳秒脉冲作用时,会在细胞核膜上产生很强的电响应,且细胞核越大,细胞的电敏感性越强,其对应的荧光强度消散更明显。推测是由于细胞核大小的改变,导致细胞质的等效电导率改变,进而细胞核膜的充电时间常数改变,引起了核膜上跨膜电位分布的变化,因此细胞核膜上穿孔区域也随之改变,体现出显著的差异。
为了从电气角度研究分析细胞的电穿孔过程,一般将细胞等效为一个 RC电路模型。本文选取了四种不同类别的细胞,其电特性均存在差异且各组介电参数也不同。细胞内外等效膜电容 Cm是直接与细胞本身的介电参数有关的物理量,由此可知,不同的细胞其内外膜等效膜电容不同,将会直接影响细胞外膜的充电时间常数[37],进而影响跨膜电位的建立及孔密度分布。当细胞膜电容越大,其时间常数越大,电响应速度更慢且电穿孔效果较差。但本文尚未开展测量各细胞对应的介电参数的研究,因此无法定量地去分析不同的膜电容引起的细胞电穿孔效应差异。
若将本文的研究内容拓展到实际的临床应用中时,可在一定程度上为不同类型的肿瘤细胞的杀伤提供参数选择依据与理论支撑。针对细胞膜尺寸较大的肿瘤细胞时,可采用微秒脉冲电场诱导细胞外膜产生较强的电穿孔效应,在保证消融效果的前提下可降低电场强度幅值,避免过量治疗;而针对恶性程度较大的肿瘤细胞即细胞核尺寸较大[38],可通过纳秒脉冲电场直接靶向作用于细胞核膜,诱导其产生更强的电穿孔效应,可能将达到更好的治疗效果。
本文从实验以及理论分析角度开展了微/纳秒脉冲电场靶向不同尺寸肿瘤细胞内外膜电穿孔效应的研究,阐述了其作用于不同尺寸的细胞及细胞核所体现出的电穿孔效应差异的原因,发现微秒脉冲电场靶向选择作用于尺寸更大的细胞,纳秒脉冲电场靶向选择作用于细胞核尺寸更大的细胞。但不同的肿瘤细胞具有不同的形态特征,即细胞的形状和大小及胞内细胞器的的几何形态都存在差异,导致脉冲电场作用下的电响应特性存在差异,本文尚未考虑微/纳秒脉冲电场对细胞的几何形态及胞内细胞器的选择性。同时,本文也未能考虑细胞电气特性的差异所引起的电穿孔效应差异,在后期将进一步从细胞本身的物理特性及电特性两方面进行研究,不断完善微/纳秒脉冲电场作用下靶向选择诱导细胞电穿孔机理。
4 结论
本文以球形单细胞五层介电模型的仿真分析及以两组细胞为研究对象开展的单细胞层面的实验,分析了在微/纳秒脉冲电场刺激下,其细胞膜以及细胞核膜的电穿孔效应,得出以下结论:①微秒脉冲的作用靶区主要在细胞膜,当细胞膜尺寸不同时,所体现出的电敏感性也不同,细胞尺寸越大,对应的电敏感性越强,电穿孔效果越好;②纳秒脉冲电场作用在不同尺寸的细胞对应的细胞外膜上时,其电穿孔效果没有显著性差异;③纳秒脉冲的作用靶区在细胞核膜,当细胞核尺寸不同时,所体现出的电敏感性不同,细胞核越大,对应的敏感性越强即电穿孔效果越好。
[1] Markelc B, Sersa G, Cemazar M. Differential mechanisms associated with vascular disrupting action of electrochemotherapy: intravital microscopy on the level of single normal and tumor blood vessels[J]. Plos One, 2013, 8(3): e59557.
[2] 董守龙, 姚陈果, 杨楠, 等. 基于Marx电路的全固态纳秒脉冲等离子体射流装置的研制[J]. 电工技术学报, 2016, 31(24): 35-44.Dong Shoulong, Yao Chenguo, Yang Nan, et al.Development of a solid-state nanosecond pulsed plasma jet device based on Marx circuit[J].Transactions of China Electrotechnical Society, 2016,31(24): 35-44.
[3] Li Chengxiang, Yao Chenguo, Sun Caixin, et al.Dependence on electric field intensities of cell biological effects induced by microsecond pulsed electric fields[J]. IEEE Transactions on Dielectrics &Electrical Insulation, 2012, 18(6): 2083-2088.
[4] Yao Chenguo, Hu Xiaoqian, Mi Yan, et al. Window effect of pulsed electric field on biological cells[J].IEEE Transactions on Dielectrics and Electrical Insulation, 2009, 16(5): 1259-1266.
[5] Bowman A M, Nesin O M, Pakhomova O N, et al.Analysis of plasma membrane integrity by fluorescent detection of Tl(+) uptake[J]. Journal of Membrane Biology, 2010, 236(1): 15-26.
[6] Kander M, Miklav D, Pavlin M. Mechanisms involved in gene electrotransfer using high- and low-voltage pulses—an in vitro study[J]. Bioelectrochemistry,2009, 74(2): 265-271.
[7] André F M, Gehl J, Sersa G, et al. Efficiency of high and low-voltage pulse combinations for gene electrotransfer in muscle, liver, tumor, and skin[J].Human Gene Therapy, 2008, 19(11): 1261-1272.
[8] Rubinsky B, Onik G, Mikus P. Irreversible electroporation: a new ablation modality clinical implications[J]. Technology in Cancer Research &Treatment, 2007, 6(1): 37-48.
[9] Heller R, Jaroszeski M J, Reintgen D S, et al.Treatment of cutaneous and subcutaneous tumors with electrochemotherapy using intralesional bleomycin[J].Cancer, 2015, 83(1): 148-157.
[10] Chopinet L, Batista-Napotnik T, Audrey M.Nanosecond electric pulse effects on gene expression[J]. Journal of Membrane Biology, 2013,246(11): 851-859.
[11] Cemazar M, Grosel A, Glavac D, et al. Effects of electrogenetherapy with\r, p53wt\r, combined with cisplatin on survival of human tumor cell lines with different\r, p53\r, status[J]. DNA and Cell Biology,2003, 22(12): 765-775.
[12] Sersa G, Jarm T, Kotnik T, et al. Vascular disrupting action of electroporation and electrochemotherapy with bleomycin in murine sarcoma[J]. British Journal of Cancer, 2008, 98(2): 388-398.
[13] 姚陈果, 郭飞, 董守龙, 等. 纳秒脉冲处理A375细胞裸鼠皮下移植瘤的疗效评估[J]. 高电压技术,2013, 39(1): 117-121.Yao Chenguo, Guo Fei, Dong Shoulong, et al.Evaluation of the therapeutic effect of nanosecond pulse on the subcutaneous transplantation of A375 cells in nude mice[J]. High Voltage Engineering, 2013,39(1): 117-121.
[14] 李成祥, 郭飞, 姚陈果, 等. 裸鼠皮下人恶性黑色素瘤在纳秒脉冲电场下的凋亡机制[J]. 高电压技术, 2013, 39(4): 890-895.Li Chengxiang, Guo Fei, Yao Chenguo, et al.Apoptosis mechanism of human malignant melanoma in nude mice under nanosecond pulse electric field [J].High Voltage Technology, 2013, 39(4): 890-895.
[15] 姚陈果, 郭飞, 王建, 等. 纳秒脉冲电场治疗裸鼠皮下人恶性黑色素瘤模型的长期效应[J]. 高电压技术, 2012, 38(12): 3357-3362.Yao Chenguo, Guo Fei, Wang Jian, et al. Long-term effects of nanosecond pulsed electric field on subcutaneous human malignant melanoma model in nude mice[J]. High Voltage Engineering, 2012, 38(12):3357-3362.
[16] Garcia P A, Neal R E, Sano M B, et al. Experimental characterization and numerical modeling of tissue electrical conductivity during pulsed electric fields for irreversible electroporation treatment planning[J].IEEE Transactions on Biomedical Engineering, 2012,59(4): 1076-1085.
[17] Phillips M A, Narayan R, Padath T, et al. Irreversible electroporation on the small intestine[J]. British Journal of Cancer, 2012, 106(3): 490-495.
[18] Maor E, Ivorra A, Leor J, et al. The effect of irreversible electroporation on blood vessels[J].Technology in Cancer Research & Treatment, 2007,6(4): 307-312.
[19] Lee E W, Chen C, Prieto V E, et al. Advanced hepatic ablation technique for creating complete cell death:irreversible electroporation[J]. Radiology, 2010,255(2): 426-433.
[20] 米彦, 姚陈果, 李成祥, 等. 基于场-路复合模型的细胞内外膜跨膜电位时频特性[J]. 电工技术学报,2011, 26(2): 14-20.Mi Yan, Yao Chenguo, Li Chengxiang, et al.Time frequency characteristics of transmembrane potentials on cellular inner and outer membranes based on dielectric-circuit compound model[J].Transactions of China Electrotechnical Society, 2011,26(2): 14-20.
[21] Beebe S J, Fox P M, Rec L J, et al. Nanosecond, highintensity pulsed electric fields induce apoptosis in human cells[J]. Faseb Journal, 2003, 17(9): 1493-1495.
[22] Beebe S J, Fox P M, Rec L J, et al. Nanosecond pulsed electric field (nsPEF) effects on cells and tissues:apoptosis induction and tumor growth inhibition[J].IEEE Transactions on Plasma Science, 2002, 30(1):286-292.
[23] Kong M G, Kroesen G, Morfill G, et al. Plasma medicine: an introductory review[J]. New Journal of Physics, 2009, 11(11): 1-35.
[24] Schoenbach K H, Beebe S J, Buescher E S.Intracellular effect of ultrashort electrical pulses[J].Bioelectromagnetics, 2010, 22(6): 440-448.
[25] Agarwal A, Zudans I, Weber E A, et al. Effect of cell size and shape on single-cell electroporation[J].Analytical Chemistry, 2007, 79(10): 3589-3596.
[26] Ibey B L, Pakhomov A G, Gregory B W, et al.Selective cytotoxicity of intense nanosecond-duration electric pulses in mammalian cells[J]. Biochimica et Biophysica Acta, 2010, 1800(11): 1210-1219.
[27] Ivey J W, Latouche E L, Sano M B, et al. Targeted cellular ablation based on the morphology of malignant cells[J]. Scientific Reports, 2015, 5: 17157.
[28] 姚陈果, 吕彦鹏, 赵亚军, 等. 基于能量概率与微孔力模型的脉冲电场对细胞电穿孔动态过程的仿真分析[J]. 电工技术学报, 2016, 31(23): 141-149.Yao Chenguo, Lü Yanpeng, Zhao Yajun, et al.Simulation analysis of dynamic process of cell electroporation based on pulsed electric field based on energy probability and microporous force model[J].Transactions of China Electrotechnical Society, 2016,31(23): 141-149.
[29] 米彦, 孙才新, 姚陈果, 等. 基于等效电路模型的细胞内外膜跨膜电位频率响应[J]. 电工技术学报,2007, 22(6): 6-11.Mi Yan, Sun Caixin, Yao Chenguo, et al. Frequency response of transmembrane potential on cell inner and outer membrane based on equivalent circuit model[J].Transactions of China Electrotechnical Society, 2007,22(6): 6-11.
[30] 姚陈果, 刘红梅, 赵亚军, 等. 基于有限元分析的球形单细胞及不规则真实细胞电穿孔动态过程仿真[J]. 高电压技术, 2016, 42(8): 2479-2486.Yao Chenguo, Liu Hongmei, Zhao Yajun, et al.Simulation on the process of electroporation in spherical single-cell and irregularly shaped real cells based on finite elements analysis[J]. High Voltage Engineering, 2016, 42(8): 2479-2486.
[31] Yao Chenguo, Liu Hongmei, Zhao Yajun, et al.Analysis of dynamic processes in single-cell electroporation and their effects on parameter selection based on the finite-element model[J]. IEEE Transactions on Plasma Science, 2017, 45(5): 889-900.
[32] Zimmermann U, Pilwat G, Riemann F, et al. Dielectric breakdown of cell membranes[J]. Biophysics of Structure & Mechanism, 1974, 14(11): 881-899.
[33] 米彦, 彭文成, 芮少琴, 等. 高频纳秒脉冲串作用下皮肤肿瘤热效应的多参数有限元仿真与实验[J]. 电工技术学报, 2017, 32(22): 264-274.Mi Yan, Peng Wencheng, Rui Shaoqin, et al. Multiparameter finite element simulation and experiment of skin tumor thermal effect under high frequency nanosecond pulse train[J]. Transactions of China Electrotechnical Society, 2017, 32(22): 264-274.
[34] 米彦, 徐进, 刘宏亮, 等. 基于网格传输网络模型的高频纳秒脉冲串单细胞穿孔特性仿真[J]. 电工技术学报, 2018, 33(18): 4217-4230.Mi Yan, Xu Jin, Liu Hongliang, et al. Simulation of single-cell perforation characteristics of highfrequency nanosecond pulse train based on grid transmission network model[J]. Transactions of the China Electrotechnical Society, 2018, 33(18): 4217-4230.
[35] Bellard E, Teissié J. Double pulse approach of electropulsation: a fluorescence analysis of the nucleus perturbation at the single cell level[J]. IEEE Transactions on Dielectrics and Electrical Insulation,2009, 16(5): 1267-1272.
[36] Yao Chenguo, Lü Yanpeng, Gong Lingyu, et al.Targeted cell membrane damage by bipolar high repeated frequency pulses[J]. IEEE Transactions on Dielectrics & Electrical Insulation, 2017, 24(5): 3270-3282.
[37] Krassowska W, Filev P. Modeling electroporation in a single cell[J]. Biophysical Journal, 2007, 92(2): 404-417.
[38] Jin Yan, Yang L J, White F H. Preliminary assessment of the epithelial nuclear-cytoplasmic ratio and nuclear volume density in human palatal lesions[J]. Journal of Oral Pathology & Medicine,2010, 24(6): 261-265.